ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ. Функциональная биохимия
 Скачать 2.5 Mb. Скачать 2.5 Mb.
|
|
Антикоагулянты. Функциональные особенности системы свертывания крови и фибринолиза Антикоагулянты — вещества, предотвращающие свертывание крови. Естественные антикоагулянты синтезируются в тканях и поступают в кровь, где препятствуют активации факторов свертывания крови. К ним относятся гепарин, антитромбин - III и α2 - макроглобулин. Гепарин предотвращает активацию некоторых факторов, но непосредственно на них не действует. Гепарин способен активировать антитромбин- III. Являясь гетерополисахаридом, с больгшим содержанием карбоксильных и сульфогрупп, обладая высоким отрицательным зарядом, гепарин связывается с катионными участками антитромбина- III. В результате изменяется конформация антитромбина- III, и он приобретает способность инактивировать сериновые протеиназы. α2-макроглобулин — эндогенный ингибитор протеаз, в том числе многих ферментов, участвующих в работе системы свертывания крови и фибринолиза (тромбин, плазмин). Он содержит участки полипептидной цепи, гидролизуемые протеиназами, при этом меняется его конформация и 2-макроглобулин захватывает протеазы подобно капкану. Образующийся комплекс быстро удаляется из крови. Работа параферментов контролируется системой протеина С. Протеин С — гликопротеин, содержащий карбоксиглутаминовую кислоту, его синтез зависит от витамина К. Существует в крови в виде профермента, активируется тромбином. В этой системе участвует и интегральный белок мембран – тромбомодулин, только в присутствии которого тромбин активирует протеин С. В свою очередь специальный комплекс с протеином С частичным протеолизом инактивирует (в течение 3 мин) на 80% факторы свертывания Va и VIIIа. Ослабление этой системы приводит к тромбогенезу. ЛАБОРАТОРНЫЕ ЗАНЯТИЯ Определение содержания общего белка биуретовым методом Студент должен знать молекулярные механизмы свертывающей противосвертывающей систем крови, роль печени в этом процессе, молекулярную структуру коагуляторов, механизм гемофилий различного генеза, уметь определять биохимические показатели состояния свертывающей системы и давать им медикобиологическую оценку, знать нарушения вo фракционном составе белков плазмы крови. Содержание общего белка в сыворотке (плазме) крови является показателем состояния человеческого организма в норме (нормопротеинемия) или нарушения белкового обмена (гипо- и редко гиперпротеинемия) при различных заболеваниях желудочно-кишечного тракта, печени, сосудистой системы. Самым распространенным химическим методом количественного определения белков является колориметрический метод, основанный на биуретовой реакции. В щелочной среде пептидные связи белка переходят в енольную форму и образуют с Cu2+ комплексное соединение, окрашенное в фиолетовый цвет. 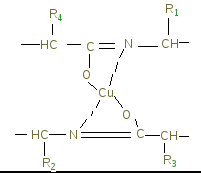 Окраска растворов при проведении биуретовой реакции варьирует от синей до красной с преобладанием фиолетовой и зависит от количества азота, участвующего в образовании комплекса. Чтобы рассчитать концентрацию белка, строят предварительно калибровочный график зависимости интенсивности окрашивания, измеряемой на ФЭКе от заведомого содержания белка в растворе. Оборудование и реактивы: фотоэлектрокалориметр, пробирки, пипетки, мерные колбы, раствор альбумина плацентарного 10%, сегнетова соль, медный купорос, калий иодистый, натрий хлористый, гидроксид натрия. Готовят биуретовый реактив, растворяя в мерной колбе на 250 мл 0,375г CuSO4Н2О и 1,5г сегнетовой соли в 150мл воды, приливая медленно 75мл 10% NaOH, и доводят содержимое до 250мл водой. Рабочий раствор биуретового реактива готовят, смешав 200 мл биуретового реактива с 800мл 0,5% раствора иодистого калия. Построение калибровочного графика Из калибровочного раствора плацентарного альбумина готовят рабочие калибровочные растворы, как указано в таблице:
Из каждого разведения берут 0,1 мл рабочего раствора и прибавляют по 5,0 мл рабочего биуретового реактива. Через 30 – 60 мин измеряют на ФЭКе оптическую плотность в кювете с толщиной слоя 1 см при длине волны 540 - 560 нм (зеленый светофильтр) против контроля (к 5 мл рабочего биуретового реактива прибавляют 0,1 мл 0,9% раствора хлористого натрия). По полученным данным строят калибровочный график. 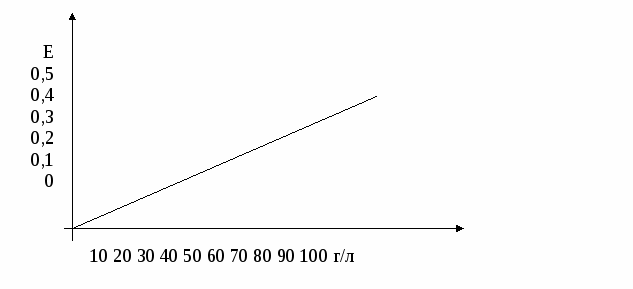 Ход работы. К 0,1мл сыворотки прибавляют 5,0 мл рабочего биуретового реактива и смешивают, избегая образования пены. Через 30 мин (и не позднее, чем через 1 час) измеряют оптическую плотность на ФЭКе, как при построении калибровочного графика против контроля (биуретового реактива). По калибровочному графику определяют содержание белка в пробе и выражают его далее с учетом разведения в процентах в целом препарате. Определение белковых фракций сыворотки крови турбидиметрическим методом Принцип метода: основан на том, что фосфатные растворы определенной концентрации осаждают с образованием очень мелкой взвеси различные белковые фракции крови. По степени мутности растворов (установленной с помощью фотоэлектрокалориметра) судят о концентрации различных фракций белков в исследуемом материале. Ход работы. Фосфатные буферные растворы различных концентраций от 0,5 до 3,0 М разливают в 7 пробирок по схеме:
Затем в 6-ю пробирку добавляют 0,5 мл сыворотки, содержимое перемешивают. В пробирки 1, 2, 3, 4 и 5 переносят из пробирки 6 по 0,5 мл полученной смеси, в пробирку 0 – 1 мл той же смеси. Содержимое пробирок осторожно перемешивают, через 15 мин вновь осторожно перемешивают и измеряют светопоглощение растворов 1-5. Светофильтр № 8 (красный), при длине волны 600 нм, в кювете с толщиной слоя 1,0 см. Фотометрируют против раствора пробирки 0. Одновременно определяют общий белок сыворотки крови биуретовым методом. Расчет и результаты : Е1, Е2, Е3, Е4, Е5, Еобщ. белок.
Диагностическое значение анализа: при различных патологических состояниях, как правило, изменяется не общий белок крови, а состояние между белковыми фракциями. Общий белок сыворотки. Уменьшение белка имеется у новорожденных и при беременности. Увеличивается при длительном пребывании в горах, употреблении пищи, богатой белками. Гипопротеинемия наблюдается при недостаточном поступлении белка в пищу (недоедание, голодание, опухоли, стеноз пищевода, привратника, нарушение функции желудочно-кишечного тракта), при снижении процессов биосинтеза белка (хронические гепатиты, циррозы печени). Содержимое альбуминов уменьшается при недостатке белка в пище, нефрозе, воспалительных процессах, циррозе печени, злокачественных новообразованиях, кровотечениях. Белки острой фазы (1, 2 глобулины) повышаются при острых инфекциях, острых нефрозах, остром ревматизме. Концентрация -глобулинов увеличивается при злокачественных новообразованиях, нефрозах, застойной желтухе. -глобулины увеличиваются при хронических воспалительных процессах – хроническом полиартрите, циррозах печени. Контрольные вопросы 1. Что такое плазма крови? 2. Что такое сыворотка крови? 3. Каков химический состав плазмы крови? 4. Перечислить основные белковые фракции плазмы. Каковы количественные соотношения отдельных фракций? 5. Дать определение понятиям диспротеинонемия, гипопротеинемия, гиперпротеинонемия. Причины, их возвышающие. 6. Причины и механизм развития «голодных отеков». 7. Дать краткую характеристику альбуминам крови. Указать молекулярную массу, биологические функции. 8. Белки какой фракции крови вносят наибольший вклад в онкотическое давление крови? Почему? 9. Дать краткую характеристику 1-глобулиновой фракции. 10. Дать краткую характеристику 2-глобулиновой фракции. 11. Дать краткую характеристику -глобулиновой фракции. 12. Дать краткую характеристику -глобулиновой фракции. Задача'>Задачи Задача 1. Гирудин, получаемый из пиявок, специфически взаимодействуют с тромбином и активирует его. Для профилактики каких заболеваний используют гирудин? Задача 2. Дикумарол и варфарин являются структурными аналогами витамина К и применяются в клинике как антикоагулянты для профилактики тромбозов. Поэтому эти лекарства не влияют на свертывание крови invitro? Задача 3. Гепарин использовать при лечении и профилактике тромбозов. Почему при дефиците антитромбина III гепарин не оказывает лечебного действия? Задача 4. Ряд тяжелых заболеваний почек сопровождается отеками, обусловленными альбуминурией. Почему при альбуминурии развиваются отеки? Задача 5. В клинике дикумарол используется для предупреждения образования тромбов. В чем основано такое применение дикумарола? Задача 6. Если допустить, что каждый этап каскада протеолитических реакций свертывания крови сопровождается образованием 100 молекул соответствующего активного фактора свертывания под действием одной молекулы предшествующего фактора, то сколько молекул фибрина образуется в результате каскада реакций, начиная с активации фактора Хагемана (ХII)? Рекомендуемая литература 1. Николаев А.Я.. Биологическая химия. М., Медицинское информационное агентство, 2004. Стр. 26-28, 131, 315 -323. 2. Биохимия. Краткий курс с упражнениями и задачами. Под ред. Е.С. Северина, А.Я. Николаева. М., «ГЭОТАР –Медиа», 2002. Стр. 502 -517. 3. Березов Т.Т., Коровкин Б.Ф.. Биологическая химия. М., Медицина, 1998. Стр. 568 -574, 577-580, 599 - 607. 4. Бышевский А. Ш., Терсенев О.А.. Биохимия для врача. Екатеринбург, «Уральский рабочий», 1994. Стр. 163 -172, 266 - 273, 281 -291. 5 . Р. Марри, Д. Гриннер, П. Мейес, В. Родуэлл. Биохимия человека. В 2-х томах. М., Мир, 2004 . (2-й том). Стр. 319 -330. 6. Биохимия. Под ред. Е.С. Северина, М., «ГЭОТАР-Мед», 2008, стр. 654-673. ЭЛЕКТРОЛИТНЫЙ СОСТАВ ПЛАЗМЫ КРОВИ. РЕГУЛЯЦИЯ ОБМЕНА Са2+ И ФОСФАТОВ Известно, что 5% от массы тела составляет вода в сосудистом русле. Распределение электролитов в плазме очень специфично по своему количественному и качественному составу. Из катионов плазмы натрий занимает ведущее место и составляет 93% от всего их количества. Это основной осмотически активный ион и составляет 132 – 150 ммоль/л и в 8 раз выше, чем в эритроцитах. При гипернатриемии развивается гипергидратация организма (при паренхиматозном нефрите, сердечной недостаточности, гиперальдостеронизме). Гипорнатриемия сопровождается дегидратацией организма. Калий в плазме составляет 3,8 – 5,4 ммоль/л, в эритроцитах его в 20 раз больше, т.е. в клетках его концентрация значительно выше, чем во внеклеточном пространстве. Поэтому клеточный распад или гемолиз ведет к увеличению калия в сыворотке крови. Гиперкалиемия наблюдается при острой почечной недостаточности и гипофункции коркового вещества надпочечников, которое выделяет альдостерон, а это уже в свою очередь усиливает выделение с мочой натрия и задержку калия в организме. При усиленной продукции альдостерона, наблюдается обратная картина. Это приводит к нарушению сердечной деятельности, что отражается на ЭКГ. Регуляция содержания вышеуказанных катионов см. в теме «Мочеобразование и свойства мочи» где описана ренин-ангиотензионная система. Магний в организме локализуется в основном внутри клетки – 15 ммоль/кг массы тела, в плазме 0,8 - 0,5 ммоль/в, в эритроцитах 2,4 – 2,8 ммоль/л, в мышцах его содержание в 10 раз больше, чем в плазме, поэтому потеря его из плазмы восполняется из мышечного депо. Железо и его обмен см. в занятии, посвященному гемоглобину, т.к. этот элемент связан с функцией гемоглобина. Микроэлементы в плазме содержатся в ничтожных количествах (106 -1012%). Это йод, медь, цинк, кобальт, селен, молибден и др. В основном они связаны с белками (медь – в церуллоплазмеине, цитохромоксидазе, цинк связан с карбоангидразой, инсулином, йод в тироксине, Со – в витамине В12, эритропоэтине, Se – в глутатионпероксидазе, Мо – в ксантиноксидазе). Из анионов плазмы важнейшими являются бикарбонат и ион Cl (см. газовый обмен и буферные системы крови). Фосфаты теснейшим образом связаны с ионами кальция в составе малорастворимых кристаллов гидроксиаппатита 3Са3(РО4)2Са(ОН)2Н2О, (99% всего Са) и 1% кальций-фосфатных солей может легко обмениваться и играть роль буфера при понижении кальция в плазме. В плазму кальций поступает не только из костной ткани, но и из кишечника (с водой и пищей). В организме взрослого человека в среднем содержится 1000г кальция. Са2+ не только структурный компонент костей, но и запускает мышечное сокращение, влияет на проницаемость Na+ при передаче нервного импульса, способствует секреции гормонов, участвует в свертывании крови, служит вторичным посредником в гормональной деятельности. Норма в плазме 2,12- 2,6 ммоль/л, где он может быть в виде ионов в свободном состоянии, связанным с белками, недиссоциированном виде в составе цитратов, оксалатов, карбонатов. Изменение содержания кальция влияет на все вышеуказанные процессы, в результате чего нарушается нормальный метаболизм. Основными регуляторами обмена кальция являются гормоны: паратгормон, кальцитриол и кальцитонин. Источником синтеза кальцитриола служит витамин D3, который образуется в коже под действием УФ-лучей из 7-дегидрохолестерола: 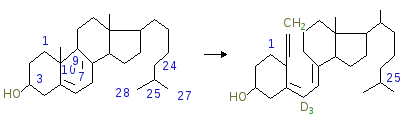 Так синтезируется большая часть витамина D3; небольшое его количество поступает с жирами пищи. Связавшись со специфическим белком, он поступает в кровь и транспортируется в печень, где происходит его гидроксилирование по С25 с образованием кальцидиола. Синтез кальцитриола заканчивается в почках с включением атома кислорода к С1 и т.о. витамин D3 можно рассматривать как прогормон. Почечную гидроксилазу по аденилатциклазной системе активирует паратгормон белковой природы, синтезирующийся в паращитовидных железах. Кроме того, паратгормон стимулирует мобилизацию Са2+ из внутренних резервов клеток почек и костной ткани (из остеобластов и остеоцитов), что идет особенно интенсивно при понижении уровня Са2+ Кальцитриол, как гормон стероидной природы связывается с цитозольным рецептором клетки-мишени (тонкий кишечник, почки и кости). Взаимодействуя с хроматином, он индуцирует транскрипцию Ca2+ -связывающих белков, которые переносят ионы кальция из кишечника в кровь. В почках кальцитриол стимулирует реабсорбцию ионов Са2+ и фосфатов, где паратгормон снижает экскрецию кальция с мочой и уменьшает реабсорбцию фосфатов. Кальцитонин, полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью, секретирующийся К-клетками щитовидной железы или С-клетками паращитовидных желез. Кальцитонин антогонист паратгормона. Он ингибирует высвобождение Са2+ из кости, снижая активность остеокластов, подавляет кальциевую реабсорбцию в печеночных канальцах, особенно у женщин, что приводит к остеопорозу. При нарушении обмена кальция и фосфатов: 1) подавляется секреция паратгормона при гиперкальциемии (опухоль околощитовидной железы, диффузная гиперплазия желез, рак паращитовидной железы); 2) избыточная секреция паратгормона приводит к повышению мобилизации кальция и фосфатов из костной ткани (гиперкальциемия, приводящая к снижению нервно-мышечной возбудимости, быстрая утомляемость, риск переломов костей); 3) при хронической почечной недостаточности и дефиците витамина D3, нарушается всасывание кальция, т.к. угнетается синтез кальцитриола. У больных развивается остеопороз, в детском возрасте – рахит, связанный с недостаточной минерализацией кости (дефицит кальция), недостаток или нарушение всасывания витамина D3, недостаточное пребывание на солнце. При рахите поражаются кости черепа, грудная клетка выступает вперед, деформируются трубчатые кости, увеличивается и выпячивается живот, задерживается развитие. В этом случае ребенок должен правильно питаться и достаточно находится на солнце. ЛАБОРАТОРНОЕ ЗАНЯТИЕ |
