ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ. Функциональная биохимия
 Скачать 2.5 Mb. Скачать 2.5 Mb.
|
|
Нарушения биосинтеза гема. Порфирии Наследственные порфирии обусловлены генетическими дефектами ферментов, участвующих в синтезе гема, за исключением аминолевулинатсинтазы. При этих заболеваниях отмечают снижение образования гема. Поскольку гем - аллостерический ингибитор аминолевулинатсинтазы, то активность этого фермента повышается, и это приводит к накоплению промежуточных продуктов синтеза гема - аминолевулиновой кислоты и порфириногенов (уропорфирогена I, выделяющегося в больших количествах с мочой, т.к. он не дает нужного протопорфирина IX, нужного для синтеза гема). При тяжёлых формах порфирии наблюдают нейропсихические расстройства, нарушения функций РЭС, повреждения кожи. Порфириногены не окрашены и не флуоресцируют, но на свету они легко превращаются в порфирины. В этом случае моча окрашена в красный цвет. Последние проявляют интенсивную красную флуоресценцию в ультрафиолетовых лучах. В коже на солнце в результате взаимодействия с порфиринами кислород переходит в синглетное состояние. Синглетный кислород вызывает ускорение ПОЛ клеточных мембран и разрушение клеток, поэтому порфирии часто сопровождаются фотосенсибилизацией и изъязвлением открытых участков кожи. Нейропсихические расстройства при порфириях связаны с тем, что аминолевулинат и порфириногены являются нейротоксинами. Такие больные на фоне анемии, испытывают неосознанную потребность в свежей крови. Иногда при лёгких формах наследственных порфирии заболевание может протекать бессимптомно, но приём лекарств, являющихся индукторами синтеза аминолевулинатсинтазы, может вызвать обострение болезни. Индукторами синтеза аминолевулинатсинтазы являются такие известные лекарства, как сульфаниламиды, барбитураты, диклофенак, вольтарен, стероиды, гестагены. В некоторых случаях симптомы болезни не проявляются до периода полового созревания, когда повышение образования β-стероидов вызывает индукцию синтеза аминолевулинатсинтазы. Порфирии наблюдают и при отравлениях солями свинца, так как свинец ингибирует аминолевулинатдегидратазу и феррохелатазу. Некоторые галогенсодержащие гербициды и инсектициды являются индукторами синтеза аминолевулинатсинтазы, поэтому попадание их в организм сопровождается симптомами порфирии. При изучении статической биохимии были рассмотрены виды гемоглобина, гемоглобинозы и значение 2,3-дифосфоглицерата. (Образование токсичных форм кислорода и роль пентозного цикла распада глюкозы, обеспечивающего целостность эритроцита см. в темах «Биологическое окисление» и «Анаэробное окисление глюкозы».) Выше указывалось, что регуляторную функцию биосинтеза гема выполняет железо и его особенности обмена. Обмен железа Содержание и функция железа. В организме содержится 4—5 г железа: в виде резервного (1/4) и функционально-активного (3/4). 62—70 % железа находится в гемоглобине эритроцитов, 5—10 % — в миоглобине, остальное — в тканях, где оно участвует во многих метаболических процессах: в составе энзимов—цитохромов, которые обеспечивают митохондриальный транспорт электронов, синтез ДНК и деление клеток, метаболизм гормонов мозгового вещества надпочечников, детоксикационные механизмы, с участием цитохрома Р450. Резервное железо постоянно переходит в функциональное и обратно. Так, за счет повторного использования костный мозг получает ежесуточно 20—25 мг железа. Потребность. Ежедневная потребность в железе, абсорбируемом из пищи в организме человека, составляет: у детей от 0 до 4 месяцев жизни — 0,5 мг/день, от 1 года до 12 лет— 1,0 мг/день, женщины детородного периода — 2,8 мг/день (во время менструации потери железа составляют от 5 до 45 мг), молодые мужчины — 1 мг/день, старики — 0,9 мг/день, беременные женщины — 3-3,5 мг/день. В организм последних за время беременности должно поступать до 1 г железа (500 мг железа используется для синтеза дополнительного количества гемоглобина в организме беременной, 300 мг Fe2+ необходимо формирующемуся плоду и 200 мг Fe2+ компенсируют естественные потери металла организмом беременной женщины). Всасывание железа. В пище железо в основном находится в окисленном состоянии (Fe3+) в виде солей или в составе белков. Его освобождение происходит в кислой среде желудка, а в 12-перстной кишке восстанавливается до Fe2+ аскорбиновой кислотой и всасывается в кишечнике из пищи. Fe2+ в кишечном содержимом вначале связывается с белком-рецептором на поверхности эпителия слизистой оболочки кишки (b3-интегрином), что необходимо для перехода его через мембрану клетки слизистой в цитозоль. Далее, образовав комплекс с цитозольным транспортным белком-мобилферрином, Fe2+ пересекает клетку эпителия слизистой кишечника, оставаясь в этом комплексе вплоть до поступления Fe2+ в капиллярную сеть кишечника. Апоферритин улавливает избыточное железо в клетках слизистой оболочки кишечника. Трансляция этого белка также зависит от IRE элемента на м-РНК, к которому присоединяется избыток железа и инициирует синтез апофферитина. Образуется ферритин, который слущивается с эпителия кишечника при превышении потребности железа в организме. Факторы, влияющие на абсорбцию железа. Абсорбции железа эпителиальными клетками желудочно-кишечного тракта способствуют сниженное насыщение трансферрина железом и повышенная эритропоэтическая активность крови. Абсорбция снижается при увеличении концентрации железа в клетках слизистой оболочки кишечника. В кишечнике более эффективна абсорбция Fe2+, чем Fe3+. Поэтому аскорбиновая кислота, фруктоза, аминокислоты (цистеин, метионин) поддерживают двухвалентную форму железа и ускоряют его абсорбцию. В кишечнике лучше абсорбируется биодоступное железо, входящее в состав гема (мясные продукты, кровяная колбаса), чем железо из пищи растительного происхождения. Абсорбция Fe2+ в желудочно-кишечном тракте зависит от возраста человека, функционального состояния его организма. Она наиболее высокая у детей первых месяцев жизни и достигает 57 %, у 7— 10-летних —7,75-17,75 %, у взрослых мужчин и женщин — 1,1-11,2 % и у беременных женщин — 20 % от поступившего в желудочно-кишечный тракт железа. Транспорт железа. С выходом в кровоток двухвалентное железо окисляется до трехвалентного белком плазмы крови церрулоплазмином (ферроксидазой) и присоединяется к трансферрину, гликопротеину плазмы крови. Трансферрином Fe3+ доставляется к тканям и используется в митохондриях эритробластов для синтеза гема, депонируется в макрофагах в виде резерва. Скорость поступления железа в неэритроидные клетки зависит от количества белков – рецепторов трансферрина в их мембране. Синтез рецепторов как и апоферритина регулируется на уровне трансляции этих белков и зависит от содержания железа в клетке. Однако, в отличие от апоферритина, железочувствительные элементы IRE м-РНК рецепторов находятся на 3′ конце. При низких концентрациях железа IRE железочувствительный белок защищает м-РНК рецепторов от разрушения и количество рецепторов увеличивается. При повышении содержания железа в клетке, как указывалось ранее, трансляция апоферритина ускоряется, а скорость синтеза рецепторов трансферрина снижается. Таким образом, эти механизмы регулируют содержание и использование железа для синтеза железосодержащих белков. Плазма содержит от 1,8 до 2,6 мг/л трансферрина, 1 мг которого связывает 1,25 мкг Fe. В общем объеме плазмы содержится около 3 мг Fe2+. В норме лишь 1/3 трансферрина плазмы насыщена железом. Количество железа, которое может быть связано трансферрином, называется общей железосвязывающей способностью крови и в норме составляет 250—400 мкг % (45— 72 мкмоль/л). Концентрация железа в сыворотке крови колеблется от 50 до 160 мкг % (9—29 мкмоль/л). С мочой выводится за сутки 60—100 мкг железа. Резервирование. Освобождение железа из комплекса трансферрин — железо обеспечивается энергией молекул АТФ, образуемых в эритробластах. Молекула трансферрина, отдавшая железо, смещается с мембранного участка молекулами трансферрина, связанными с железом, поскольку их сродство к рецепторам более сильное. Железо, поступившее в эритробласт, используется в митохондриях для синтеза гема и депонируется в эритробласте в виде резерва. В макрофагах печени и костного мозга резервное железо депонируется в молекуле ферритина. Внутри лизосом молекулы ферритина образуют большие аморфные нерастворимые агрегаты — гемосидерин. Его накопление в клетках печени и селезенке может привести к повреждению функций этих органов. Таким образом, ферритин и гемосидерин — это формы резервного железа в клетках. Из клеточного резерва железо освобождается в двухвалентном состоянии (благодаря энзиму ксантиноксидазе, аскорбиновой кислоте и др.), затем церулоплазмин окисляет Fe2+ до трехвалентного состояния, Fe3+ соединяется с трансферрином и транспортируется с плазмой крови к эритробластам. Печень может депонировать до 700 мг железа. Гемосидерин плохо растворим в воде и содержит 37% железа. Накопление гранул гемосидерина в печени, селезенке, поджелудочной железе приводит кповреждению этих органов – гемохроматозу (отложение пигмента ржавого цвета). Накопление гемосидерина в β-клетках панкреса приводит к их разрушению и как следствие, к сахарному диабету; в печени гемосидерин вызывает цирроз; в миокардиоцитах – сердечную недостаточность. К гемохроматозу могут привести частые переливания крови, в этих случаях больных лечат препаратами, связывающими железо. Анемии. Дефицит железа в организме человека приводит к развитию гипохромной анемии и к гипоксии. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном, увеличение — о гиперхромном содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В2-дефицитной анемии, гипохромия — для железодефицитной анемии. Анемия может развиться и при недостатке меди, входящей в состав трансферина, кобальта - составной части эритропоэтина, витамина В12, фолиевой кислоты, ионов натрия и хлора, участвующих в образовании соляной кислоты, необходимой для всасывания в кровь витамина В12; нарушении синтеза гема; мутации в генах гемоглобина (гемоглобинозы); при обширном гемолизе эритроцитов; кровопотерях; при заболеваниях печени; почечной недостаточности; при инфекционных заболеваниях и т.д. Дыхательная функция крови Эритроциты являются главным участником транспорта газов кровью за счет гемоглобина. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в легких, так как каждый протомер (22) за счет Fe2+ присоединяет координационной связью молекулу кислорода О2. Кислород, присоединяясь к первой -частице гемоглобина, вызывает конформационные изменения в последующих протомерах, что приводит к увеличению сродства к кислороду (4-я -субчастица в 300 раз скорее присоединяет молекулу кислорода, по сравнению с первой ). Благодаря кооперативной работе протомеров кривая насыщения гемоглобина кислородом имеет S – образную форму и характеризует сродство гемоглобина кислороду (см. физиологию). Эта кооперативность обеспечивает не только связывание максимального количества кислорода, но и освобождение его в тканях. Этому способствуют Н+ и СО2, в свою очередь, кислород ускоряет высвобождение СО2 и Н+ в легочной ткани. Эта аллостерическая зависимость между присоединением Н+, О2 и СО2 получила название эффекта Бора. Присоединение О2 и его отдача тканям происходит в результате разницы парциального давления кислорода в воздухе, альвеолах и тканях (в воздухе – 157 мм рт.ст., в альвеолах – 100, в тканях 35 мм рт.ст. соответственно). При насыщении гемоглобина кислородом увеличивается кислотность гемоглобина, причем HHbO2 как кислота сильнее Н2СО3, а последняя сильнее дезоксигемоглобина HHb. Известно, что сильные кислоты вытесняют более слабые из их солей. СО2 в тканях образуется в результате метаболизма (реакции декарбоксилирования); в эритроцитах работает карбоангидраза – фермент катализирующий обратимую реакцию: СО2 + Н2О КА Н 2СО3. В эритроцитах превалируют соли К+, в плазме – Na+. H HbO2 H2CO3 H Hb 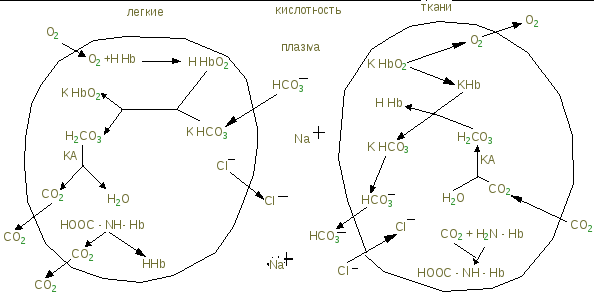 За счет содержания Hb в крови (15%), каждые 100 мл крови переносят в ткани 20 об. % О2 (1 г Hb присоединяет 1,34 мл О2. Плазма за счет простого растворения кислорода может перенести только 0,3 мл на 100 мл. Углекислый газ более растворим и каждые 100 мл плазмы может перенести 6 – 8% 13 мл 100 мл крови всего углекислого газа, 12% за счет карбгемоглобина, когда СО2 присоединяется к -NH2 полипептидных и -цепей, и основное количество СО2 переносится бикарбонатным путем (80%), когда в эритроцитах тканей образуется НСО3, а в альвеолах НСО3 превращается в Н2СО3 и посылает в выдыхаемый воздух СО2. Ионы Н+, СО2 уменьшают сродство гемоглобина к О2. Помимо этого отдачу О2 тканям повышает 2,3-бифосфоглицерат БФГ, синтезируемый эритроцитами в процессе гликолиза из 1,3-бифосфоглицерата N БФГ - 5 ммоль/л крови, при понижении парциального давления О2 (у горцев) концентрация БФГ = 8 мл/л, что увеличивает снабжение тканей кислородом, т.е спасает их от гипоксии. Такая гипоксия называется экзогенной. Однако она может возникнуть и в шахтах, при неполадках в системах кислородообеспечения летательных аппаратов, подводных лодок, наркозной аппаратуры. Гипоксия может возникнуть и при патологических процессах в связи с нарушением проходимости дыхательных путей (спазм, инородные тела, воспалительный процесс), уменьшением дыхательной поверхности легких (отек, пневмония). Обычно такая гипоксия сопровождается гиперкапнией (накопление углекислого газа). Сердечно-сосудистый тип гипоксии наблюдается при нарушении кровообращения; кровяной тип возникает при уменьшении эритроцитной массы или понижении содержания гемоглобина, отравлении угарным газом и т.д. Наконец, тканевой тип гипоксии обуславливается нарушением способности тканей поглощать кислород (отравление цианидами или другими ингибиторами биологического окисления, повреждения мембранных структур клетки, или нарушение синтеза ферментов биоокисления). Буферные системы крови Кровь способна противодействовать изменению рН при увеличении концентрации Н+ или щелочных ионов, т.е. поддерживать постоянство значения своего рН, которое в норме колеблется от 7,37 до 7,44. Снижение величины рН ниже 6,8 или возрастание до 8,0 несовместимые с жизнью, в клинике практически не встречаются. Кровь представляет собой взвесь клеток в жидкой среде, поэтому ее кислотно-основное равновесие поддерживается совместным участием буферных систем плазмы и клеток крови. Такие системы состоят из слабой кислоты и ее соли с сильным основанием или слабого основания с солью сильной кислоты. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая. Бикарбонатная буферная система - самая управляемая система внеклеточной жидкости: на ее долю приходится около 10% всей буферной емкости крови. В данной системе донором протонов является Н2СО3, а акцептором бикарбонат-ион НСО3. При выделении в кровь больших количеств кислых продуктов, водородные ионы Н+ взаимодействуют с НСО3 образуя Н2СО3, которая выделяет СО2 через легкие в результате их гипервентиляции. Если в крови увеличивается количество оснований, то они взаимодействуют со слабой угольной кислотой, образуя ионы бикарбонатов и воду. При этих взаимодействиях не происходит заметных сдвигов в величине рН и в плазме задерживается некоторое количество СО2 в результате гиповентиляции легких. Данная буферная система тесно связана с гемоглобиновой системой, которая в 9 раз мощнее бикарбонатного буфера и составляет 75% всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. Диссоциация кислотных групп гемоглобина меняется от его насыщения кислородом (ННbO2 более сильная кислота, нежели HHb). В паре с ними работают их соли KHbO2 и KHb, выполняющие функции сопряженных оснований. Системы гемоглобина и оксигемоглобина являются взаимопревращающимися и существуют как единое целое. Кислые соединения реагируют с калиевой солью гемоглобина: KHb + H2CO3 KHCO3 + HHb, что поддерживает рН крови в пределах допустимых величин. В капиллярах легких HHbO2 подкисляет кровь и понижает щелочной резерв. Белковая буферная система имеет меньшее значение для поддержания кислотно-основного равновесия (14%) в плазме крови, чем другие буферные системы. Благодаря наличию кислотно-основных групп (-СОО и -N+H3) она может быть донором протонов и их акцептором, в результате чего эффективна в области значений рН 7,2-7,4. Фосфатная буферная система составляет 1% от буферной системы крови и представляет собой сопряженную кислотно-основную пару Н2РО4 (донор протонов) и НРО Нарушения кислотно-основного равновесия (КОР) Если компенсаторные механизмы организма не могут предотвратить сдвиги концентрации водородных ионов, то КОР нарушается и могут наблюдаться два противоположных состояния – ацидоз и алкалоз. При ацидозе рН крови уменьшается и ниже 6,8 – вызывает смерть, если рН возрастает до 8, то такое состояние также не совместимо с жизнью. В зависимости от механизмов развития нарушений КОР, выделяют дыхательный и метаболический ацидоз (или алкалоз). Дыхательный ацидоз возникает в результате гиповентиляции легких при уменьшении объема дыхания (астма, эмфизема, отек легких), что ведет к накоплению СО2 и Н2СО3 в плазме (гиперкапния). рН крови снижается и повышается выведение с мочой свободных кислот или их аммонийных солей. Метаболический ацидоз - частая и тяжелая форма нарушения КОР, обусловлен накоплением в тканях органических кислот (лактата или кетоновых тел). Такое возможно при голодании, лихорадке и особенно при диабете при недостаче инсулина. Метаболический ацидоз ведет к компенсаторному выделению СО2 в бикарбонатной системе, а это в свою очередь ведет к понижению и НСО3, что ведет к неблагоприятным последствиям. Дыхательный алкалоз возникает при резко усиленной вентиляции легких, сопровождающейся быстрым выделением из организма СО2 и развитием гипокапнии (понижение парциального давления углекислого газа в крови). Данный вид алкалоза наблюдается при вдыхании чистого кислорода, пребывание в разреженной атмосфере, при возбуждении дыхательного центра барбитуратами и т.п. За несколько минут внеклеточная жидкость может иметь значение рН до 7,65 и при этом снижается щелочной резерв крови ввиду превращения НСО3 в Н2СО3. Метаболический алкалоз развивается при потере большого количества кислых эквивалентов (неукротимая рвота, всасывание основных эквивалентов кишечного сока и накопление основных эквивалентов в тканях). При метаболическом алкалозе повышается концентрация НСО3 в плазме, компенсирующая урежением частоты дыхания с задержкой СО2. Кислотность мочи и содержание NH3 в ней понижены. В клинической практике специальными приборами измеряют рН, РСО2 (парциальное давление углекислого газа) и концентрацию бикарбоната в плазме. Норма НСО3 = 25 ммоль/л, РСО2 = 53,3 гПа (40 мм рт.ст.), Н2СО3 = 0,625 мл/л. ЛАБОРАТОРНЫЕ ЗАНЯТИЯ ПО БИОХИМИИ КРОВИ |
