ФУНКЦИОНАЛЬНАЯ БИОХИМИЯ. Функциональная биохимия
 Скачать 2.5 Mb. Скачать 2.5 Mb.
|
| |||||||||||||||||||||||||||
| Признак | Желтухи | ||
| механическая | паренхиматозная | гемолитическая | |
| Свободный билирубин крови | Не изменен | Незначительно повышен | Резко повышен |
| Связанный билирубин крови (глюкуронид) | Резко повышен | Значительно повышен | Незначительно повышен |
| Билирубин мочи (глюкуронид, прямой) | Значительно повышен | Незначительно повышен | Не изменен |
| Уробилиноген мочи | Не изменен или снижен | Значительно повышен | Резко повышен |
| Стеркобилин кала | Снижен | Снижен или тот же | Тот же |
Проба Гмелина на желчные пигменты
Ход работы. В пробирку наливают 10 капель концентрированной азотной кислоты содержащей следы азотистой кислоты и осторожно, пипеткой наслаивают на нее исследуемую мочу (примерно 1 мл). При наличии в моче желчных пигментов на границе кислоты и мочи появляется слой цветных колец, возникающих в результате образования продуктов окисления билирубина. Особенно характерным является зеленое кольцо.
Диагностическое значение анализа. Увеличение содержания билирубина в крови (гипербилирубинемия) наблюдается при желтухах (гемолитической, обтурационной, печеночно-клеточной).
Проба Богомолова на уробилин
Ход работы. К 10-15 мл мочи прибавить 2-3 млнасыщенного раствора сульфата меди. Если получается помутнение от образовавшегося гидроксида меди, то прибавить несколько капель соляной кислоты до просветления раствора. Через 5 минут прибавить 2-3 мл хлороформа или толуола и взболтать.
Диагностическое значение анализа. Уробилин - продукт окисления бесцветного уробилиногена, в малых количествах выделяется с мочой (3, 2 мг). Определение концентрации желчных пигментов в моче имеет значение для дифференциации видов желтух: увеличение – гемолитическая желтуха, отсутствие - обтурационная желтуха.
Контрольные вопросы к теме биохимия печени
1. Роль печени в углеводном обмене.
2. Роль печени в липидном обмене.
3. Роль печени в белковом обмене.
4. Механизм детоксикации чужеродных веществ в печени.
5. Химический состав желчи.
6. Какие «защитные» синтезы протекают в печени?
7. Участие печени в обмене а) головного мозга; б) мышечной ткани; г) почек.
8. Как осуществляется распад гемоглобина в тканях?
9. Какие вещества называют желчными пигментами?
10. Напишите формулу билирубина. Что такое «прямой» и «непрямой» билирубин? Каковы их синонимы?
11. В каком организме происходит образование билирубинглюкуронидов? В чем биологический смысл этого процесса?
12. Напишите реакцию образования билирубин-диглюкуронида.
13. Каково содержание билирубина в сыворотке крови в норме?
14. Перечислите виды желтух. Лабораторная диагностика желтух.
15. Какие превращения происходят с билирубином в кишечнике?
16. Какие продукты превращения билирубина можно обнаружить в моче в норме и при патологии?
Контрольные задачи
Задача 1. В результате жизнедеятельности кишечной микрофлоры образуется ряд соединений, токсичных для организма, например скатол:
А. Из какой аминокислоты образуется скатол?
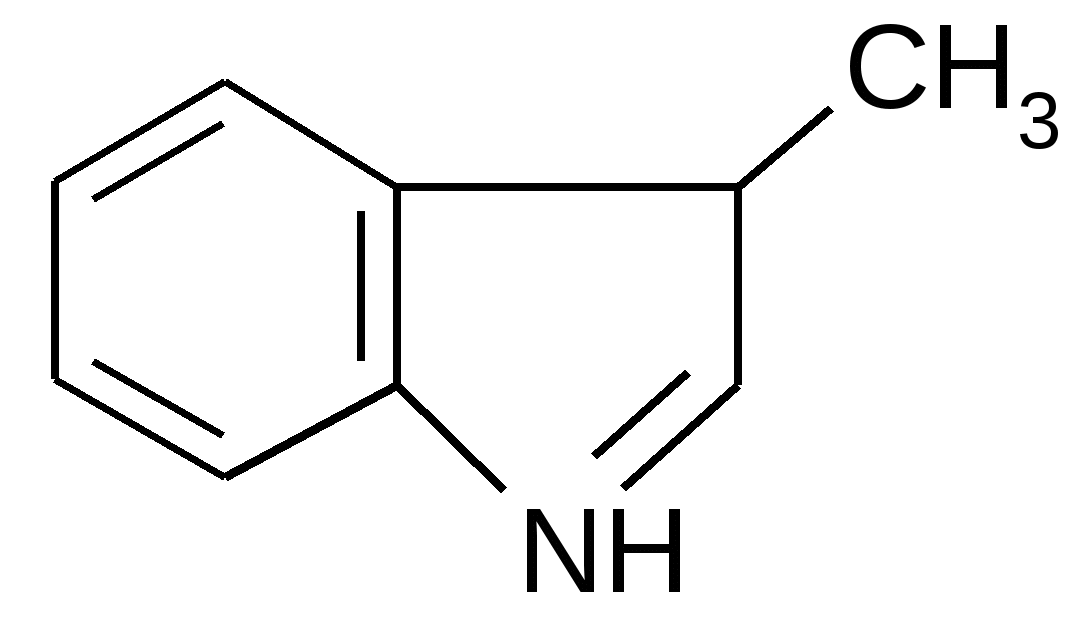
Б. Составьте схему процесса микросомального окисления скатола, используя перечисленные ниже компоненты:
1. О2;
2. Цитохром Р450;
3. НАДФН- дегидрогеназа;
4. Fе2+ - белок.
В. Напишите формулами реакции дальнейшего обезвреживания этого соединения в организме.
Задача 2. При лечении хронического алкоголизма применяют тетурам, в результате чего происходит накопление в организме уксусного альдегида.
А. Напишите схему метаболизма этанола до стадии образования уксусной кислоты.
Б. Какой фермент ингибируется при лечении тетурамом?
Задача 3.
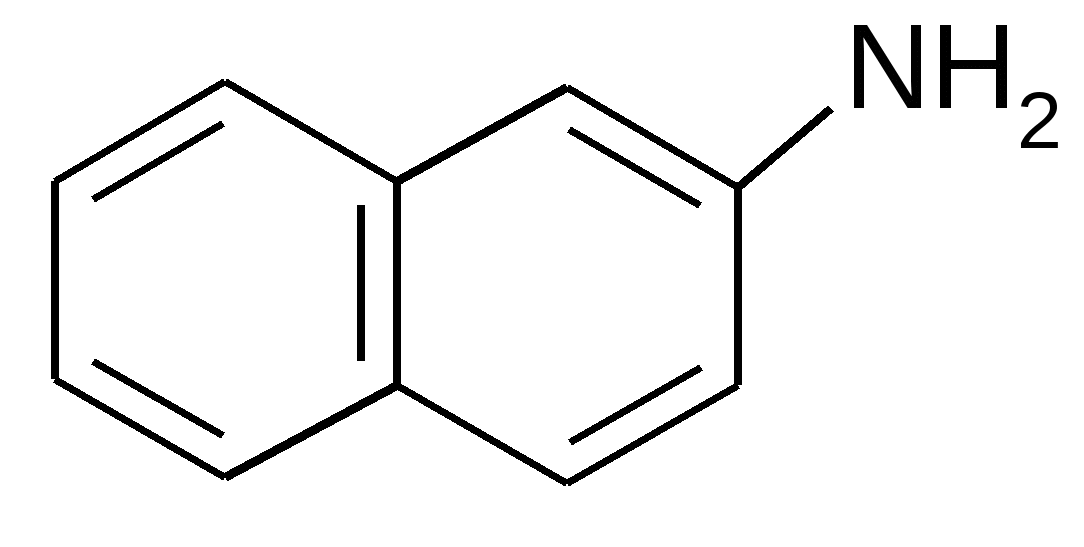 -2-нафтиламин, относящийся к группе ароматических аминов. Используется в производстве анилиновых красителей. Известно, что путь «обезвреживания» в организме этого соединения включает микросомальное окисление реакции конъюгации.
-2-нафтиламин, относящийся к группе ароматических аминов. Используется в производстве анилиновых красителей. Известно, что путь «обезвреживания» в организме этого соединения включает микросомальное окисление реакции конъюгации.А. Напишите реакции окисления и конъюгации данного соединения.
Б. Как называется промежуточный продукт, который является канцерогеном?
В. Почему при работе с анилиновым красителем возникает рак мочевого пузыря?
Задача 4.
А. Билирубин непрямой.
Б. Билирубин прямой.
В. Оба.
Г. Ни один.
1. Повышается при паренхиматозной желтухе.
2. Продукт конъюгации с глюкуроновой кислотой.
3. Образуется при катаболизме глобина.
4. Транспортируется кровью в комплексе с альбумином.
Задача 5.
А. Билирубин.
Б. Билирубинглюкурония.
Г. Стеркобилиноген.
Д. Уробилин.
1. Повышается концентрация при гемолитической желтухе.
2. В составе желчи секретируется в кишечнике.
3. В норме в небольшом количестве содержится в моче.
Ситуационные задачи
Задача 6. У женщины, страдающей желчнокаменной болезнью, появились боли в области печени, быстро развилось желтушное окрашивание склер, кожи, кал обесцветился, моча приобрела цвет крепкого чая. Какие нарушения пигментного обмена могут быть обнаружены, какой тип желтухи?
Задача 7. У больного желтушность кожи, яркая желтушность склер, слизистых. Моча цвета пива, окраска кала существенно не изменена. В крови повышено содержание прямо билирубина, в кале - нормальное содержание стеркобилиногена, в моче есть стеркобилиноген и билирубин. О каком типе желтухи можно думать?
Задача 8. У ребенка наблюдается желтушность кожи, склеры светлые. Содержание билирубина в крови умеренно, повышено (за счет непрямого «свободного»), кал интенсивно окрашен, количество стеркобилина увеличено, в моче повышено содержание стеркобилиногена, билирубина нет. Резистентность эритроцитов снижена. О каком типе желтухи можно думать?
Задача 9. Мужчина 40 лет жалуется только на желтушность кожных покровов. В крови увеличено содержание прямого билирубина, в моче обнаружен прямой билирубин. Уробилин в моче и стеркобилин в кале в незначительном количестве. Стеаторея отсутствует. Установите вид желтухи.
Задача 10. У мальчика возрастом 1 года признаки энцефалопатии, постоянная желтуха, не поддающаяся лечением фенобарбиталом. В крови высокий уровень непрямого билирубина. Желчные пигменты в моче и кале не обнаружены. Установите вид желтухи?
Задача 11. У мужчины 30 лет кожа и склеры, слизистые оболочки окрашены в желтый цвет. Содержание билирубина в крови 6 мг%. В моче билирубин отсутствует. При исследовании биоптата печени обнаружена низкая активность глюкуранилтрансферазы гепатоцитов. Установите вид желтухи.
Литература
1. Биохимия. Учебник для вузов под ред. чл.-кор. РАН Е.С. Северина; Москва, изд. дом ГЭОТАР-Мед., 2003. Стр. 616-656.
2. Биохимия. Краткий курс с упражнениями и задачами. Под ред. чл.-кор. РАН Е.С. Северина, проф. А.Я. Николаева, Москва, ГЭОТАР - Мед., 2001. Стр. 430-433.
3. Николаев А.Я.. Биологическая химия. МИА, Москва, 1998. Стр. 411-424.
4. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. Москва, "Медицина", 1998. Стр. 506-508, стр. 551-565.
5. Пустовалова Л.М.. Практикум по биохимии. "Феникс", Ростов-на-Дону, 1999. Стр. 378-387.
БИОХИМИЯ КРОВИ
Кровь – жидкая подвижная ткань, перемещающаяся по кровеносным сосудам. Благодаря работе сердца кровь циркулирует по замкнутой системе кровеносных сосудов и осуществляет ряд функций:
I. Транспортная функция:
а) кровь переносит кислород из легких в ткани, углекислый газ из тканей в легкие;
б) питательные вещества из кишечника в ткани и конечные продукты обмена в выделительные органы;
в) поставляет гормоны от органов внутренней секреции к тканям – мишеням;
г) разносит молекулы АТФ из мест синтеза к местам потребления.
II. Регуляторная функция:
а) кровь регулирует кислотно-щелочной баланс, поддерживая нормальный рН, составляющий 7,36– 7,44;
б) играет большую роль в водном и минеральном балансе при помощи нейро-гуморальных механизмов;
в) выполняет терморегуляторную функцию, поддерживая постоянство температуры.
III. Защитная функция:
а) клеточные (лейкоциты) и гуморальные (антитела) элементы защищают организм от чужеродных молекул;
б) способность крови свертываться, образование тромба в месте повреждения останавливает кровотечение.
Масса крови в сосудах человека составляет около 5% от массы тела. Кровь состоит из клеток, клеточных фрагментов и водного раствора - плазмы. Доля клеточных элементов в общем объеме называется гематокритом и составляет примерно 45%.
Нерастворимыми элементами крови являются эритроциты, лейкоциты и тромбоциты.
Эритроциты(5·106 в 1мл крови) – единственные клетки, которые имеют только клеточную мембрану и цитоплазму. Они образуются из полипотентных стволовых клеток костного мозга. В процессе дифференцировки на стадии эритробластов происходит интенсивный синтез гемоглобина, концентрация которого в крови зависит от количества эритроцитов и от концентрации его в одной клетке. Нормальное содержание гемоглобина составляет 34%, на сухое вещество – 95%. Наряду с нормой встречается гипо- и гиперхромная анемия.
Главная функция этих высокоспециализированных клеток – транспорт газов: перенос О2 от легких к тканям и СО2 из тканей к альвеолам легких. Он возможен благодаря содержанию гемоглобина и высокой активности фермента карбоангидразы. В зрелых эритроцитах нет ядер рибосом, митохондрий, лизосом. Поэтому обмен эритроцитов имеет ряд особенностей.
1. В зрелых эритроцитах не идут реакции биосинтеза белков, метаболизм его упрощен и предназначен, в основном, для сохранения структуры мембраны и предотвращения окисления гемоглобина.
2. Энергия необходимая транспортным АТФ-азам образуется за счет глюкозы (на 90% путем гликолиза и 10% за счет ГМФ-пути). С гликолизом связан и синтез 2,3 бифосфоглицерата, который вытесняет кислород в ткани.
В эритроцитах существует механизм защиты гемоглобина от окисления: супероксиддисмутаза, каталаза, глутатионпероксидаза. ГМФ-путь распада глюкозы дает НАДФН+Н+, который восстанавливает окисленный глутатион. Глутатион, содержащий SН –группы является донором протонов для действия пероксидазы, обезвреживающей Н2О2 (см. тему «Биологическое окисление»).
Лейкоциты (7·103 в 1мл крови) – клетки, которые выполняют защитные функции и способны к фагоцитозу. В фагоцитозе участвуют 2 типа лейкоцитов – нейтрофилы и моноциты. Нейтрофилы поступают в кровоток из костного мозга. Моноциты могут выходить из кровяного русла и тогда их называют фагоцитами. Оба типа фагоцитов захватывают и разрушают бактерии. В лейкоцитах много активных протеаз, которые расщепляют чужеродные белки. В момент фагоцитоза увеличивается выработка пероксида водорода и увеличивается активность пероксидазы, что способствует окислению чужеродных частиц (антибактериальное действие). Протеиназы (катепсины), локализованы в лизосомах и способны практически к тотальному протеолизу белковых молекул. В лизосомах лейкоцитов в значительных количествах содержатся и другие ферменты: например, рибонуклеазы и фосфатазы. При фагоцитозе (особая форма эндоцитоза) образуются большие эндоцитозные пузырьки – фагосомы, которые сливаются с лизосомами, где происходит активация кислородзависимых бактерицидных механизмов (с участием оксида азота) уничтожения микроорганизмов. Ферментный комплекс мембраны фагосом – NAДPH-оксидаза восстанавливает О2 образуя супероксидный анион 2О2+ NAДPH→2О2¯+NAДP++Н+ и О2¯+2Н+→Н2О2. Под действием миелопероксидазы в присутствии Cl¯ образуется дополнительный токсичный окислитель – гипохлорид: Н2О2+ Cl¯+ Н+→НОСl+Н2О. Активные формы кислорода инициируют свободнорадикальные реакции, разрушающие липиды клеточных мембран поглощенных фагоцитами бактерий.
Наследственная недостаточность NAДPH – оксидазы, обусловленная дефектом одного из генов этого ферментного комплекса, приводит к хроническому гранолематозу. При этом фагоциты больных не способны продуцировать токсичные формы кислорода и не могут быстро разрушить клетки бактерий и грибов.
Тромбоциты (3·103 в 1мл крови) – образуются из цитоплазмы мегакариоцитов костного мозга. Это неполноценные клетки, так как не содержат ядра, но все биохимические процессы протекают (биосинтез белка; обмен углеводов и липидов, биоокисление с фосфорилированием). Способность тромбоцитов прилипать к поврежденной стенке сосуда (адгезия) и друг к другу, связываться с фибрином, образуя тромбоцитарный тромб и секретировать гемостатические факторы (тромбостенин, простагландины, тромбоксан и др.) определяет их роль в гемостазе. См. раздел «Свертывание крови».
Синтез гема и гемоглобина
Гем является простетической группой многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЦПЭ, цитохрома Р450, участвующего в микросомальном окислении. Ферменты каталаза, пероксидаза, цитохромоксидаза содержат гем в качестве кофермента. Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом.
Общая схема синтеза гемоглобина у человека представлена на рисунке:

Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сукцинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
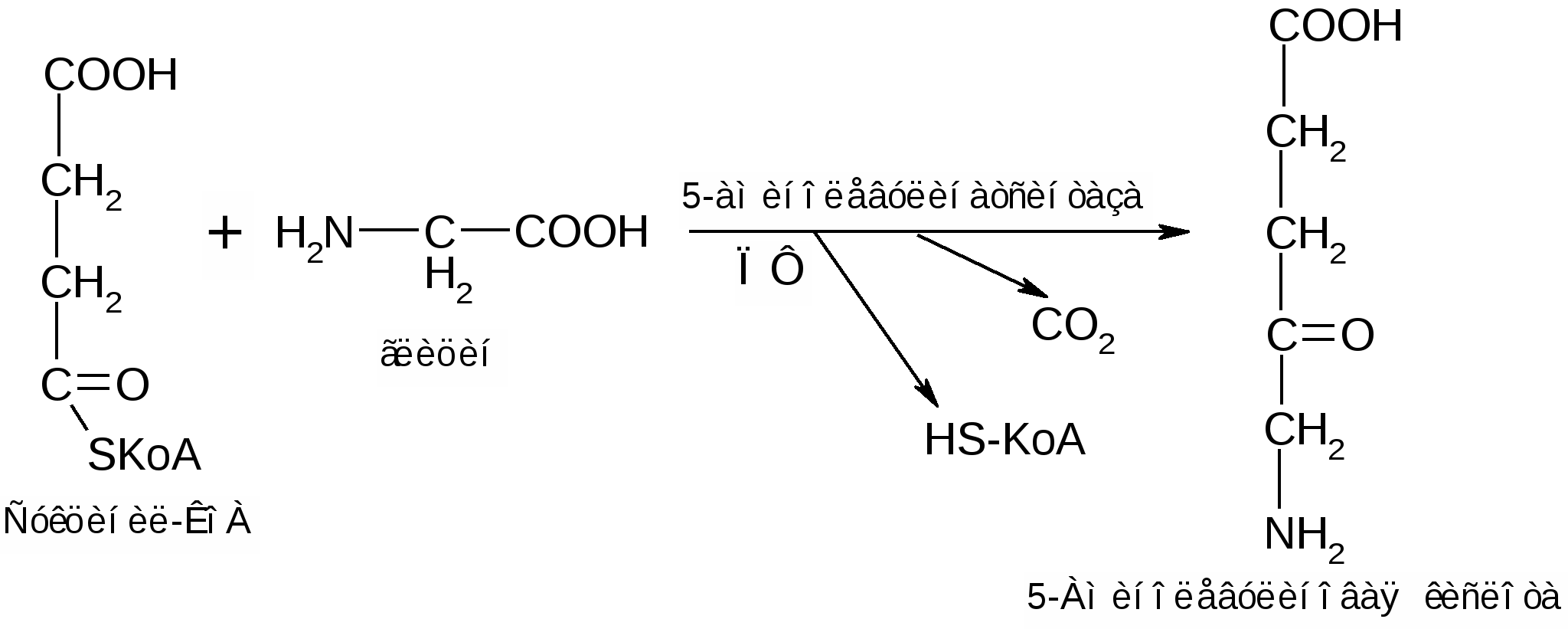
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2-x молекул 5-аминолевулиновой кислоты в молекулу порфобилиногена.
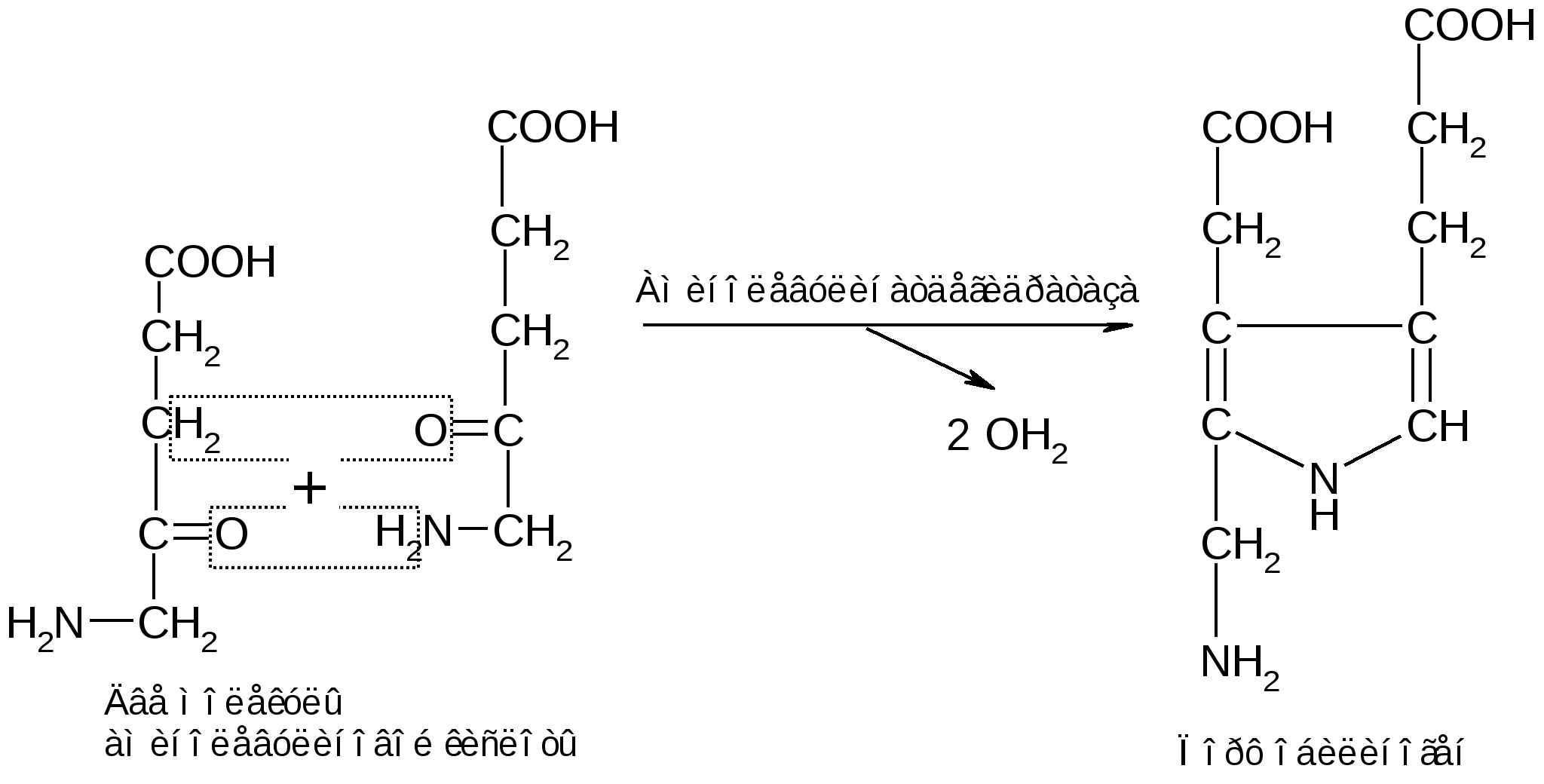
Под действием порфобилиногендезоминазы 4 молекулы порфобилиногена конденсируются с образованием гидроксиметилбилана:
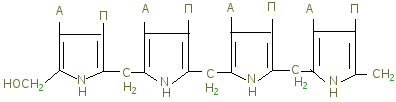
где радикалы А – ацетил, а П – протонил. Далее ферменты изомераза и дегидратаза образуют замкнутый цикл из четырех пиррольных колец с радикалами А и П, связанных между собой метиленовыми группами с образованием уропорфириногена III, который после последовательных ферментативных превращений образует нужный протопорфирин IX, соединяющийся с Fe и образует гем.
Регуляция синтеза гема и гемоглобина
Гем по принципу отрицательной обратной связи ингибирует аминолевулинатсинтазу и аминолевулинатдегидратазу и является индуктором трансляции α- и β-цепей гемоглобина. Последовательность нуклеотидов, образующая шпилечную петлю, которая называется железочувствительным элементом (от англ. iron-responsive element, IRЕ).
При высоких концентрациях железа в клетках оно образует комплекс с остатками цистеина регуляторного железосвязывающего белка. Взаимодействие железа с регуляторным железосвязывающим белком вызывает снижение сродства этого белка к IRE-элементу мРНК, кодирующей аминолевулинатсинтазу, и продолжение трансляции. При низких концентрациях железа железосвязывающий белок присоединяется к железо-чувствительному элементу, находящемуся на 5'-нетранслируемом конце мРНК, и трансляция аминолевулинатсинтазы тормозится.
Аминолевулинатдегидратаза также аллостерически ингибируется гемом, но так как активность этого фермента почти в 80 раз превышает активность аминолевулинатсинтазы, то это не имеет большого физиологического значения.
Дефицит пиридоксальфосфата и лекарственные препараты, которые являются его структурными аналогами, снижают активность аминолевулинатсинтазы.
