лабораторный практикум. Техника безопасной работы в органическом практикуме Химическая лаборатория это место повышенной опасности!
 Скачать 257.5 Kb. Скачать 257.5 Kb.
|
|
Глава 1. Техника безопасной работы в органическом практикуме Химическая лаборатория – это место повышенной опасности! Работая в практикуме органической химии необходимо знать правила техники безопасности и меры предупреждения и предотвращения несчастных случаев, уметь оказывать первую медицинскую помощь себе и окружающим. 1. Общие положения. Запрещается допускать студентов к работе в лаборатории без ознакомления с инструкцией по технике безопасности. Проведение инструктажа фиксируется личными подписями инструктируемых и датой в журнале проведения инструктажа. Студенты, нарушившие правила техники безопасности должны пройти внеочередной инструктаж. 2. Общие правила работы в лаборатории органической химии. В лаборатории необходимо находиться только в застегнутом хлопчатобумажном халате с длинными рукавами, длина халата должна быть ниже колен. При себе должно быть небольшое полотенце для рук и одноразовые резиновые перчатки. Все работы в лаборатории должны выполняться только в защитных очках, а при работе с вакуумом обязательно использоваться защитный экран! Студенты не должны в практикуме носить контактные линзы, только очки. Некоторые едкие и токсичные вещества легко адсорбируются на поверхности контактных линз. Это может вызвать болезненные ощущения или покраснение глаз. При работе в лаборатории необходимо соблюдать тишину, чистоту, аккуратность, быть внимательным, стремиться к тому, чтобы вещества не попадали на кожу, не трогать руками лицо и глаза, после работы тщательно вымыть руки. В процессе работы необходимо использовать только чистую химическую посуду. Химические реагенты и приготовленные растворы должны обязательно храниться в посуде, снабженной этикеткой. Нельзя наклоняться над сосудом с нагревающейся жидкостью, направлять отверстие таких сосудов на себя и других работающих. При отгонке растворителей и других работах, связанных с нагреванием при атмосферном давлении, не допускается работа в герметически закрытых сосудах. Нагревание замкнутой системы любого типа может привести к взрыву в результате резкого повышения давления паров в системе. Категорически запрещается оставлять действующие приборы без наблюдения! Все работы в лаборатории проводятся при работающей вытяжной вентиляции. Запрещается выливать в раковины остатки экологически опасных реагентов и любые органические вещества. Для утилизации этих соединений имеются специальные склянки в вытяжных шкафах. В лаборатории категорически запрещается курить, слушать музыку, пить и принимать пищу. Работа с ядовитыми и едкими веществами Необходимо иметь в лаборатории предохранительные маски, защитные очки и противогазы. Все работы с ядовитыми и горючими газами и парами следует проводить в вытяжном шкафу, не заглядывать внутрь шкафа. Приборы, содержащие ядовитые или агрессивные пары, разбирать под тягой. Выносить части приборов из-под тяги только после соответствующей обработке. Приступая к работе с хлором, бромом и другими летучими ядовитыми веществами, предупреждать об этом работающих рядом; не загромождать путь срочной эвакуации из лаборатории на случай выброса в атмосферу ядовитых веществ. Работа с бромом Бром вызывает крайне болезненные, долго и трудно заживающие ожоги. Пары брома тяжелее воздуха и стекают вниз. При работе с ним: следует остерегаться вдыхать пары, беречь глаза и руки от возможного ожога парами; при наливании и переливании брома надевать резиновые перчатки (помнить о том, что резиновые перчатки достаточно быстро разъедаются бромом и являются лишь временной мерой защиты); учитывать, что бром ни в коем случае не должен попадать на алюминиевых поверхности: при попадании брома в алюминиевую баню возможно самовозгорание. кран капельной воронки необходимо предварительно испытать на герметичность с помощью эфира, тщательно удалить смазку с крана и шлифа и смазать их фосфорной кислотой. Работа с ртутью Ртуть и ее соединения весьма ядовиты. Все работы со ртутью следует проводить над ванночкой для предотвращения ее разливания на столе или полу. Основной причиной разлива большого количества ртути в лаборатории органического синтеза является разрушение ртутных манометров. Поэтому категорически запрещается резко впускать атмосферный воздух в приборы, соединенные с такими манометрами. Однако основными источниками загрязнения лаборатории ртутью являются разбитые термометры. Поэтому категорически запрещается нагревать такие термометры до температур, выходящих за пределы измерительной шкалы. При попадании ртути в лабораторное помещение необходимо немедленно сообщить об этом преподавателю. Разлитую ртуть следует собирать с помощью медных пластинок, обработанных азотной кислотой. Щели столов или пола, в которые могла попасть ртуть, засыпать порошком серы или обработать раствором хлорида железа (III). Работа с кислотами и едкими веществами Концентрированные кислоты, ангидриды и галогенангидриды кислот, аммиак и амины переливать только через воронку и в вытяжном шкафу. При разбавлении концентрированной серной кислоты вливать кислоту небольшими порциями в воду и осторожно перемешивать. При растворении концентрированной серной кислоты, при приготовлении хромовой смеси, при смешивании концентрированных растворов щелочей использовать только химическую посуду из термостойкого стекла (сильный разогрев!). Работа с легковоспламеняющимися и взрывоопасными веществами Не держать ЛВЖ вблизи огня или вблизи нагревательных приборов. Не нагревать ЛВЖ на открытом огне, близи от огня или же в открытых сосудах. При кипячении и перегонке использовать эффективные холодильники, для нагревания – водяные бани, колбонагреватели или специальные электроплитки с закрытой спиралью. Не хранить ЛВЖ в тонкостенной посуде с плотно закрытой пробкой. Работа с металлическим натрием Проводится только под наблюдением преподавателя или лаборанта! Натрий хранят в хорошо закрывающихся банках под слоем инертного высококипящего растворителя. Натрий берут пинцетом или щипцами. Резать и взвешивать натрий следует только под слоем инертного растворителя. При добавлении натрия в реакционный сосуд уже взвешенные и нарезанные кусочки быстро по одному промакивают фильтровальной бумагой. Каждый следующий кусочек вынимают из растворителя и промакивают только после того, как предыдущий помещен в реакционный сосуд. При проведении реакций с натрием обратные холодильник используют с осторожностью, так как конденсирующаяся снаружи влага при извлечении холодильника или при использовании негерметичных шлифов может попасть в реакционную смесь. Кроме того, плохо закрепленные водяные шланги могут быть сорваны напором воды. Обрезки натрия складывают в специально предназначенную для них емкость. Небольшие количества натрия обезвреживают изопропанолом. В случае возгорания натрий следует тушить песком или углекислотными огнетушителями. Химические пенные или бромэтиловые огнетушители использовать категорически нельзя. 3. Первая помощь при ожогах, отравлениях и других несчастных случаях В случае любого, даже незначительного на первый взгляд происшествия немедленно поставить в известность преподавателя. При легких термических ожогах пораженное место обмыть струей холодной воды, протереть спиртом, а затем смазать глицерином. При ожогах бромом пораженное место тщательно обмыть струей холодной воды, а затем 10%-ным раствором тиосульфата натрия. После вдыхания паров брома следует вдыхать разбавленный раствор аммиака и выйти на свежий воздух. При ожогах концентрированными растворами кислот обмыть обожженное место струей холодной воды, а затем 3%-ным раствором соды. При попадании кислоты в глаза промыть под струей холодной воды в течение 5 минут и обратиться к врачу. При ожогах концентрированными растворами щелочей обмыть кожу струей холодной воды, а затем 1%-ным раствором борной кислоты. Аммиак и амины почти не действуют на кожу, однако при попадании в глаза могут вызвать их сильное поражение. При случайном попадании реактивов внутрь организма немедленно выпить не менее стакана воды и поставить в известность преподавателя. При порезах в первую очередь необходимо удалить из раны осколки стекла, края раны дезинфицировать 3%-ным спиртовым раствором йода, а затем наложить стерильную повязку. При сильных кровотечениях следует наложить жгут выше раны и вызвать врача. 4. Противопожарные мероприятия В случае воспламенения горючей жидкости следует перекрыть газовые краны, отключить щитки электропитания, затем прикрыть пламя асбестовым полотенцем, засыпать его песком или воспользоваться углекислотным огнетушителем. Растворимые в воде ЛВЖ (спирт, ацетон), если воспламенилось небольшое их количество, можно тушить водой. При воспламенении нерастворимого в воде вещества (эфир, бензол, гексан) воду применять для тушения нельзя – это может вызвать увеличение площади горения. В этом случае очаг возгорания необходимо засыпать песком или воспользоваться углекислотным огентушителем. В случае возгорания одежды следует быстро отойти от очага возгорания и лечь на пол и постараться сбить пламя. Глава 2. Лабораторные работы Порядок проведения лабораторных работ Студент должен самостоятельно подготовиться к выполнению лабораторной работы, используя учебную и справочную литературу: сделать расчет синтеза, изучить свойства исходных веществ и продуктов реакции, правила техники безопасности при выполнении лабораторной работы, порядок сборки установки и выполнения работы; знать методы очистки и выделения органических веществ. По результатам самостоятельной подготовки студент обязан получить допуск к выполнению лабораторной работы у преподавателя. Студент, не получивший допуск, к выполнению работы не допускается. Во время работы студент обязан: строго соблюдать правила работы с приборами и реактивами; без разрешения преподавателя не оставлять рабочее место; строго соблюдать условия проведения, последовательность выполнения работы в соответствии с методическими указаниями. Если какие-то этапы работы непонятны или вызывают сомнение, обязательно проконсультироваться с преподавателем! После выполнения лабораторной работы студент должен представить в тетради отчет, в котором необходимо указать установленные в работе константы синтезированного вещества, выход в процентах, а также привести механизмы основной и побочных реакций. Для защиты лабораторной работы студент должен представить отчет по установленной форме, ответить на вопросы по данной работе. Образец оформления лабораторной работы в рабочем журнале Дата Название синтеза Основная реакция Свойства и расчет количества исходных веществ:
Методика синтеза Выход и характеристики продуктов реакции:
Выход вещества от теоретического, % Выход вещества от полученного по методике, % Описание выделенного соединения (внешний вид, температуры плавления, кипения, показатель преломления) Механизм реакции Побочные реакции с механизмом Основные методы выделения и очистки органических соединений Лабораторная работа №1. Ректификация при атмосферном давлении
Установка Ф 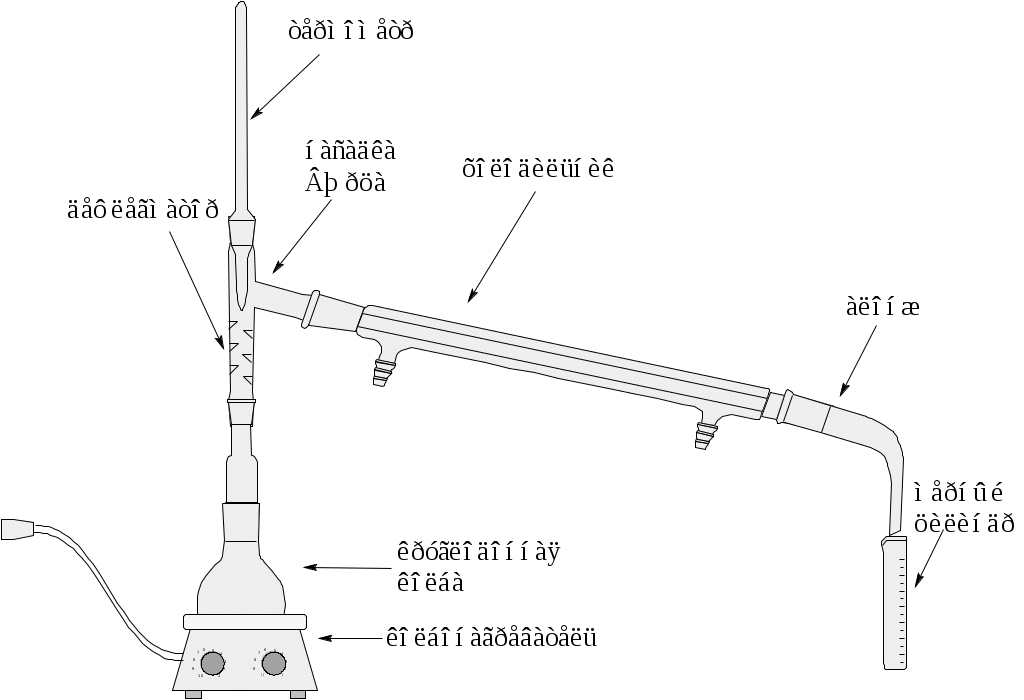 ракционированная перегонка (ректификация) используется для выделения в чистом виде компонентов смеси органических жидкостей, отличающихся друг от друга по температурам кипения. ракционированная перегонка (ректификация) используется для выделения в чистом виде компонентов смеси органических жидкостей, отличающихся друг от друга по температурам кипения.Температуру кипения контролируют термометром, вставленным в горло колбы таким образом, чтобы не касался стенок и нижний край термометра был на 0.5 см ниже отвода насадки Вюрца. Размер колбы должен быть таким, чтобы перегоняемая жидкость занимала от половины до двух третей объема шарообразной части. Для того, чтобы кипение было равномерным и не происходило перегрева жидкости перед началом перегонки в колбу с жидкостью помещают «кипелки» - кусочки пористого фарфора или керамзита. «Кипелки» можно вносить только в холодный раствор. Помещать «кипелки» в горячую жидкость нельзя, так как это может привести к резкому вскипанию жидкости и к ее разбрызгиванию. Размер холодильника должен быть таким, чтобы была обеспечена полная конденсация паров. Чем ниже кипит жидкость, тем эффективнее (длиннее) должен быть холодильник. При перегонке веществ, имеющих высокую температуру кипения (выше 150 °С), можно использовать воздушный холодильник (стеклянная трубка). Холодильник соединяется с приемником посредством алонжа. В качестве приемников применяются конические или круглодонные колбы (в данной работе используется мерный цилиндр). В зависимости от температуры кипения перегоняемого вещества колбу нагревают: а) на водяной бане (ниже 80 °С); б) на масляной бане (не выше 200 °С); в) сплав Вуда (выше 200 °С). В баню помещают термометр и нагревают ее до температуры, при котором вещество перегоняется с нормальной скоростью (10-20 капель в минуту). Температура бани не должна превышать температуру кипения жидкости более чем на 20 °С. Для построения графика зависимости температуры паров от объема дистиллята необходимо после начала кипения записывать температуру кипения после отбора каждых 2-х мл дистиллята в таблицу. Интервал температуры кипения фракции, содержащей чистый компонент, не должен превышать более 5 °С. Перегонку проводят до тех пор, пока в перегонной колбе не останется несколько миллилитров жидкости. Нельзя перегонять досуха! В процессе выполнения ректификации необходимо собрать три фракции: первую и третью фракции, содержащие чистые компоненты (индивидуальные вещества) и вторую фракцию, содержащую смесь этих компонентов. Для индивидуальных веществ необходимо определить показатель преломления. Сравните полученные в работе экспериментальные данные (температура кипения и показатель преломления) со справочными (приложение 1) и идентифицируйте компоненты в смеси. Оформите отчет и постройте график зависимости температуры кипения от объема дистиллята. Покажите на графике все три фракции, полученные при перегонке. Контрольные вопросы: 1. Какие существуют другие виды перегонок? 2. Какие смеси жидкостей можно разделять ректификацией? 3. Что такое азеотропная смесь? В каких случаях используется перегонка с водяным паром? 4. Что такое азеотропная осушка растворителя? 5. Для чего нужен дефлегматор? Принцип его действия. В каком случае можно отказаться от него при перегонки бинарной смеси жидкостей? 6. Для чего нужны «кипелки»? Принцип их действия. 7. Почему нельзя перегонять досуха? Лабораторная работа №2. Фракционная перегонка при пониженном давлении
Вещества, кипящие при высоких температурах и подвергающиеся при этом разложению, перегоняют при уменьшенном давлении. В соответствии с уравнением Менделеева-Клаузиуса-Клапейрона существует зависимость температуры кипения жидкости от внешнего давления. Следовательно, понижая давление в перегонной установке, тем самым снижают температуру кипения данной жидкости. Для приблизительной оценки температуры кипения жидкости при определенном давлении достаточно знать температуру кипения при атмосферном давлении. Это можно сделать, используя диаграмму «давление–температура» (рис. 1).  Рис. 1 Диаграмма «температура-давление» Установка П 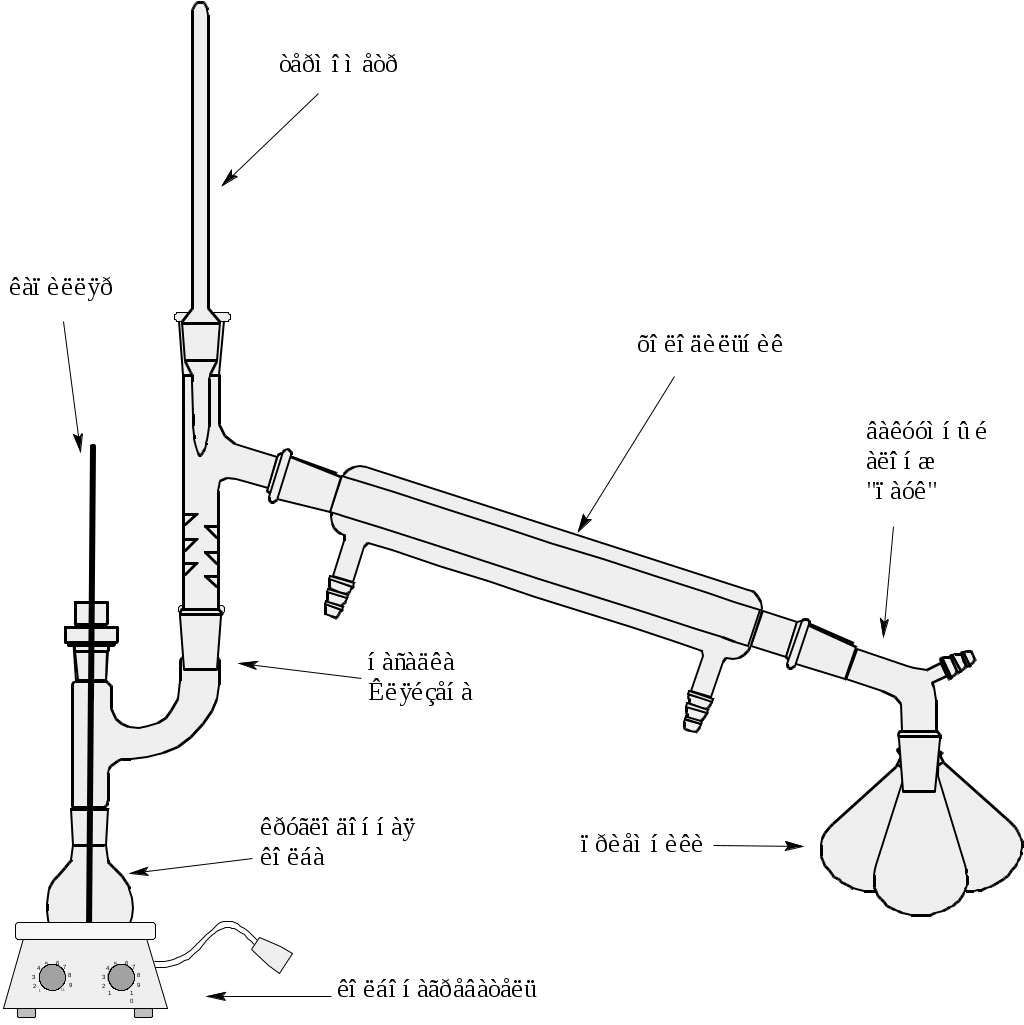 ониженное давление в приборах для перегонки создается вакуумными насосами. Простейшим из них является водоструйный насос, он дает разряжение 10 мм рт. ст. Для перегонки в вакууме используют только круглодонные колбы, в том числе и приемники. «Кипелки» не работают при пониженном давлении, поэтому для обеспечения равномерного кипения жидкости в этих условиях используют тонкий капилляр, погруженный в перегоняемую жидкость. Через капилляр при перегонке входят маленькие пузырьки воздуха, которые предотвращают перегрев жидкости и обеспечивают равномерность кипения. Если перегоняемое вещество может взаимодействовать с кислородом воздуха, через капилляр вводят азот или углекислый газ. Для фракционной перегонки в вакууме используют специальный алонж «паук» - насадка с тремя и более отводами для присоединения приёмников и отвода для подключения вакуума. Прибор для перегонки соединяют с насосом при помощи толстостенных резиновых шлангов, между прибором и насосом включают ртутный манометр для измерения остаточного давления. Перед началом работы необходимо проверить герметичность прибора: все стеклянные шлифы должны быть смазаны специальной вакуумной смазкой так, чтобы соединение легко прокручивалось и шлиф был прозрачным (не было внутри пузырьков воздуха и излишка смазки вне шлифа). После того как будет достигнута герметичность установки приступают к перегонке. Включают насос, перекрывают кран сообщения с воздухом и осторожно включают манометр. Лишь после достижения постоянства разряжения в приборе начинают подогрев перегонной колбы. Скорость перегонки должна быть небольшой (не более 1 капли в секунду), иначе возможен переброс жидкости. В течении перегонки определенной фракции поддерживают постоянную температуру бани. Результаты записывают, отмечая температурный интервал и остаточное давление, например т. кип. 80-81 °С (4 мм рт. ст.). По окончании перегонки прекращают нагревание и дают колбе охладиться, и лишь затем постепенно соединяют с атмосферой. После сообщения с атмосферой вытаскивают капилляр и термометр, снимают приемники и выключают насос. Все шлифы, которые были смазаны вакуумной смазкой, необходимо вымыть от смазки ватой, смоченной неполярным растворителем, прежде, чем начинать мыть посуду водой. ониженное давление в приборах для перегонки создается вакуумными насосами. Простейшим из них является водоструйный насос, он дает разряжение 10 мм рт. ст. Для перегонки в вакууме используют только круглодонные колбы, в том числе и приемники. «Кипелки» не работают при пониженном давлении, поэтому для обеспечения равномерного кипения жидкости в этих условиях используют тонкий капилляр, погруженный в перегоняемую жидкость. Через капилляр при перегонке входят маленькие пузырьки воздуха, которые предотвращают перегрев жидкости и обеспечивают равномерность кипения. Если перегоняемое вещество может взаимодействовать с кислородом воздуха, через капилляр вводят азот или углекислый газ. Для фракционной перегонки в вакууме используют специальный алонж «паук» - насадка с тремя и более отводами для присоединения приёмников и отвода для подключения вакуума. Прибор для перегонки соединяют с насосом при помощи толстостенных резиновых шлангов, между прибором и насосом включают ртутный манометр для измерения остаточного давления. Перед началом работы необходимо проверить герметичность прибора: все стеклянные шлифы должны быть смазаны специальной вакуумной смазкой так, чтобы соединение легко прокручивалось и шлиф был прозрачным (не было внутри пузырьков воздуха и излишка смазки вне шлифа). После того как будет достигнута герметичность установки приступают к перегонке. Включают насос, перекрывают кран сообщения с воздухом и осторожно включают манометр. Лишь после достижения постоянства разряжения в приборе начинают подогрев перегонной колбы. Скорость перегонки должна быть небольшой (не более 1 капли в секунду), иначе возможен переброс жидкости. В течении перегонки определенной фракции поддерживают постоянную температуру бани. Результаты записывают, отмечая температурный интервал и остаточное давление, например т. кип. 80-81 °С (4 мм рт. ст.). По окончании перегонки прекращают нагревание и дают колбе охладиться, и лишь затем постепенно соединяют с атмосферой. После сообщения с атмосферой вытаскивают капилляр и термометр, снимают приемники и выключают насос. Все шлифы, которые были смазаны вакуумной смазкой, необходимо вымыть от смазки ватой, смоченной неполярным растворителем, прежде, чем начинать мыть посуду водой.Контрольные вопросы: 1. Для перегонки каких веществ нельзя использовать вакуумную перегонку? 2. Почему нельзя использовать «кипелки» для вакуумной перегонки? 3. Какую роль выполняет капилляр, принцип его действия? 4. Почему нельзя использовать в качестве приемником плоскодонные колбы? 5. Какие существуют приемы для перегонки микроколичеств жидкости? 6. Основные правила работы с вакуумом. Лабораторная работа №3. Перекристаллизация органического вещества
Одним из главных методом очистки твердых органических веществ является перекристаллизация. Работу по перекристаллизации неизвестного органического соединения начинают с выбора растворителя. Основным требованием к растворителю является хорошая растворимость органического соединения при нагревании в этом растворителе и минимальная растворимость при охлаждении. Установки 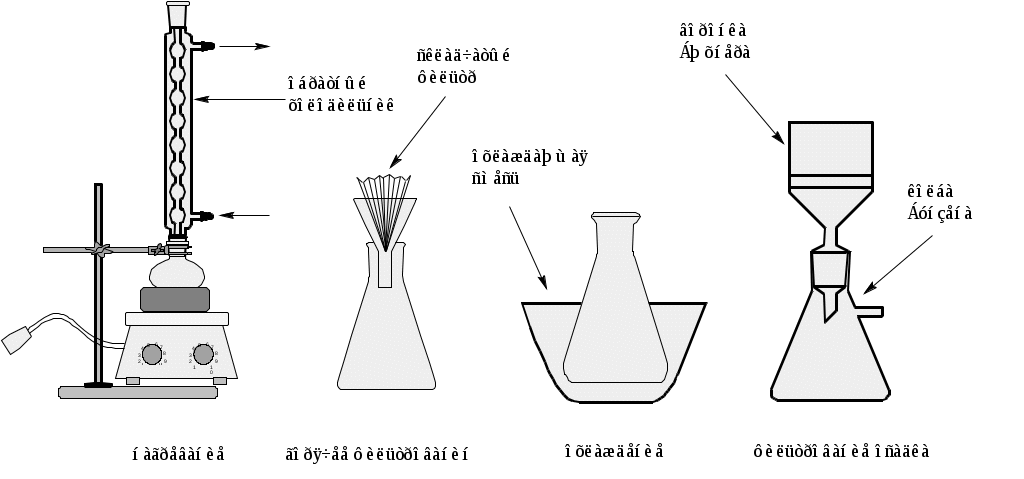 Вещество с растворителем нагревают колбе с обратным холодильником. Растворитель берется в меньшем количестве, чем это необходимо для полного растворения вещества. Всегда при растворении вещества следует доводить раствор до кипения, не забывая периодически помешивать смесь вручную. Затем через обратный холодильник осторожно небольшими порциями добавляют такое количество растворителя, чтобы при кипении всё вещество полностью растворилось. Обязательно следует взвешивать вещество до перекристаллизации и измерять объём использованного растворителя, чтобы количественно оценить процесс перекристаллизации. Полученный раствор доводят до кипения и фильтруют горячим через складчатый фильтр на воронке с коротким кончиком. Края складчатого фильтра должны на 5 мм быть выше края воронки, когда в нее будет налита жидкость для фильтрования. Сосуд с фильтратом неплотно закрывают и оставляют охлаждаться. Для полноты выпадения кристаллов сосуд помещают в охлаждающую смесь. Органические вещества часто имеют склонность к образованию пересыщенных растворов. Поэтому часто для начала кристаллизации желательно внести «затравку» – в сосуд после охлаждения добавляют несколько кристалликов того же вещества. Трение стеклянной палочкой о стенку сосуда также вызывает образование зародышей кристаллизации, на которых и происходит дальнейший рост кристаллов. Охлаждение проводят до тех пор, пока маточный раствор над кристаллами станет полностью прозрачным. Относительно большие количества веществ фильтруют с использованием воронок Бюхнера и колб Бунзена, а малые количества на фильтрах Шотта – специальных воронках со стеклянной пористой пластиной. Для ускорения фильтрования в колбе создается пониженное давление с помощью водоструйного насоса.Хорошо подогнанный круглый бумажный фильтр (края фильтра не должны заходить на стенки воронки Бюхнера) предварительно смачивают на воронке растворителем, затем плотно прижимают фильтр к воронке, подключая вакуум, после этого в воронку начинают добавлять фильтруемую смесь. Осадок на фильтре отжимают при помощи плоской широкой стеклянной (или пластиковой) пробки до тех пор, пока перестанет капать маточный раствор. В целях удаления остатков маточного раствора кристаллы промывают на фильтре небольшими порциями предварительно охлажденного растворителя при перемешивании. После промывания осадок высушивают на фильтре при включенном насосе, затем переносят на взвешанную чашку Петри и высушивают до постоянной массы. Следует определить процентное содержание примеси в исходном смеси и измерьте температуру плавления вещества в капилляре после высушивания, идентифицируйте вещество, используя справочные данные (приложение 2). Контрольные вопросы: 1. Как подбирают растворитель для перекристаллизации неизвестного органического вещества? 2. Основные требования к растворителям для перекристаллизации. 3. Что такое «горячее фильтрование», в каком случае оно необходимо? 4. Как правильно кристаллизовать вещество? Что такое «окклюзия»? Как ее избежать? 5 Что такое «затравка»? Для чего она нужна? 6. Какие приборы существуют для высушивания твердых веществ? 7. Какие существуют другие способы очистки твердых веществ? 8. По каким данным можно судить о чистоте полученного перекристаллизацией вещества? Лабораторная работа №4. Тонкослойная хроматография
Тонкослойная хроматография (ТСХ) представляет собой разновидность адсорбционной хроматографии. Разделение веществ происходит в тонком слое сорбента, нанесенного и закрепленного на алюминиевой, полимерной или стеклянной пластине (подложке). Сорбентом обычно является силикагель или окись алюминия. Растворы веществ готовятся в легколетучем растворителе, как правило в хлороформе. Для растворения необходимо брать несколько миллиграмм (на кончике шпателя) вещества и 0.2-0.3 мл растворителя. Вещество наносится на пластину капилляром. Пятнышко нанесенного вещества должно находиться не менее 0.5-1 см от нижнего края пластины и так, чтобы уровень растворителя-элюента в хроматографической камере был ниже пятна. Если на пластину одновременно наносится несколько веществ, то рекомендуется разметить стартовую линию простым карандашом, не повреждая поверхность пластинки. Пятна должны находиться на одном уровне и не ближе 1 см друг от друга и от края пластины. Капилляр для нанесения каждого вещества должен быть чистым, не загрязненным другим веществом. Диаметр пятна должен быть как можно меньше, обычно 2-3 мм. Не следует делать очень концентрированные растворы для нанесения, иначе не удастся добиться хорошего разделения пятен. Готовую пластину с нанесенными веществами высушивают от растворителя, в котором вещества были растворены, а затем помещают в закрытую хроматографическую камеру (сосуд), в которую уже налит элюент– растворитель для хроматографии. Для более полного насыщения камеры парами элюента внутри вдоль стенок сосуда помещают фильтровальную бумагу. Во время проявления камера должна оставаться закрытой. Когда элюент дошел до верхнего края пластины, её извлекают из камеры, отмечают карандашом фронт растворителя и высушивают на воздухе. Подбор элюента является важной задачей, иногда для этих целей необходимо делать ТСХ в разных растворителях, либо в их смесях, добиваясь того, чтобы Rf нужного вещества был около 0.5. Для подбора подходящего элюента используют элюотропные ряды Траппа или Шталя (приложение 3), в которых растворители расположены по возрастанию полярности и элюирующей силы. Начинать следует с растворителей средней полярности (например, хлороформ). Если после проявления пятна остаются на старте или Rf<0.1, следует переходить к более полярному растворителю. Если пятна двигаются с фронтом или Rf>0.85, следует перейти к менее полярному растворителю. Если с помощью индивидуальных растворителей не удается добиться хорошего разрешения пятен, следует использовать смеси растворителей. Для составления смесей следует брать растворители, заметно различающиеся по полярности (например, хлороформ-этилацетат). Для сложных смесей иногда не удается подобрать элюент так, чтобы величины Rf для всех компонентов пробы были в пределах 0.1-0.85. В этом случае для идентификации полярных и неполярных компонентов образца следует использовать разные растворители. Неполярные компоненты идентифицируются в менее полярном растворителе, а полярные – в более полярном. Идентифицируйте компоненты смеси органических веществ, используя ТСХ и образцы свидетелей индивидуальных веществ. Рассчитайте величины Rf для каждого свидетеля и компонентов задачи. Результаты занесите в таблицу. Контрольные вопросы: 1. Для каких целей используется ТСХ в органическом синтезе? 2. Как с помощью ТСХ определить начало реакции и завершение реакции, если есть в качестве свидетелей только исходные вещества? 3. Какие существуют способы проявления хроматографических пластинок, если вещества не окрашены? 4. Что такое двумерная тонкослойная хроматография? Когда ее используют? Приложение Приложение 1 Физические свойства некоторых органических растворителей
Приложение 2 Физические свойства некоторых органических веществ
Приложение 3 Элюотропные ряды растворителей В приведенной ниже таблице расположены вначале слабо полярные растворители, и в конце - сильно полярные.
Список рекомендуемой литературы 1. Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия, т. 1-4. М.: БИНОМ, Лаборатория знаний, 2004-2007. 2. Юровская М.А., Куркина А.В.. Основы органической химии. М., БИНОМ. Лаборатория знаний. 2010. 3. Шабаров Ю.С. Органическая химия. М.: Химия, 2000. 4. Марч Д. Органическая химия: реакции, механизмы и структура, т. 1-4. М.: Мир, 1987-1988. 5. Нейланд О.Я. Органическая химия. М.: Высш. шк., 1990. 6. Кэри Ф., Сандберг Р. Углубленный курс органической химии, т. 1,2. М.: Химия, 1981. 7. Ли Дж. Дж. Именные реакции. Механизмы органических реакций. М.: БИНОМ. Лаборатория знаний, 2006. 8. Курц А.Л. и др. Задачи по органической химии с решениями. М.: БИНОМ. Лаборатория знаний, 2011. 9. Грандберг И.И. Практические работы и семинарские занятия по органической химии. М.: Высш. шк., 1973. 10. Органикум, т. 1,2. М.: Мир, 1992. 11. Теренин В.И. и др. Практикум по органической химии. М.: БИНОМ. Лаборатория знаний, 2010. 12. Гиттис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии. М.: Высш. шк., 1991. 13. Шарп. Дж., Госни И., Роули А. Практикум по органической химии. М.: Мир, 1993. 14. Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. М.: Химия, 1974. 15. Свойства органических соединений. Справочник. Л.: Химия, 1984. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
