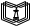вкр. мухин11. Технология очистки промышленных выбросов на предприятии нефтегазовой отрасли
 Скачать 461.84 Kb. Скачать 461.84 Kb.
|
ВЫПУСКНАЯ КВАЛИФИКАЦИОННАЯ РАБОТА БАКАЛАВРА Обучающийся __________Мухамадиев А.Ф.________________________ИЗ-2-18_______ фамилия и.о подпись группа Тема ВКР _Технология очистки промышленных выбросов на предприятии нефтегазовой отрасли _______________________ Научный руководитель доцент кафедры ИЭ, д.т.н., доцент__________Бариева Э.Р должность, ученое звание, ученая степень подпись фамилия и.о. Консультант по _______________________________________________________________ _____________________________________________________________________________ должность, ученое звание, ученая степень подпись фамилия и.о. Консультант по _______________________________________________________________ _____________________________________________________________________________ должность, ученое звание, ученая степень подпись фамилия и.о. Консультант по _______________________________________________________________ _____________________________________________________________________________ должность, ученое звание, ученая степень подпись фамилия и.о. Нормоконтролёр ______________________________________________________________ должность, ученое звание, ученая степень подпись фамилия и.о. Объем оригинального текста составляет __________ %. Зав. кафедрой ________________________________________________________________ должность, ученое звание, ученая степень подпись фамилия и.о. Дата "_______" ________________________ 20 ______
З А Д А Н И Е на выполнение выпускной квалификационной работы бакалавра Обучающийся _____________________Мухамадиев А.Ф________________________ИЗ-2-18___ фамилия и.о. группа Тема ВКР _ Технология очистки промышленных выбросов на предприятии нефтегазовой отрасли _____________________ утверждена приказом от «____» ______________ 20 _____ г. № ______________ Научный руководитель __Бариева Э.Р., доцент кафедры ИЭ, д.т.н., доцент_______________ ___ фамилия и.о., должность, ученая степень, ученое звание Исходные данные к ВКР _________________________________________________________ _______________________________________________________________________________ Содержание разделов ВКР (перечень подлежащих разработке вопросов) _________________ ________________________________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________________________________________________ Перечень графического/демонстрационного материала ________________________________ ________________________________________________________________________________ Рекомендуемая литература ________________________________________________________ ________________________________________________________________________________ ________________________________________________________________________________ Консультанты по работе с указанием относящихся к ним разделов работы
Календарный план
Передача обучающимся электронного варианта ВКР научному руководителю для размещения в ЭБС КГЭУ не позднее трех дней до даты защиты ВКР. Научный руководитель ________________________ __________________________________ подпись фамилия и.о. Задание принял к исполнению _________________________________ ______________ подпись обучающегося дата ________________________________________________________________________________ Подготовка ВКР бакалавра завершена «____»___________20____г. Пояснительная записка, графический и демонстрационный материалы просмотрены. Оценки консультантов: _____________________________________ _____________________________________ оценка подпись фамилия и.о. консультанта оценка подпись фамилия и.о. консультанта _____________________________________ _____________________________________ оценка подпись фамилия и.о. консультанта оценка подпись фамилия и.о. консультанта Считаю возможным допустить обучающегося к предзащите ВКР Мухамадиев А.Ф. Фамилия И.О. обучающегося Научный руководитель __________________ подпись Электронный вариант ВКР передан на кафедру. Зав. кафедрой __________________ подпись АННОТАЦИЯ В данной выпускной квалификационной работе (ВКР) рассмотрена технология очистки промышленных выбросов на предприятии нефтегазовой отрасли. В ВКР дана краткая характеристика предприятия, рассмотрена действующая технология очистки нефтегазовых выбросов, изучены альтернативные технологии по уменьшению выбросов; приводится подбор оборудования с целью снижения негативного влияния на окружающую среду, приводится эколого-экономическое обоснование предложенного решения. Структура работы представлена введением, 8 главами, заключением, списком использованных источников. В ВКР - общее количество страниц , использовано 13 таблиц, 8 рисунков. СодержаниеВведение 7 1 Краткая характеристика предприятия 8 2 Оценка степени воздействия предприятия на окружающую среду 9 3 Описание технологической схемы очистки от оксида углерода 11 3.1 Очистка газов от оксида углерода 11 ВведениеВклад нефтегазового комплекса в загрязнение воздуха в течение последних лет стабильно растет, за последние 5 лет он вырос примерно в 1,7 раза. Две трети атмосферных выбросов, генерируемых нефтегазовым комплексом, приходится на нефтедобычу. Активность нефтедобывающих компаний дорого обходится окружающей природной среде. Нефтегазовыми предприятиями России в атмосферу выбрасывается около 2 млн.т вредных веществ, в числе которых на долю углеводородов приходится 48%, окиси углерода — 33% и на твердые вещества (сажу) — 2%. Суммарный выброс загрязняющих веществ предприятиями отрасли составляет 9 — 10% от валового выброса по стране. Страдает прежде всего воздушная среда — улавливается и обезвреживается лишь 10 — 20% загрязнителей. В связи с этим, целью ВКР является анализ технологической очистки выбросов на предприятии нефтегазовой отрасли. Для достижения цели были поставлены следующие задачи: - рассмотреть общие сведения о предприятии; - рассмотреть действующую технологию очистки выбросов на предприятии; - провести анализ современных технологий по очистке выбросов предприятии нефтегазовой отрасли; - произвести расчёт оборудования и дать эколого-экономическую оценку предлагаемого технического решения; - изучить безопасность труда на предприятии. 1 Краткая характеристика предприятияДеятельность рассматриваемого предприятия заключается в добычае нефти и газа, и их дальнейшей транспортировке. Основными видами деятельности Компании являются: - производство геологоразведочных работ и разработка нефтяных, газовых и иных месторождений; - добыча, сбор, подготовка, транспортировка, переработка, хранение и реализация нефти, газа и продуктов их переработки; - производство буровых, строительно-монтажных, ремонтно-строительных и дорожных работ; - внешнеэкономическая деятельность; - сoздание безопасных условий труда, разработка и утверждение в установленном порядке правил, норм и типовых инструкций по охране труда и технике безопасности; Производственная деятельность отвечает высоким стандартам в промышленной и экологической безопасности [1]. 2 Оценка степени воздействия предприятия на окружающую средуПроизводственная деятельность по добыче нефти, концентрируя в себе колоссальные запасы энергии и вредных веществ в виде нефтяных углеводородов, является постоянным источником техногенной опасности и возникновения аварий, сопровождающихся чрезвычайными ситуациями и загрязнением природной среды. Геохимический техногенез свойственен всем этапам освоения месторождений углеводородов: бурения поисково-разведочных и эксплуатационных скважин, разработки и эксплуатации месторождения, ликвидации промысловых сооружений. Нефтегазовый комплекс оказывает влияние на все элементы природной среды: атмосферу, гидросферу, почву, грунты, растительность и животный мир. Основными источниками выбросов в атмосферу являются: скважины; технологические установки; резервуары нефти; факельное сжигание; выпуск и продувка газа; выжигание разлитой нефти; работа двигателей внутреннего сгорания; утечки газа и испарение легких углеводородов[2]. В атмосферу могут попадать углекислый газ, окись углерода, окислы азота, сернистые соединения, метан, метанол, летучие компоненты деэмульгаторов и ингибиторов коррозии, сажа и др. На предприятиях нефтегазового комплекса применяется значительное число технологических процессов, в отходящих пылегазовоздушных выбросах которых содержатся частицы пыли и вредные газовые примеси. Выброс таких веществ пагубно влияет на состояние окружающей природной среды, особенно на состояние атмосферы. К возможным воздействиям разработки нефтяного месторождения на гидросферу и почву относятся: изменение стока из-за нарушения рельефа; прямое или косвенное воздействие на источники воды в результате удаления растительного покрова; загрязнение грунтовых и поверхностных вод в результате сбросов, утечек, дренажа и случайных разливов, связанных с эксплуатацией промысловых объектов; эрозия почвы в результате изменения наклона поверхности и запруживания воды;нарушение почвенно-растительного слоя; накопление строительных и бытовых отходов; загрязнение территории нефтепродуктами, отработанными буровыми растворами и другими веществами, применяемыми при бурении [3]. Оксид углерода СО образуется на предприятии в результате неполного сгорания жидкого, твердого и газообразного топлива. Он входит в состав газов, выделяющихся в процессах выплавки и переработки черных и цветных металлов, выхлопных газов двигателей внутреннего сгорания, газов, образующихся при взрывных работах. Методы санитарной очистки выбросов от оксида углерода дороги и несовершенны. Это не позволяет подвергать санитарной очистке значительные объемы выбросов, содержащих СО. Чаще выполняют очистку газов от СО в технологических целях: например, газы, подаваемые на синтез аммиака, должны содержать не более 5-10 промилей СО, который является каталитическим ядом. Однако наряду с оксидом углерода в зависимости от условий конкретного производства в газах могут содержаться и другие токсичные компоненты: диоксид серы, , пары различных углеводородов. Кроме того, в них обычно присутствуют диоксид углерода, кислород, азот, пары воды и часто механические примеси в виде различных пылей. Некоторые из этих примесей могут быть ядами для катализаторов[4]. 3 Описание технологической схемы очистки от оксида углерода3.1 Очистка газов от оксида углеродаОксид углерода (карбоксид) представляет собой высокотоксичный газ. Установлены жесткие предельно допустимые его концентрации: в рабочей зоне - 20 мг/м3, в атмосфере (максимально-разовая) - 5 мг/м3, среднесуточная - 3 мг/м3. Оксид углерода CO образуется в результате неполного сгорания жидкого, твердого и газообразного топлива. Он входит в состав газов, выделяющихся в процессах выплавки и переработки черных и цветных металлов, выхлопных газов двигателей внутреннего сгорания, газов, образующихся при взрывных работах. Методы санитарной очистки выбросов от оксида углерода дороги и несовершенны. Это не позволяет подвергать санитарной очистке значительные объемы выбросов, содержащих CO[6]. Чаще выполняют очистку газов от СО в технологических целях: например, газы, подаваемые на синтез аммиака, должны содержать не более 5-10 промилей CO, который является каталитическим ядом. 3.2 Каталитическая очистка газов от оксида углерода Каталитическое окисление является наиболее рациональным методом обезвреживания отходящих газов промышленности от оксида углерода. Однако наряду с оксидом углерода в зависимости от условий конкретного производства в газах могут содержаться и другие токсичные компоненты: диоксид серы. оксиды азота, пары различных углеводородов. Кроме того, в них обычно присутствуют диоксид углерода, кислород, азот, пары воды и часто механические примеси в виде различных пылей. Некоторые из этих примесей могут быть ядами для катализаторов[7]. Процесс очистки газовых смесей с высоким содержанием СО осуществлтся с использованием реакции водяного газа (конверсией с водяным паром), проводимой в присутствии окисных железных катализаторов: CO + Н2O = CO2 + Н2 + 37,5 кДж/моль. Процесс применим для очистки водорода, получаемого конверсией природного газа, кроме того, метод используют для изменения соотношения H2 : CO в синтез-газе, а также для очистки защитной атмосферы, предназначенной для термообработки металлов. Промышленный катализатор конверсии имеет форму таблеток размером 6,4x6,4 или 9,6x9,6 мм. Он содержит от 70 до 85% Fe2O3 и 5-15 % промотора Cr2O3. Катализатор относительно устойчив в присутствии сернистых соединений при непродолжительном воздействии капельной влаги; он сохраняет активность вплоть до 600оС. В случае высоких концентраций CO в исходном газе катализатор в контакторе располагают в несколько слоев, причем необходимо предусмотреть меры для отвода тепла между слоями. Схема процесса представлена на рисунке 1 [3]. 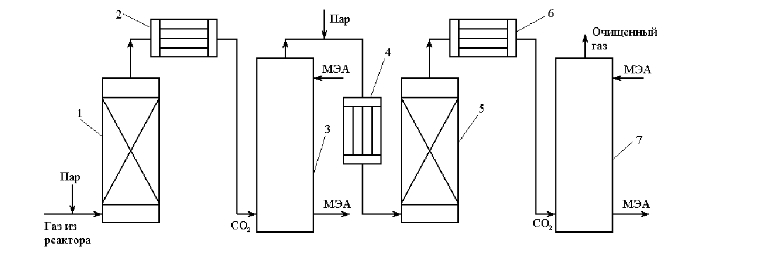 Рисунок 1 - Схема установки для очистки газов от оксида углерода реакцией: 1-конвертор СО первой ступени; 2, 6 - холодильники; 3 - абсорбер CO2 первой ступени; 4 - нагреватель газа; 5 - конвертор СО второй ступени; 7 - абсорбер CO2 второй ступени Газовую смесь, образованную в результате конверсии природного газа с паром и содержащую водород, оксид и диоксид углерода, после выхода из реактора конверсии охлаждают добавкой водяного пара до 370о и пропускают через конвертор первой ступени 1. Здесь в присутствии катализатора 90-95% CO превращается в CO2 с образованием эквивалентного количества водорода. Газ охлаждают в водяном холодильнике 2 до 35-40оС и извлекают из него диоксид углерода этаноламином. очищенный газ подогревают, добавляют необходимое количество водяного пара, снова подвергают конверсии и очистке от образовавшегося CO2. С целью получения водорода повышенной чистоты иногда процесс проводят в три ступени. После третьей ступени газ имеет состав: 99,7% (об.) H2; 0,02% CO; 0,01% CO2; О,27% CH4. Каталитические гидрирование оксида и диоксида углеродов в метан обычно применяется для очистки небольших остаточных количеств этих соединений (не более 2%) в газовых потоках после удаления основной массы их при помощи других методов. Метод используется особенно часто в тех случаях, когда присутствие метана не ухудшает условий дальнейшей переработки или использования газов. Типичным примером применения этого процесса может быть удаление оксидов углерода из водорода после конверсии CO и абсорбции CO2 жидкостными процессами. Остаточное содержание оксидов углерода в очищенном газе составляет несколько десятитысячных долей процента. Одновременно происходит удаление свободного кислорода, если он присутствует в газе. Схема процесса представлена на рисунке 2[4]. Р 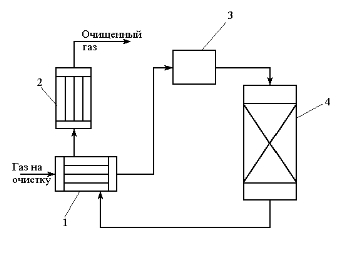 еакция метанирования оксидов углерода: Рисунок 2 – Схема установки для очистки газа метанированием: 1- теплообменник; 2 - холодильник; 3 - печь; 4 — реакторCO + 3H2 = CH4 + H2O + 218 кДж/моль; CO2 + 4H2 = CH4 + 2H2O + 180 кДж/моль. Промышленный катализатор содержит 76-78% N0 и 20-22% Al2O3. Его изготовляют, как и в предыдущем случае, в виде таблеток. Срок службы катализаторов достигает несколько лет[5]. Газ после колонны этаноламиновой очистки от CO2 подогревается сначала в теплообменник теплом продуктов метанирования, а затем до 260-270oС в печи. Нагретый газ сверху вниз проходит через слой катализатора, охлаждается в теплообменнике и в концевом холодильнике, после чего поступает на синтез аммиака или используется для других целей. Вследствие неблагоприятного воздействия высоких температур на равновесие реакции и стабильность работы катализатора режим работы в реакторе регулируют таким образом, чтобы температура газа на выходе из реактора не превышала 440oС. Процесс отличается высокой экзотермичностью: повышение температуры в реакторе составляет 56oС на каждый процент карбоксида, содержащийся в газе. Это препятствует использованию данного процесса применительно к газам, содержащим более 2% кислорода, оксида и диоксида углерода в сумме[2]. 3.3 Абсорбционная очистка газов от оксида углерода В качестве абсорбента для поглощения CO применяют медноаммиачные растворы (МАР). В процессе абсорбции СО под высоким давлением поглощается в противоточном абсорбере раствором комплексного медно-аммиачного соединения. Чаще других используются растворы формиата, карбоната или ацетата меди. Раствор имеет слабощелочной характер, вследствие чего одновременно поглощается и диоксид углерода. Регенерацию проводят нагревом, под действием тепла комплекс разлагается и оксиды углерода полностью выделяются. Степень очистки зависит от парциального давления CO над регенерирова-нным раствором и общего давления газа. Чтобы улучшить условия очистки, абсорбцию проводят при высоком давлении - 32 МПа и низкой температуре - около 0oС. Десорбцию ведут при атмосферном давлении и температуре около 60oС. Более высокие температуры приводят к интенсивному выделению аммиака. Схема установки приведена на рисунке 3[5].  Рисунок 3 Схема установки медно-аммиачной очистки газов: 1 - абсорбер; 2 - насос; 3 - водяной холодильник; 4 — аммиачный холодильник 5 - емкость; 6 – десорбер После очистки газ, содержащий не более 40 см3/м3 СО и до 150 см3/м3 CO2, подается в скрубберы, орошаемые аммиачной водой (на схеме не показан), где он освобождается от остальной CO2, и затем в цех синтеза NH3. Регенерацию МАР проводят путем снижения Р и нагревания раствора в 6. В результате предварительного дросселирования МАР до 0,8 МПа из него удаляются растворенные H2 и N2. При дальнейшем дросселировании до 0,1 МПа и нагревании раствора до 45-50оС происходит разложение медноаммиачного комплекса и выделение CO[1]. Для нагревания отработанного раствора до 60оС служит отходящий регенерированный раствор, а для окончательного нагрева до 80оС - пар. Регенерированный раствор охлаждают последовательно поступающим отработанным раствором, оборотной водой в теплообменнике 3 и испаряющимся жидким NH3 в холодильнике 4, после чего регенерированный раствор при 10оС направляют на абсорбцию. В случае необходимости проводят окисление Си+ продуванием воздуха через регенерированный раствор. Для разложения углекислого аммония при атмосферном давлении раствор нагревают не выше 80оС. Поскольку при более высокой температуре медноаммиачный комплекс разлагается, для более полной регенерации вторую ее ступень проводят в вакууме[3]. 4 Очистка газов от диоксида серы Диоксид серы (SО2) появляется в атмосфере в результате трех процессов. Во-первых, он является побочным продуктом естественного биологического распада и вулканической деятельности. В глобальном масштабе этот источник является самым большим. Во-вторых, SО2 выбрасывается в атмосферу в результате сгорания твердого и жидкого топлива, содержащего серу. Этот источник является доминирующим в определенных частях мира с высоким развитием промышленности. Третий источник – это ряд промышленных процессов, таких как обжиг руды. Сера, содержащаяся в топливе и рудах, при их сжигании или термической переработке превращается в сернистый газ. Предварительное обессеривание топлива и руд протекает неполностью, а потому не может в полной мере решить проблемы ликвидации выбросов SО2 в атмосферу. В химической промышленности основным источником загрязнения атмосферы SО2 является сернокислотное производство. Загрязнение биосферы указанным компонентом или продуктами на его основе наносит вред здоровью людей, отрицательно действует на растительный и животный мир, разрушает конструкции и металлические сооружения, снижает урожайность сельскохозяйственных культур, т. е. наносит экономический ущерб народному хозяйству. Наряду с этим, отходящие газы, содержащие SО2, могут служить мощным источником получения различных серосодержащих продуктов: серной кислоты, концентрированного SО2, элементарной серы, гипса и сульфатов различных металлов, растворов бисульфита и т.д[7]. Концентрация SО2 в дымовых газах электростанций зависит от содержания серы в топливе. Так, при сжигании мазута с содержанием серы 3 % (масс.) концентрация SО2 в дымовых газах 0,4 %. К сожалению, до последнего времени в большинстве случаев, особенно на электростанциях, единственным способом борьбы с загрязнением атмосферы SО2 является его рассеивание через высокие трубы. При выдаче рекомендации по ПДК ВОЗ учитывала следующие токсикологические свойства SО2: 1) нарушение видимости и раздражающее действие наступает при среднегодовой концентрации SО2, равной 0,08 мг/м3 ; 2) нарушение со стороны органов дыхания – при среднегодовой концентрации 0,10 мг/м3 ; 3) ухудшение состояния больных легочными заболеваниями – при среднесуточной концентрации 0,25-0,50 мг/м3 ; 4) повышение смертности и числа госпитализаций – при среднесуточной концентрации 0,50 мг/м3 . ВОЗ рекомендовало ПДК среднегодовую, равную 0,06 мг/м3 [8]. В РФ установлены следующие ПДК на SО2: в рабочей зоне – 10 мг/м3 ; максимально разовая – 0,5 мг/м3. 4.1 Абсорбционные методы очистки газов от SО2 Первыми методами очистки отходящих газов от SО2 были методы, основанные на промывке газа щелочными растворами иливзвесями, переводящими оксиды серы в сульфиты, бисульфиты и сульфаты. Преимуществом этих методов является высокая степень очистки, простота процессов и надежность работы очистных установок. Существенным недостатком мокрых методов является повышенный теплообмен между нагретыми отходящими газами и промывной жидкостью. При этом часть раствора испаряется, а очищаемые газы насыщаются водяным паром, охлаждаясь до температур 40-60 оС. В дальнейшем при выбрасывании в атмосферу, водяной пар конденсируется, и термическая подъемная сила газа уменьшается. Это может привести к быстрому опусканию потока газа вблизи выбросных труб, где концентрация SО2 окажется значительной. Для большинства мокрых методов требуется сравнительно громоздкая аппаратура, а получающиеся в процессе очистки продукты не всегда находят сбыт. Разрабатываемые в настоящее время процессы направлены, в основном, на решение вопроса эффективной очистки газа с одновременным получением утилизируемых продуктов. Во всех методах с использованием сульфит-бисульфитных растворов механизм поглощения SО2 одинаков. Вначале SО2 взаимодействует с водой, образуя малоустойчивую сернистую кислоту. При определенном соотношении SО2 в газе и сернистой кислоты в растворе должно наступить состояние равновесия. Чтобы полностью поглотить SО2 из газов, необходимо нейтрализовать сернистую кислоту, что достигается растворенной щелочью, которая, взаимодействуя с кислотой, образует сульфит: 2MeOH + SО2 MeSO3 + H2O Образующийся сульфит может взаимодействовать с кислотой с образованием бисульфита: Me2SO3 +HSO3 2MeHSO3. При взаимодействии кислой соли со щелочью снова получается средняя соль: MeHSO3 + MeOH Me2SO3 + H2O. Сульфит может взаимодействовать с растворенным кислородом, образуя сульфат: 2Me2SO3+O2 2Me2SO4. В регенеративных циклических схемах образование сульфата является нежелательным, и, как правило, ведет к усложнению процесса. Наибольшее распространение среди поглотителей диоксида серы суспензии извести или известняка (известковые методы), суспензии магнезита (магнезитовые методы)[9]. 4.1.3 Известковые методы Наиболее дешевыми и доступными материалами для улавливания SО2 из выбросных газов по известковому способу являются известняк, известь, мел. В основе процесса лежат следующие реакции: CaCO3 + SO2 CaSO3 + CO2; CaO + SO2 CaSO3; 2CaSO3 + O2 2CaSO4.Сульфит кальция плохо растворим в воде (0,136 г/л), в процессе очистки быстро пересыщает раствор и выпадает в виде мелких кристаллов. Если сернистая кислота в растворе нейтрализована, то SO2 растворяется с максимальной скоростью и практически полностью может быть извлечен из газа. Одним из вариантов этого метода является промывка газа суспензией извести или известняка и состоит из следующих стадий: 1) очистка отходящих газов от пыли и золы; 2) промывка газа известковым молоком; 3) отделение кристаллов сульфита и сульфата от жидкости. Предварительная очистка отходящих газов связана с тем, что пыль легче выделить в сухом виде, чем из раствора. В качестве золоуловителей обычно применяют батарейные циклоны. Схема очистки приведена на рисунке 5 Предварительно очищенный от пыли газ поступает в скруббер 1, где происходит удаление SО2.Скруббер орошается по замкнутому циклу. К вытекающей из скруббера кислой жидкости постоянно добавляется свежее известковое молоко[1]. По мере насыщения жидкости в ней накапливаются кристаллогидраты сульфита и сульфата кальция состава CaSO3*0,5H2O и CaSO4*2H2O и частицы золы, не задержанные циклонами. Для предотвращения забивки насадки и коммуникаций кристаллами в цикле оборота орошающего раствора установлен кристаллизатор 2, представляющий собой полый аппарат, в котором находится раствор в течение времени, необходимого для образования и роста кристаллов сульфита и сульфата. Из кристаллизатора часть раствора поступает на орошение скруббера, а часть отбирается и подается на вакуум-фильтр 3, где кристаллы отделяются от фильтрата, который возвращается в систему орошения, а шлам направляется в отвал[4]. Рисунок 5 – Схема известкового процесса очистки газа: 1-скруббер; 2 – кристаллизатор; 3 – вакуум-фильтр; 4 – емкость; 5 – мельница; 6 – дробилка  4.4 Магнезитовые методы Магнезитовые методы основаны на связывании SО2 оксидом магния с образованием сульфита магния: MgO + SО2 = MgSO3. Сульфит магния, взаимодействуя с SО2, может образовывать бисульфит: MgSO3 + SО2 + H2O = Mg(HSO3)2. Часть сульфита магния под действием кислорода, содержащегося в очищаемом газе, окисляется до сульфата: 2MgSO3 + O2 = 2MgSO4. Сульфат магния не активен по отношению к SО2, поэтому последняя реакция является нежелательной. Скорость окисления сульфита в сульфат магния может быть сведена к минимуму добавлением к поглотительному раствору 0,005-0,01 % ингибитора - парафенилендиамина (ПФДА). Образовавшийся в процессе насыщения бисульфит магния подвергается нейтрализации добавлением соответствующих количеств свежего оксида магния: Mg(HSO3)2 + MgO = 2MgSO3 + H2O. Растворимость сульфита магния в воде ограничена, поэтому образовавшийся при нейтрализации избыток сульфита выпадает в осадок в виде кристаллов гексагидрата MgSO3*6H2O. При температуре выше 50 последний может переходить в тригидрат 2MgSO3*3H2O. Кристаллы выводятся из суспензии, сушатся и подвергаются термическому разложению при температуре 800-900 оС. MgSO3 MgO + SО2. Оксид магния возвращается в процесс, а концентрированный SО2 может быть переработан в серную кислоту или элементарную серу. Магнезитовый «бескристальный» метод предложен и проверен НИИОгазом. Основан на эффекте растворения кристаллов сульфита магния, образующихся на насадке, по реакции: MgSO3 + H2SO3= Mg(HSO3)2. Образующийся бисульфит магния при обычных условиях не существует в твердом состоянии, и, следовательно, не образует насыщенных растворов[4]. По схеме «бескристального» метода кристаллы из раствора выделяются в специальном аппарате-нейтрализаторе, где бисульфит магния взаимодействует с магнезитом. В цикле сорбции находится обычно минимальное количество (2-3 %) кристаллов сульфита магния. Это значительно облегчает работу установки. Схема метода приведена на рисунке 5. Газ подается в скруббер 1, где очищается от SО2. Поглотительный раствор, содержащий до 50-70 г/л бисульфита магния, из скруббера поступает в циркуляционный сборник 2, из последнего часть раствора подается в напорный бак 3 и возвращается на орошение скруббера, а часть – в нейтрализатор 4 для выделения кристаллов MgSO3*6H2O, куда также подается необходимое количество сухого магнезита. Нейтрализатор 4 служит не только для нейтрализации бисульфита, но и для роста кристаллов гексагидрата, поэтому его емкость должна быть рассчитана на пребывание в нем суспензии в течение 30-35 мин. Условием получения и быстрого роста кристаллов является хорошее перемешивание. Выделенные на вакуум-фильтре кристаллы поступают в многополочную печь кипящего слоя 8. На верхних полках печи происходит сушка и дегидратация кристаллов в токе горячего газа, а на нижних – термическая диссоциация обезвоженных кристаллов при температуре 800-900 оС. При этом получается высококонцентрированный (18-19 %) сернистый газ и вторичный (оборотный) магнезит. Сернистый ангидрид может быть переработан в серную кислоту или элементарную серу, а оборотный магнезит возвращается через дозирующее устройство в циркуляционный сборник, замыкая технологический цикл. Маточный раствор и промывные воды с фильтр-пресса 7 поступают в сборник осветленного раствора 10. Сюда же подается некоторое количество воды для компенсации потерь и около половины оборотного магнезита, поступающего из обжиговой печи 8, для нейтрализации кислого раствора из сборника 2. 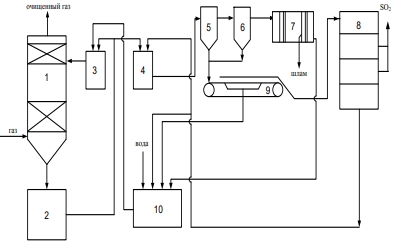 Рисунок 5 – Схема магнезитового «бескристального» метода: 1–скруббер; 2–циркуляционный сборник; 3–напорный бак;4–нейтрализатор; 5, 6 – гидроциклоны; 7 – вакуум-пресс; 8 – обжиговая печь; 9–ленточный вакуум-фильтр; 10 – сборник Раствор из сборника 10 подается в напорный бак 3, где смешивается с кислым раствором из циркуляционного сборника и подается на орошение. Достоинством магнезитового процесса является возможность очистки запыленных газов, имеющих высокую температуру. Благодаря невысокой корр-озионной активности все оборудование можно выполнить из обычных конструкционных сталей с применением кислотостойких покрытий. Существенными недостатками способа является наличие в циркулирующем растворе твердой фазы, возможность забивки аппаратуры и трубопроводов кристаллами гексагидрата сульфита магния и большой расход топлива на регенерацию магнезита[8]. 5.1 Расчет абсорбера ОБРАЗЕЦ ОФОРМЛЕНИЕ ФОРМУЛ 1. Нагрузка от транспортируемого грузана 1 п.м. определяем по формуле (1) [13]: 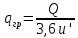 (1) (1)qгр= 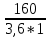 = 44,4 кг/м= 444 н/м = 44,4 кг/м= 444 н/м Рассчитать насадочный абсорбср с кольцами Рашига 10х10 мм со свободным объёмом 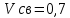 , с удельной поьерхностью , с удельной поьерхностью 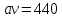 для абсорбции воздушно-аммиачной смеси при = 20 ° С и p=1 атм. Начальная концентрация оксида углерода в воздухе y=0,15 мольных долей, массовый расход газовых смеси G=0,11 кг/с. Начальная концентрация оксида углерода в жидкости x=0. Степень извлечения m = 1, число насадочных элементов в 1 м N=250000 штук. для абсорбции воздушно-аммиачной смеси при = 20 ° С и p=1 атм. Начальная концентрация оксида углерода в воздухе y=0,15 мольных долей, массовый расход газовых смеси G=0,11 кг/с. Начальная концентрация оксида углерода в жидкости x=0. Степень извлечения m = 1, число насадочных элементов в 1 м N=250000 штук.К онцентрация компонента в газовой фазе на выходе из аппарата (1) О 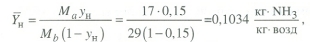 тносительная массовая концентрация (2) К 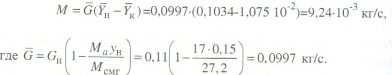 оличество переданной массы M (3) М  олекулярная масса смеси газов М смг: Минимальный расход жидкого поглотителя Lmin (4) 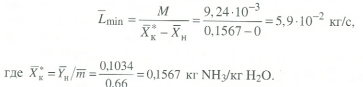 Р  абочий расход поглотителя (5): Д 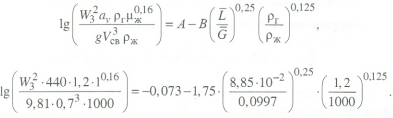 ля данной насадки – кольца Рашига в навал с параметрами: Vсв=0,7 м3/м3, av= 440 м2/м3 = уравнение примет вид: Р абочая скорость газа W (6): Средняя сила массопередачи (7): 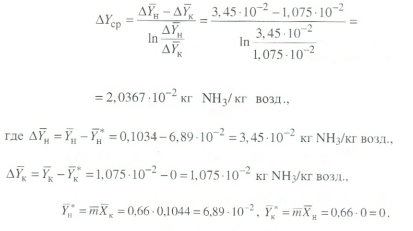 Сопротивление сухого насадочного слоя Δ Pсух (8):  С 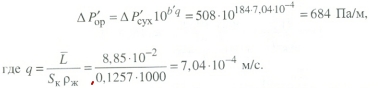 опротивление орашаемого насадочного слоя ΔPор (9): Критерий Галилея Ga (10): 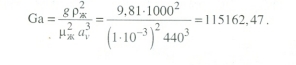 Коэффицент массопередачи Kог (11): 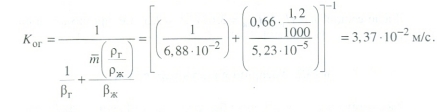 Поверхность массопередачи F, рассчитанные по формулам (3) и (5), согласуются с погрешностью 1%, следовательно расчет выполнен правильно. В 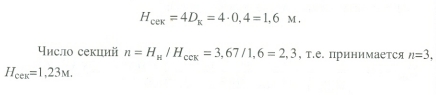 ысота секции насадки в абсорбере: Список литературы 1. Кириллов О.А., Кабанов А.Н., Савинков С.В. Экономическая эффективность переработки шламов нефтеперерабатывающего предприятия. Успехи в химии и химической технологии. 2014. №10. С. 105-107 2. Шарафутдинов, Н.С. Нефтедобывающая отрасль Республики Татарстан: основные тренды и перспективы развития / Н.С. Шарафутдинов, Л.Р. Вафин // Международный научно-исследовательский журнал. – 2017. – В. №10 – С. 132-135. 3. Ысмаил Э., Жусупова Л.А. Экологические проблемы нефтяных отходов [Электронный ресурс] / Э. Ысмаил, Л. А. Жусупова. // Молодой ученый. — 2018. — № 44.1 — С. 21-23. — Режим доступа: https://moluch.ru/archive/230/53759/ - (Дата обращения: 05.03.2022). 4. Серый С. Перспективы использования биопрепаратов углеводооксиляющих микроорганизмов для обезвреживания, переработки, утилизации нефтесодержащих отходов [Электронный ресурс] / С. Серый, Б. Анохин // Экологический советник. – Режим доступа: http://www.nefteshlamy.ru/stat.php?id=43 – (Дата обращения: 10.03.2022). 5. Методологические принципы выбора оптимальных наполнителей композиционных материалов / Прошин А.П., Данилов А.М., Королев Е.В., Смирнов В.А., Бормотов А.Н. // Известия высших учебных заведений. Строительство. – 2004. – № 10. – С. 15–20. 7. Глетглицериновые строительные материалы для защиты от радиации / Королев Е.В., Бормотов А.Н., Иноземцев А.С., Иноземцев С.С. // Строительные материалы. – 2009. – № 12. – С. 69–71. 8. Сверхтяжелый бетон для защиты от радиации / Баженов Ю.М., Прошин А.П., Еремкин А.И., Королев Е.В., Бормотов А.Н. // Строительные материалы. – 2005. – № 8. – С. 6–9. | |||||||||||||||||||||||||||||||||||||||||

 К Г Э У
К Г Э У