|
|
реферат. Реферат на тему получения золота. Технология получения золота
ФГАОУ ВПО «Уральский Федеральный Университет
имени первого Президента России Б.Н.Ельцина»
Институт новых материалов и технологий
Кафедра: Металлургия цветных металлов
Реферат
Дисциплина: «Металлургия цветных металлов»
Тема: «Технология получения золота»
Выполнили:
студенты группы НМТ-202202
Яблоков П. С., Южаков Н. А.
Проверил:
преподаватель
Кырчиков А.В.
Екатеринбург
2022 г.
Золото:
Зо́лото (Au от лат. Aurum) — элемент 11 группы (по устаревшей классификации — побочной подгруппы первой группы), шестого периода периодической системы химических элементов, с атомным номером 79. Простое вещество золото — благородный металл жёлтого цвета.
 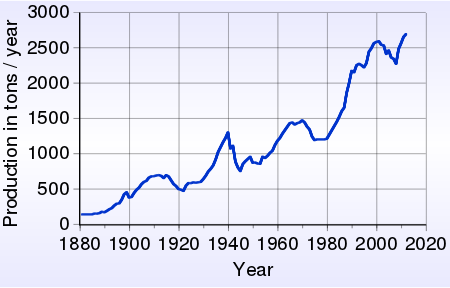
Производство золото
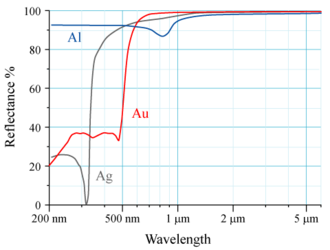
Спектральный коэффициент отражения золота (Au) и для сравнения алюминия (Al) и серебра (Ag)
Происхождение:
Зарядовое число 79 золота делает его одним из высших по количеству протонов элементов, которые встречаются в природе. Ранее предполагалось, что золото образовывалось при нуклеосинтезе сверхновых звёз, однако по новой теории предполагается, что золото и другие элементы тяжелее железа образовались в результате разрушения нейтронных звёзд. Спутниковые спектрометры в состоянии обнаружить образующееся золото лишь косвенно, «у нас нет прямых спектроскопических доказательств, что такие элементы действительно образуются. По этой теории в результате взрыва нейтронной звезды содержащая металлы пыль (в том числе тяжёлые металлы, например, золото) выбрасывается в космическое пространство, в котором оно впоследствии конденсируется, так произошло в Солнечной системе и на Земле. Поскольку сразу после своего возникновения Земля была в расплавленном состоянии, почти всё золото в настоящее время на Земле находится в ядре. Большинство золота, которое сегодня присутствует в земной коре и мантии, было доставлено на Землю астероидами во время поздней тяжёлой бомбардировки.
На Земле золото находится в рудах и породах, образованных начиная с докембрийского периода[33].
Области применения золота:
Одной из ключевых сфер, где используется золото, является промышленное производство. Особая важность драгметалла в этой отрасли человеческой деятельности обусловлена специфическими свойствами, а именно ковкостью и тягучестью.
Также золоту свойственна высокая степень устойчивости к агрессивным воздействиям, что немаловажно для химического направления и электроники. При этом даже низкая тепло- и электропроводность не делает золото менее востребованным, чем медь.
Отраслевое применение у золота достаточно широкое: от пищевой индустрии до атомной промышленности и ракетостроения.
Основные направления, в которых этот драгоценный металл используется в промышленных целях, могут быть перечислены следующим списком:
1)В ядерной промышленности золото используется как мишень в воспроизведении атомной реакции в ускорителях элементарных частиц.
2)Изготовление одной из оболочек нейтронной бомбы.
3)Создание покрытия для стекла и зеркал при строительстве и создании скафандров. Он не пропускает вредное излучение и служит теплоизоляцией.
4)Драгоценный металл используется в качестве сварочного материала при пайке, является незаменимым решением при создании передовых технических образцов, термопар или мелких составляющих гальванометров.
5)Пластичность материала позволяет создавать тончайшую драгоценную фольгу, или сусальное золото. Им покрывают предметы для декоративного эффекта и защиты от ржавчины.
Хлорное золото является очень важным соединением, которое получают при растворении металла в «царской водке». Хлорное золото применяется для получения красного стекла высокого качества, его также называют золотым рубином. Впервые такое стекло было получено в конце 17 века Иоганном Кункелем. В процессе его изготовления хлорное золото соединяют с шихтой. В зависимости от количества золота, получается стекло с определенным оттенком – от бледно-розового, до рубинового и темно-пурпурного. Такой метод окрашивания стекла обходится относительно недорого, поскольку требует микроскопического количества хлорного золота для большой партии изделий.
Хлорное золото используют для нанесения рисунков на стекло и фарфор. Также оно долгое время применялось фотографами как тонирующий реагент. К примеру, «Вираж-фиксаж с золотом» помогал придать фотографиям черно-фиолетовый иди коричневый оттенок.
В промышленности:
Научно-технический прогресс значительно расширил сферы применения золота. Это объясняется его физико-химическими характеристиками. Оно обладает высокой стойкостью к воздействию агрессивных сред, противостоит коррозии. Обладает уникальной электропроводностью, немного уступая меди и серебру. Способность золота к отражению инфракрасных лучей приближается к ста процентам, в сплавах оно обладает каталитическими свойствами.
1)Чтобы детали космических и авиационных двигателей не поддавались коррозии, сплавы золота применяют для спаивания контактов. Золото надёжно защищает от инфракрасного излучения, поэтому его добавляют в светофильтры шлемов скафандров.
Хотя космонавтика не может обойтись без золота, но его используют в небольших количествах. Так, за 37 лет НАСА для постройки ракет понадобился 41 килограмм золота.
2)Современный автомобиль комплектуют микросхемами, в которых тоже содержится золото. Оно стало применяться в системе безопасности авто.
Его используют в микросхемах, которые отвечают за антиблокировку системы тормозов, в сенсорах, активирующих подушки безопасности при столкновениях и авариях. Нанопокрытие с содержанием золота стали использовать в выхлопных системах для снижения выбросов в окружающую среду вредной химии.Содержание золота в одном современном автомобиле ничтожно, а вот в машинах старого типа его может быть от 1 до 30 грамм.
3) Золото нашло применение в современных системах, которые аккумулируют солнечную энергию. Драгметалл используют при остеклении зданий: тончайшая плёнка коллоидного здания на стеклополотне предотвращает нагревание воздуха. Уже сегодня многие здания в США и Японии сдаются в эксплуатацию со стеклопакетами с золотым покрытием. В Торонто при строительстве небоскрёба на 14 тысяч окон было использовано 70 килограммов золота.
4) Золото применяют в измерительной технике. Оно необходимо для контроля температуры. В основном используют сплавы золота с кобальтом или хромом. В химической промышленности золото главным образом используют для плакирования стальных труб, предназначенных для транспортировки агрессивных веществ.
В медицине и пищевой отрасли:
Основная область медицины, где применяется желтый металл, — стоматология и протезирование зубов. Для создания напыления, коронок, зубных протезов применяют высокопробные сплавы. Они обладают высоким уровнем инертности, поэтому не темнеют и не подвержены влиянию внешних факторов.
В качестве финансового инструмента:Солнечный металл используется как инструмент инвестиций. Для сохранности капитала не обязательно скупать ювелирные украшения — достаточно открыть металлический вклад в банке. Вложить деньги можно и в покупку памятных монет в Сбербанке, которые изготавливают из высокопробного сплава.
В ювелирной отрасли:
Большая часть добытого человечеством золота используется в ювелирной области. Самые древние украшения относятся к III тысячелетию до н.э. и принадлежат шумерской цивилизации.
Для создания драгоценностей используют сплавы, так как в чистом виде этот металл слишком мягок и легко повреждается. На изделиях ставят клеймо, которое подтверждает подлинность украшения и его сорт. В России и странах СНГ для оценки качества материала действует система проб, которая позволяет определить количество чистого элемента в предмете.

Сплавы золота:
Сплавы золота:Сплавы золота — сплавы, основным компонентом (или одним из компонентов) которых является золото. Такой термин был введён итальянским медиком и алхимиком Арнольдом де Вилланова в 1289 году. При этом доля содержания основного компонента (Au) выше вспомогательных. Добавление лигатур меняет свойства основного металла.
Самые распространенные сплавы золота: жёлтое (европейское) золото, красное (советское) золото, зелёное золото, белое золото. Именно такой цвет приобретают сплавы. Всё зависит от добавочных металлов (лигатуры).
Для получения зелёного золота используется 58,5 % Au и 41,5 % лигатуры. В лигатуре берется 3 части Ag и 1 часть Сu. При получении красного золота используется такое же соотношение основного металла и лигатуры. А вот лигатура содержит 3 части Cu и 1 часть Ag.
Жёлтое золото — соединения золота с серебром и медью. Золото и лигатура берутся в равных пропорциях. В лигатуре соотношения меди и серебра 50/50. Данный вид сплава очень распространён при производстве монет и ювелирных украшений, а также при производстве микросхем.
Сплав белого золота отличается от других. В данный сплав добавляется легирующее вещество на основе никеля, палладия или мельхиора. Главное, процентное содержание лигатуры не должно превышать содержание основного металла.
Сплавы золота использовались с давних времён, однако не было общепринятых норм и стандартов. Арнольд де Вилланова первый, кто постарался классифицировать сплавы золота. Он доказал, что независимо от металлов, которые добавляются к золоту, в сплаве сохраняются основные свойства золота.
Химические свойства:
Из чистых кислот золото растворяется только в концентрированной селеновой кислоте при 200 °C с образованием жёлтого осадка (селената золота) и селенистой кислоты:
2Au+6H2SeO4= Au2(SeO4)3+3H2SeO3+3H2O
Концентрированная хлорная кислота HClO4 реагирует с золотом и при комнатной температуре, при этом образуя различные нестойкие оксиды хлора, а также жёлтый раствор растворимого в воде перхлората золота (III):
2Au+8HClO4=Cl2+2Au(ClO4)3+2O2+4H2O
Реакция обусловлена сильной окислительной способностью Cl2O7.
Золото не реагирует с кислородом ни при каких температурах и до 100 °С устойчиво к воздействию озона.
Au+O2 не реагирует
Au+O3 не реагирует
Золото сравнительно легко реагирует с кислородом и другими окислителями при участии комплексобразователей. Так, в водных растворах цианидов при доступе кислорода золото растворяется, образуя цианоаураты:
4Au+8CN+2H2O+O2=4[Au(CN2)]+4OH
Цианоаураты легко восстанавливаются до чистого золота:
2Na[Au(CN)2]+Zn=Na2[Zn(CN)4]+2Au
В случае реакции с хлором возможность комплексообразования также значительно облегчает ход реакции: если с сухим хлором золото реагирует при 200 °C с образованием хлорида золота(III), то в концентрированном водном растворе соляной и азотной кислот в пропорции 3:1 («царская водка») золото растворяется с образованием хлораурат-иона уже при комнатной температуре:
2Au+3Cl2+2Cl=2[AuCl4]
При комнатной температуре (20—30 °C) золото реагирует с жидким бромом и его растворами в воде и органических растворителях, диспропорционируя, образуя трибромид AuBr3:
2Au+2Br2=AuBr3+AuBr3+AuBr
С йодом реагирует при 120−393 °C:
2Au+I2=2AuI
Реагирует с галогенами при нагревании: 2Au + 3Cl2 = 2AuCl3;
не растворяется в щелочных и кислотных растворах;
растворяется в смесях кислот: HCl+HNO3 (царской водке) и H2SO4+HNO3: Au + 3HNO3 + 3HCl = AuCl3 + 3NO2 + 3H2O;
металлическое золото переходит в раствор в виде комплексной соли в водных растворах цианида калия и натрия в присутствии окислителей: 4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4KOH;
легко растворяется в ртути с образованием сплава (амальгамы).
Кислородные соединения золота при незначительном нагревании легко разлагаются со взрывом, например, гремучее золото взрывается при 145°C.
Соединения золота достаточно легко гидролизуются и восстанавливаются до свободного металла в водных растворах, поскольку являются неустойчивыми соединениями: при нагревании гидроксид золота (III) дегидратируется образуя оксид золота (III), который, в свою очередь, распадается с образованием свободного золота при 160°C: 4Au(OH)3 → 2Au2O3 → 4Au + 3O2.
Гидроксид и оксид золота (III) - амфотерные соединения, реагируют с кислотами и основаниями, образуя комплексные соединения:
Au(OH)3 + KOH = K[Au(OH)4]
Au(OH)3 + 4HCl = H[AuCl4] + 3H2O
Кроме того, золото растворяется в хлорной воде
С фтором золото реагирует в интервале температур 300—400 °C, при более низких реакция не идёт, а при более высоких фториды золота разлагаются.
Золото также растворяется в ртути, образуя легкоплавкий сплав (амальгаму), содержащий интерметаллиды золото-ртуть.
Известны золотоорганические соединения — например, этилдибромид золота или ауротиоглюкоза
Золото не взаимодействует с серой напрямую, но сульфид золота(III) можно получить пропусканием сероводорода через разбавленный раствор хлорида золота(III) или хлорно-золотой кислоты.
Физические свойства золота:
Золото — блестящий металл желтого цвета с высокой плотностью, тепло- и электропроводностью, низкой твердостью, хорошей пластичностью и ковкостью.
Плотность золота
Золото обладает высокой плотностью и относится к группе тяжелых металлов. Плотность химически очищенного золота 999 пробы 19,32 г/см³, а «самородного золота» колеблется в диапазоне от 18 до 18,5 г/см³. 585 проба, используемая в ювелирной промышленности, обладает относительно небольшой плотностью — от 12,85 до 14,76 г/см³, так как это сплав золота, палладия, серебра, никеля и меди.
Твердость золота
Золото — мягкий металл, по десятибальной шкале Мооса твердость золота находится в диапазоне от 2,5 до 3 баллов. Очищенное и «самородное» золото легко царапается, а при усилии режется острым ножом.
Тепло- и электропроводность золота
Золото относится к группе металлов с высоким коэффициентом теплопроводности — при температуре 0ºC 311 Вт/(м∙К). При нагревании его теплопроводность ухудшается. Удельное электрическое сопротивление золота 0,023 Ом∙мм²/м, что на 25% выше электрического сопротивления меди.
Температура плавления золота
Золото относится к среднеплавким металлам, температура плавления 999 пробы 1064ºC, точка кипения чистого золота — 2947ºC. Температура плавления 585 пробы 840ºC, благодаря этому ювелиры могут проводить его переплавку в домашних условиях.
Ковкость и пластичность золота
Высокая пластичность золота позволяет ему сохранять свои свойства при растяжении, прокатке, шлифовании, сжатии и скручивании. Золото вытягивается в проволоку с линейной плотностью 2 мг/м, а при ковке можно получить сусальное золото — листы толщиной 100 нм.
ДОБЫЧА РУДЫ:
Минералы золота и их технологические свойства
Золото в природе чаще всего встречается в виде самородного металла, интерметаллических соединений и минералов, содержащих золото, серебро, медь, железо, ртуть, висмут, платину, палладий, иридий, родий, и минералов — геллуридов золота. Кроме того, золото встречается в виде соединений с органическими кислотами.
Самородное золото никогда не бывает химически чистым и содержит до 50 % примесей. Присутствие посторонних примесей в золоте резко влияет на его качество и свойства. Например, мышьяк, свинец, платина, кадмий, висмут, теллур придают золоту хрупкость, что приводит к переизмельчению и ошламованию золота в процессах рудоподготовки. Кроме того, зерна самородного золота могут быть покрыты пленками («рубашками») оксидов железа и породных минералов, что существенно затрудняет извлечение золота при амальгамации и цианировании.
Самородное золото имеет высокую плотность — от 15,5 до 19,7 т/м3. Высокой плотностью обладают также минералы золота. В зависимости от крупности самородное золото классифицируют на крупное (более 2 мм), мелкое (0,05—2 мм), пылевидное (5—50 мкм) и тонкодисперсное (менее 5 мкм). Поведение зерен самородного золота и золотосодержащих минералов в процессах обогащения зависит от их состава и вкрапленности.
Крупновкрапленные золотосодержащие минералы, а также крупное и мелкое самородное золото хорошо извлекаются с помощью гравитационных процессов, но плохо флотируются и медленно цианируются. Пылевидное и частично мелкое золото плохо извлекается с помощью гравитационных процессов, но хорошо флотируется и хорошо цианируется, если не связано с теллуридами. Тонкодисперсное золото плохо извлекается не только гравитационными процессами, но и флотацией, если оно не связано с минералами-носителями. Такое золото вполне удовлетворительно извлекается только в результате гидромегаллургической обработки.
Золото, тесно связанное с сульфидами, хорошо извлекается с помощью процессов, рассчитанных на извлечение сульфидов (флотация, отсадка, концентрация на столах и т. д.). Выделение золота из сульфидных продуктов осуществляется обычно после разрушения самих сульфидов обжигом либо биохимическим способом.
Схемы и режимы переработки руд существенно зависят от минерального состава руд, их разрушаемости, наличия или отсутствия примесей, осложняющих извлечение золота, а также от размеров частиц золота. Эти и некоторые другие свойства руд в основном определяются их происхождением, по которому месторождения золотых руд подразделяют на две основные группы — коренные и россыпные. Из коренных месторождений добывают примерно 75 % золота, из россыпных — 25 %.
Типовой процесс переработки руды чётко подразделяется на 3 технологических передела :
А) Механическое обогащение руды (гравитация, флотация, радиометрическая или магнитная сепарация и т.д.), целью которого является получение обогащённых по содержанию ценного компонента продуктов - концентратов и отвальных хвостов, не требующих дополнительной переработки. Данная цель, как правило, достигается без применения процессов, нарушающих кристаллическую решётку минералов, в связи, с чем извлекаемые ценные компоненты присутствуют в концентратах в той же минеральной форме, что и в исходной руде.
Б) Металлургическая переработка рудных концентратов с использованием гидро- (выщелачивание ценных компонентов водными растворами кислот, щелочей, солей) и пирометаллургических (плавка) операций, результатом которых является получение черновых металлов.
В) Рафинирование черновых металлов (аффинаж) с целью очистки их от посторонних примесей и получения конечных товарных продуктов, удовлетворяющих условиям рынка.
Опыт мировой золотодобывающей промышленности свидетельствует о том, что плавка указанным материалов экономически оправдывается лишь в том случае, когда эти материалы содержат (причём в значительных количествах) медь, свинец, сурьму и другие металлы, способные выполнять при плавке роль «внутреннего» коллектора благородных металлов, и кроме того, сами представляют определённую промышленную ценность.
Отражением этой тенденции является существующая практика металлургической переработки медных и других концентратов, золото в которых присутствует в виде попутного ценного компонента и извлекается из концентратов в самостоятельную товарную продукцию на стадии рафинирования получаемых цветных металлов.
В принципе метод плавки может быть применён и для извлечения золота из некоторых категорий собственно золотых руд и концентратов, не содержащих другие цветные металлы. К их числу могут быть в первую очередь отнесены богатые гравитационные концентраты или огарки, для которых, наряду с классическими методами пирометаллургической обработки, представляет интерес вариант бесколлекторной плавки непосредственно на черновое золото или золото-серебряный сплав. В случае расположения золотоизвлекательного предприятия вблизи действующих пирометаллургических заводов достаточно эффективным представляется также использование золотых руд (концентратов) в качестве железосодержащих флюсов в медном производстве при условии, что эти руды (концентраты) по своему составу удовлетворяют техническим условиям на флюсы.
Особое место в мировой золото добывающей промышленности занимает процесс цианирования, основанный на способности металлического золота растворяться в слабых растворах щелочных цианидов по реакции:
2Au + 4NaCN + 1/2O2 + H2O = 2NaAu(CN)2 + 2NaOH
Относительная селективность растворителя (цианида), удачное сочетание процессов растворения и осаждения благородных металлов из цианистых растворов (цементация цинковой пылью, сорбция на ионообменных смолах и активированных углях и др.), простота аппаратурного оформления и другие преимущества цианирования делают его весьма эффективным и производительным, обеспечивая возможность применения данной технологии не только к концентратам механического обогащения, но и к рядовым золотым рудам и даже к хвостам обогащения, содержащим 1-2 г/т золота и ниже.
В настоящее время цианирование применяется при переработке 85 % золотых руд в мире .
К достоинствам цианистого процесса выщелачивания золота следует отнести его экологичность.
Анализ современного состояния техники и технологии цианирования золотых руд (концентратов), которым охвачена деятельность большинства действующих предприятий, показал, что мировая золотодобывающая промышленность располагает большим количеством вариантов технологических схем и применением цианистого процесса , которые в совокупности обеспечивают законченный цикл обработки руды на месте даже для технологически упорных руд, при достаточно высоком сквозном извлечении золота .
Классическая технология цианирования золотосодержащих руд (полный иловый процесс) включает в себя следующие технологические операции :
1) Измельчение руды до крупности, обеспечивающей необходимую полноту вскрытия золота;
2) Перемешивание измельчённой руды со щелочными цианистыми растворами в аппаратах-агитаторах механического, пневмомеханического и пневматического типа;
3) Отделение золотосодержащих растворов от твёрдой части пульпы (сбрасываемой в отвал) методами сгущения и фильтрации;
4)Осаждение золота из растворов цементацией на цинковой пыли;
e) Обработка золотосодержащих осадков (выщелачивание кислотами, обжиг, плавка) с получением чернового металлического золота, направляемого на рафинировочные заводы;
5) Химическая очистка сточных вод и хвостов гидрометаллургического процесса от токсичных цианистых соединений.
Необходимо ещё раз подчеркнуть, что все перечисленные выше операции сами по себе не обеспечивают получения товарной золотосодержащей продукции и выполняют, как правило, вспомогательную роль в схемах обработки руд, дополняя и интенсифицируя цианистую технологию извлечения металлов.
Заметное депрессирующее действие на золото при цианировании оказывают минералы и химические соединения меди, на растворение которых расходуется от 2,3 до 3,4 кг NaCN на 1 кг меди, присутствующей в исходной руде. При этом, большинство медьсодержащих минералов не проявляет при цианировании восстановительных свойств. Вместе с тем, установлено,
что увеличение концентрации Cu в растворах может вызвать образование на поверхности золотых частиц вторичных химических плёнок, тормозящих процесс последующего растворения золота. Предполагают, что состав этих плёнок представлен комплексными соединениями типа AuCu(CN)2 и простым цианидом меди CuCN.
Промывка
Метод промывки основан на высокой плотности золота, благодаря которой в потоке воды, минералы с плотностью меньше золота (а это почти все минералы земной коры) смываются и металл концентрируется в тяжёлой фракции, песка состоящего из минералов повышенной плотности, который называется шлихом. Этот процесс называется отмывкой шлиха или шлихованием. В небольших объёмах её можно проводить вручную, при помощи промывочного лотка. Этот способ используется с древнейших времён, и до сих пор для отработки маленьких россыпных месторождений старателями, но основное его применение — поиск месторождений золота, алмазов и других ценных металлов.
Промывка используется для разработки крупных россыпных месторождений, но при этом применяются специальные технические устройства: драги и промывочные устройства. Полученные шлихи, кроме золота, содержат множество других плотных минералов и металл из них извлекается, например, путём амальгамации.
Методом промывки разрабатываются все россыпные месторождения золота, ограничено он применяется на коренных месторождениях. Для этого породу дробят и затем подвергают промывке. Этот метод не может быть применён на месторождениях с рассеянным золотом, где оно так распылено в породе, что после дробления не обособляется в отдельные зёрна и смывается при промывке вместе с другими минералами. К сожалению, при промывке теряется не только мелкое золото, которое легко смывается с промывочной колоды, но и крупные самородки, гидравлическая крупность которых не позволяет им спокойно оседать в ячейках коврика. Поэтому на драгах и на промприборах обязательно следят за крупными катящимися обломками — это вполне могут оказаться самородки!
Этот метод добычи золота исторически был первым, и он очень дёшев, потому что не требует строительства дорогих заводов, и в случае речных отложений не нужно дробить породу. Экономически рентабельна отработка россыпей с содержанием золота более 0,1 г на 1 кубический метр рыхлой породы (песков, суглинков и т. д.).
Амальгамация
Метод амальгамации основан на способности ртути образовывать сплавы — амальгамы с различными металлами, в том числе и с золотом. В этом методе увлажнённая дроблёная порода смешивалась со ртутью и подвергалась дополнительному измельчению в мельницах — бегунных чашах. Амальгаму золота (и сопутствующих металлов) извлекали из получившегося шлама промывкой, после чего ртуть отгонялась из собранной амальгамы и использовалась повторно. Метод амальгамации известен с I века до н. э., наибольшие масштабы приобрёл в американских колониях Испании начиная с XVI века: это стало возможным благодаря наличию в Испании огромного ртутного месторождения — Альмаден. В более позднее время использовался метод внешней амальгамации, когда дроблёная золотоносная порода при промывке пропускалась через обогатительные шлюзы, выстланные медными листами, покрытыми тонким слоем ртути. Метод амальгамации применим только на месторождениях с высоким содержанием золота или уже при его обогащении. Сейчас он используется очень редко, главным образом старателями в Африке и Южной Америке.
Цианирование
Золото растворяется в растворах синильной кислоты и её солей, и это его свойство дало начало ряду методов извлечения путем цианирования руд.
Метод цианирования основан на реакции золота с цианидами в присутствии кислорода воздуха: измельчённая золотоносная порода обрабатывается разбавленным (0,3-0,03 %) раствором цианида натрия, золото из образующегося раствора цианоаурата натрия Na[Au(CN)2] осаждается либо цинковой пылью, либо на специальных ионнообменых смолах.
Метод цианирования первоначально применялся на крупных заводах, где порода дробилась и цианирование проводилось в специальных чанах. Однако развитие технологии привело к появлению метода кучного выщелачивания, который заключается в следующем: готовится водонепроницаемая площадка, на неё насыпается руда и её орошают растворами цианидов, которые, просачиваясь через толщу породы, растворяют золото. После этого они поступают в специальные сорбционные колонны, в которых золото осаждается, а регенерированный раствор вновь отправляется на кучу.
Метод цианирования ограничен минеральным составом руд, он неприменим, если руда содержит большое количество сульфидов или арсенидов, так как цианиды реагируют с этими минералами. Поэтому цианированием перерабатываются малосульфидные руды или руды из зоны окисления, в которой сульфиды и арсениды окислены атмосферным кислородом.
Для извлечения золота из сульфидных руд используются сложные многоэтапные технологии. Золото, добытое из месторождений, содержит различные примеси, поэтому его подвергают специальным процессам высокой очистки, которые производятся на аффинажных заводах.
Регенерация
Осуществляется действием 10 % раствора щелочи на растворы солей золота с последующим осаждением аффинажного золота на алюминий из горячего раствора гидрооксида.
Заключение:
Золото - металл красивого желтого цвета с сильным блеском, вязкий, мягкий, ковкий, тягучий (из одного грамма золота можно вытянуть проволоку длиной 3,5 км); химически очень стойкий - растворяется в “царской водке” (смеси соляной и азотной кислот), а также в ртути, растворах цианистых щелочей, хлорной и бромной воде. Редко в чистом виде, чаще в виде сплава с другими металлами золото применяется для изготовления всех без исключения ювелирных украшений и как материал декоративного покрытия при золочении недрагоценных металлов. В ювелирном деле (за счет введения в сплавы специальных легирующих добавок) широко используется золото белого, желтого, красного, зеленого, розового и даже черного и голубого цвета, причем такая многоцветность нередко присуща одному изделию. Ювелиры охотно применяют золото в сочетании с платиной, серебром, коррозионностойкой сталью, титаном, черным деревом
Список использованных источников информации:
https://zhazhdazolota.ru/interesnoe/gde-primenyayut-zoloto
https://prosto-o-slognom.ru/chimia/513_zoloto_Au.html
https://ru.wikipedia.org/wiki/Сплавы_золота
http://www.luksuria.ru/jeweller-wiki/zoloto_-_put_ot_rudy_do_slitkov/
http://himsnab-spb.ru/article/ps/au/
https://answr.pro/articles/1915-fizicheskie-i-khimicheskie-svojstva-zolota/
https://www.allmetals.ru/metals/gold/apply/
https://jewel-spb.ru/poludragocennye/dlya-chego-nuzhno-zoloto.html
|
|
|
 Скачать 335.71 Kb.
Скачать 335.71 Kb.




