Тема 2.21. Тема 21 Содержание и задачи аналитической химии
 Скачать 84.21 Kb. Скачать 84.21 Kb.
|
|
Тема 2.21 Содержание и задачи аналитической химии В решении крупнейших общечеловеческих проблем (проблема сырья, продовольствия, атомной энергетики, космонавтики, полупроводниковой и лазерной техники) ведущее место принадлежит аналитической химии. Основой экологического мониторинга является совокупность различных химических наук, каждая из которых нуждается в результатах химического анализа, поскольку химическое загрязнение – основной фактор неблагоприятного антропогенного воздействия на природу. Целью аналитической химии становится определение концентрации загрязняющих веществ в различных природных объектах. Ими являются природные и сточные воды различного состава, донные отложения, атмосферные осадки, воздух, почвы, биологические объекты и т.д. Широкое внедрение высокоэффективных мер контроля над состоянием окружающей природной среды, не ликвидируя болезнь в корне, очень важно для диагностики. Эффект в этом случае может быть получен намного быстрее и с наименьшими затратами. Система контроля дает возможность вовремя обнаружить вредные примеси и локализовать источник загрязнения. Вот почему роль аналитической химии в охране окружающей среды приобретает всебольшее значение. Аналитическая химия – это наука о способах идентификации химических соединений, о принципах и методах определения химического состава веществ и их структуры. Она является научной основой химического анализа. Химический анализ – это получение опытным путем данных о составе и свойствах объектов. Впервые это понятие научно обосновал Р. Бойль в книге «Химик-скептик» (1661 г.) и ввел термин «анализ». Аналитическая химия базируется на знаниях, полученных при изучении курсов неорганической, органической, физической химии, физики и математики. Цель изучения аналитической химии – освоение современных методов анализа веществ и их применение для решения народно-хозяйственных задач. Тщательный и постоянный контроль производства и объектов окружающей среды основан на достижениях аналитической химии. В. Оствальд писал: «Аналитическая химия, или искусство распознавать вещества или их составные части, занимает среди приложений научной химии особое место, так как вопросы, на которые она дает возможность ответить, возникают всегда при попытке воспроизвести химические процессы для научных или технических целей. Благодаря такому своему значению аналитическая химия с давних пор встречает постоянную заботу о себе…». Аналитическая химия – не просто дисциплина, накапливающая и систематизирующая знания; эта наука имеет огромное практическое значение в жизни общества, она создает средства для химического анализа и обеспечивает его осуществление – в этом ее главное предназначение. Без эффективного химического анализа невозможно функционирование ведущих отраслей народного хозяйства, систем охраны природы и здоровья населения, оборонного комплекса, невозможно развитие многих смежных областей знания.  Основные понятия и термины Аналитическая химия – наука, развивающая теоретические основы химического анализа и разрабатывающая методы определения химического состава веществ и химического строения соединений. Химический анализ – совокупность готовых приемов анализа, в результате применения которых устанавливается химический состав. Обнаружение - установление факта присутствия или отсутствия вещества или его компонента в образце. Определение – установление содержания (количества, концентрации) какого-либо компонента в изучаемом образце. Химические методы обнаружения – методы, основанные на использовании аналитических реакций; аналитический сигнал наблюдают главным образом визуально. Физические и физико – химические методы обнаружения – методы основанные на изучении физических свойств исследуемых веществ (оптические, электрохимические, магнитные и др.); аналитический сигнал получают и регистрируют с помощью специальной аппаратуры. Реагент специфический – реагент для обнаружения искомых ионов в присутствии других ионов. Применяется при проведении дробного метода анализа. Реагент избирательный (селективный) – реагент, который реагирует с ограниченным числом ионов. Используют как в дробном, так и в систематическом анализе. Реагент групповой – реагент на группу ионов с образованием одного и того же аналитического сигнала (чаще всего осадка). Используется в систематическом анализе. Дробный анализ – анализ, при котором искомые ионы можно обнаружить в отдельной порции исследуемого раствора, не прибегая к определенной схеме обнаружения ионов. Систематический анализ – определенная последовательность обнаружения ионов – после того, как мешающие обнаружению ионы удалены или замаскированы. Маскирование – подавление мешающего влияния посторонних ионов путем действия на них окислителей, восстановителей или комплексообразующих веществ. Микроанализ – количество исследуемого вещества составляет 1 г или 10 мл раствора. Полумикроанализ – количество исследуемого вещества составляет 0,1 – 0,01 г или 1,0 – 0,1 мл раствора. Ультрамикроанализ – количество исследуемого вещества < 10-4 г или 10 -3 – 10-6 мл раствора. Аналитический сигнал – среднее значение результатов измерения физической величины в заключительной стадии анализа, функционально связанное с содержанием определяемых компонентов. Градуировочная характеристика – зависимость аналитического сигнала от содержания определяемого компонента, устанавливаемая опытным или расчетным путем и выраженная в виде формул (градуировочная функция), таблиц, графиков. Градуировочный график может представлять зависимость между преобразованными величинами аналитического сигнала и определяемого содержания. Коэффициент чувствительности (S) – значение первой производной градуировочной функции при данном определяемом содержании. Для 5 градуировочных графиков, построеныых без преобразования аналитического сигнала и определяемого содержания, коэффициент чувствительности (S) равен угловому коэффициенту градуировочного графика: S = (dy/dc)ci. Диапозон определяемых концентраций – предусмотренная данной методикой область значений определяемых содержаний. Активность (a) – эффективная, кажущаяся концентрация вещества (иона), соответственно которой оно действует в химической реакции. Выражается в тех же единицах, что и концентрация раствора (моль/л). Коэффициент активности (f) – отношение активности к действительной концентрации иона (c): f = a/c. Ионная сила раствора (м) – полусумма произведений концентраций всех присутствующих в растворе ионов на квадрат заряда данного иона: м = 0,5·∑ z 2 c. Предел обнаружения (Cmin, p, мкг/мл) – минимальная концентрация или минимальное количество вещества, которое может быть обнаружено или идентифицировано данным методом с какой-то допустимой погрешностью ( р – доверительная вероятность). Предельное разбавление (Vпред., мл/г) – величина, обратная предельной концентрации, которая показывает, в какой массе растворителя содержится 1 г определяемого иона: Vпред. = 1:V·106/Cmin, p. Классификация методов анализа 1. По объектам анализа: неорганический и органический. 2. По цели: качественный и количественный анализ. Количественный анализ позволяет установить количественные соотношения составных частей данного соединения или смеси веществ. В отличие от качественного анализа количественный анализ дает возможность определить содержание отдельных компонентов анализируемого вещества или общее содержание определяемого вещества в исследуемом объекте. Методы качественного и количественного анализа, позволяющие определить в анализируемом веществе содержание отдельных элементов, называют элементным анализом; функциональных групп – функциональным анализом; индивидуальных химических соединений, характеризующихся определенной молекулярной массой, – молекулярным анализом. Совокупность разнообразных химических, физических и физико-химических методов разделения и определения отдельных структурных (фазовых) составляющих гетерогенных систем, различающихся по свойствам и физическому строению и ограниченных друг от друга поверхностями раздела, называют фазовым анализом. 3.По способу выполнения: химические, физические и физико-химические (инструментальные) методы. 4. По массе пробы: макро– (>> 0,10 г), полумикро– (0,10 – 0,01г), микро– (0.01 – 10−6 г), ультрамикроанализ (< 10−6 г ). Группы методов анализа. Принято делить методы анализа на три большие группы:
К химическим методам относят:
К физико–химическим методам относят все способы инструментального анализа:
К физическим относятся:
Аналитические реакции Способы выполнения аналитических реакций В основе аналитических методов – получение и измерение аналитического сигнала, т.е. любое проявление химических и физических свойств вещества в результате протекания химической реакции. Аналитические реакции можно проводить «сухим» и «мокрым» путем. Примеры реакций, проводимых «сухим» путем: реакции окрашивания пламени ( Na + – желтый; Sr 2+ – красный; Ba 2+ – зеленый; K+ – фиолетовый; Tl3+ – зеленый, In+ – синий и др.); при сплавлении Na 2B4O7 и Co2+ , Na 2B4O7 и Ni2+ , Na 2B4O7 и Cr3+ образуются «перлы» буры различной окраски. Чаще всего аналитические реакции проводят в растворах. Анализируемый объект (индивидуальное вещество или смесь веществ) может находиться в любом агрегатном состоянии (твердом, жидком, газообразном). Объект для анализа называется образцом, или пробой. Один и тот же элемент в образце может находиться в различных химических формах. Например: S0 , S2− , 2-324SO − , SO и т.д. В зависимости от цели и задачи анализа после переведения в раствор пробы проводят элементный анализ (определение общего содержания серы) или фазовый анализ (определение содержания серы в каждой фазе или в ее отдельных химических формах). Выполняя ту или иную аналитическую реакцию необходимо строго соблюдать определенные условия ее протекания (температура, рН раствора, концентрация) с тем, чтобы она протекала быстро и имела достаточно низкий предел обнаружения. Классификация аналитических реакций 1. Групповые реакции: один и тот же реактив реагирует с группой ионов, давая одинаковый сигнал. Так, для отделения группы ионов (Ag+ , Pb+2, Hg+2) используют реакцию их с Cl− – ионами, при этом образуются белые осадки ( AgCl, PbCl2 ,Hg2Cl2). 2. Избирательные (селективные) реакции. Пример: йодокрахмальная реакция. Впервые ее описал в 1815 г. немецкий химик Ф. Штромейер.Для этих целей используют органические реагенты. Пример: диметилглиоксим + Ni2+ →образование красного осадка диметилглиоксимата никеля. Изменяя условия протекания аналитической реакции, можно неизбирательные реакции сделать избирательными. Пример: если реакции Ag+Pb 2+Hg2+ с Cl − ионом, проводить при нагревании, то PbCl2 не осаждается, так как он хорошо растворим в горячей воде. 3. Реакции комплексообразования используются для целей маскирования мешающих ионов. Пример: для обнаружения Со2+ в присутствии Fe3+ – ионов с помощью KSCN , реакцию проводят в присутствии F− – ионов. При этом Fe3++ 4F− →[FeF4]−, K=10 −16 , поэтому Fe3+ – ионы закомплексованы и не мешают определению Co2+ – ионов. Реакции, используемые в аналитической химии 1 Гидролиз (по катиону, по аниону, по катиону и аниону) 2 Реакции окисления–восстановления 3 Реакции комплексообразования СuSO4 + 4NH4OH→[Cu(NH3)4]SO4 + 4H2O 4 Реакции осаждения Ba2+ +SO42- → BaSO4 ↓ Метрологические характеристики методов анализа Ошибки при количественном анализе. По своему характеру ошибки анализа подразделяются на систематические, случайные и промахи.
а) Методические – это ошибки, которые зависят от особенности применяемого метода (неполное протекание реакции, частичное растворение осадка, свойство индикатора). б) Оперативные – недостаточное промывание осадка на фильтре, ошибки приборные или реактивов, неравноплечность весов. в) Индивидуальные – ошибки лаборантов (способность точно определять окраску при титровании, психологические ошибки). г)Приборные или реактивные (эти ошибки связаны с недостаточной точностью используемых приборов, ошибки лаборанта).
Чувствительность, правильность и точность анализа. Чувствительность – минимальная определяемая концентрация вещества. Правильность – близость полученного результата к истинному. Точность - характеристика воспроизводимости определения от опыта к опыту. Анализ считается выполненным более точным, чем меньше различаются результаты параллельных определений между собой. 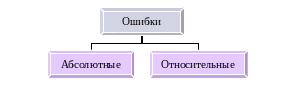 Абсолютная ошибка – разность между полученным результатом и истинным или наиболее достоверным значением. Относительная ошибка – отношение абсолютной ошибки к истинному значению.  1 Правильность – параметр, характеризующий близость экспериментальных и истинных значений измеряемой величины. Она характеризуется систематической погрешностью, которая зависит отработы прибора, индивидуальных особенностей аналитика, ошибок при расчете и методических погрешностей. 2 Воспроизводимость – параметр, отражающий случайные ошибки измерения и показывающий степень разброса повторных (параллельных) определений. Это мера того, как повторяются результаты при многократном проведении анализа. Воспроизводимость определяет вероятность того, что результаты последующих измерений окажутся в некотором заданном интервале, в центре которого находится среднее значение. Ее можно оценить с помощью любого доступного образца, тогда как для оценки правильности метода необходимо располагать стандартными образцами. Стандартные образцы – образцы веществ, состав которых типичен для определенного класса анализируемых материалов, определен с высокой точностью и не изменяется при хранении. Непременным условием применения стандартного образца в химическом анализе является максимальная близость состава и свойств стандартного образца и анализируемой пробы. Их применяют для градуировки и проверки аналитических приборов и методов. Особое значение они имеют при использовании физического метода анализа (пример: анализ сплавов чугуна и стали). В настоящее время готовят государственные стандартные образцы (образцы 1-го разряда) для металлов, сплавов, продуктов и полупродуктов химической промышленности. Для решения ряда проблем, в том числе и правильности анализа, применяют стандартные образцы 2-го разряда, так называемые вторичные стандартные образцы. Это вещества, состав которых тщательно определен после градуировки по эталонам или стандартам, имеющим государственную аттестацию. 3 Точность анализа определяется суммой правильности и воспроизводимости. 4 Предел обнаружения (ПО) – это минимальная концентрация вещества, которая может быть определена данным методом с какой-то допустимой погрешностью: (моль/дм3; мкг/см3; % ). 5 Чувствительность – параметр, характеризующий изменение аналитического сигнала, например, оптической плотности или напряжения, с изменением концентрации определяемого компонента, т.е. это тангенс угла наклона градуировочного графика. 6 Избирательность, селективность – возможность определения какого-то вещества (иона) в присутствии других. 7 Экспрессность. 8 Простота. 9 Экономичность. 10 Локальность. 11 Автоматизация. 12 Дистанционность. В производственных условиях, где анализы носят массовый характер, выбирают наиболее простые, быстрые методы, если они обеспечивают требуемую точность и достаточно низкий предел обнаружения. Выбор метода в каждом конкретном случае определяется целями и задачами исследования, а также производственными возможностями (наличие химических реактивов и приборов). Метрологическая организация аналитических лабораторий. В нашей стране государственная аналитическая служба представляет собой совокупность аналитических служб отдельных ведомств, например, в области промышленности, сельского хозяйства, ведомств природы, здравоохранения и т.д. Деятельность аналитических лабораторий, предприятий, называемых ЦЗЛ или просто заводскими лабораториями, имеет исключительное значение для государства в целом. Главная задача производственных лабораторий – каждодневное обслуживание производства: анализ сырья, полупродуктов и конечных продуктов. Для повышения эффективности их работы необходима разработка новых, более совершенных, методов анализа, обеспеченность реактивами и приборами. Многие прикладные лаборатории, располагающие квалифицированными кадрами и современным оборудованием, участвуют в работе. В крупных лабораториях специально организуются методические группы, основная цель которых – разработка, поиск, усовершенствование и приспособление к запросам предприятий методов и приемов анализа. Очень важно укреплять такую научную базу на предприятиях, делать заводские лаборатории центрами исследований. В наши дни некоторые методы анализа вообще невозможно представить без компьютера (хромато-масспектрометрия, жидкостная хроматография с многоканальным детектированием). Первоначально компьютеры рассматривали как «большие арифмометры». В соответствии с этим представлением их и использовали, прежде всего, для автоматизации научно-технических расчетов. Сейчас ситуация существенно изменилась. Математические задачи аналитической химии стали осмысливаться в общем контексте прикладной математики. Алгоритм и программы активно переносятся на химико-аналитическуюпроблематику. В настоящее время многие полагают, что в рамках аналитической химии оформилась самостоятельная дисциплина –аналитическая химия, основанная на использовании компьютеров. Предметом ее являются все аналитические задачи, которые нельзя решить без помощи компьютера. Внедрение в практику аналитических лабораторий инструментальных методов анализа привело к более широкому использованию ЭВМ, которые применяются в качестве основной части приборов и измерительных устройств, а также для решения многих теоретических и практических задач. Экспрессность анализа и улучшение контроля производственных процессов полностью зависит от автоматизации и механизации работ в заводских лабораториях. Следует автоматизировать как сам анализ, так и подготовку к нему (так называемые подсобные лабораторные работы – отбор проб, растворение, кипячение и т.д.). Автоматизация – создание кибернетических машин, выполняющих по определенной программе ряд операций (поступление пробы – анализ –результаты анализа) –требует капитальной перестройки анализа. Это не всегда возможно и удобно. Такая автоматизация оправдана в лабораториях, выполняющих ежедневно сотни однородных анализов. Оснащение химических лабораторий приборами основано на следующих принципах: –уменьшение утомляемости человека и возможности ошибок; –снижение расходов на оплату персонала; –увеличение экспрессности анализа; –уменьшение предела обнаружения и возможность определения сложных смесей; –возможность определения молекулярного и элементного состава. |
