НЕДЕЛЯ ХИМИИ. Тема методика организации внеклассной работы по химии общие вопросы организации внеклассной работы
 Скачать 0.87 Mb. Скачать 0.87 Mb.
|
|
Часть стенда должна быть отведена для показа результатов хода олимпиады: сообщаются набранные баллы, как в командном, так и в личном зачете, занимаемые места по сумме проведенных заданий. Задания для заочного тура подбираются с определенными трудностями. Фактический материал заданий может выходить за рамки школьной программы, так как ученик имеет возможность посмотреть необходимую дополнительную литературу или проконсультироваться у старших, знающих химию. Задания необходимо подавать в занимательной форме, с неожиданными вопросами. Например, под рисунком обычного стакана и коробки спичек стоит вопрос: Как практически доказать, что в состав древесины входит водород? Подобные задания, предложенные всем учащимся VIII - XI классов, надо чередовать с заданиями для определенного класса. Задания не должны включать много задач. Вполне достаточно одной - двух задач, чтобы ученик без спешки смог в отведенное время сделать задание олимпиады и выполнить очередное домашнее задание по другим предметам. Кроме расчетных и качественных задач, заданиями заочной олимпиады могут быть вопросы викторины занимательного характера, разгадывание ребуса и кроссворда на химическую тему. Учащимся предлагают написать реферат о каком-то химическом факте, реакции, веществе, научном открытии и т. д.; изготовить модель аппарата или явления; прибор; предложить разработать таблицу или другое наглядное пособие для демонстрации и объяснения определенного химического явления или теоретического вопроса; составить самим чайнворд, кроссворд, ребус, задачу. Например, учащимся можно предложить зашифровать в ребусе высказывание французского писателя, философа-просветителя Д. Дидро: «Какой только области механических искусств не нужны знания химии!» Работая над решением задач заочной олимпиады, учащиеся психологически подготавливают себя к систематической самостоятельной работе, так необходимой им в дальнейшей жизни. Эффективность самостоятельной работы учащихся по расширению и углублению знаний при выполнении заданий заочного тура проверяется проведением очного тура. Учащиеся, набравшие наибольшее количество баллов в заочном туре, приглашаются на очный тур, который целесообразнее провести в декабре. Наибольшую трудность со стороны учителя представляют подбор и составление задач для очного тура. Они должны быть необычными по содержанию, включать неожиданные вопросы, требовать более глубоких знаний теоретического и фактического материала. Одновременно они должны быть посильны для учащихся того класса, которому предлагаются, т. е. теоретический и фактический материал должен охватить основные разделы курса химии соответствующего класса, не выходя за рамки школьной программы. В предложенных 4 - 5 задачах не меньше половины должны быть качественными, ибо они позволяют проверить начитанность учеников, их логическое мышление, умение объяснить различные теоретические положения. В число предложенных задач необходимо включить утешительные, т. е, задачи, не вызывающие у школьников затруднений. Для выявления же истинных победителей предлагается в задании сложная задача, решить которую могут только талантливые ученики. Благодаря такому набору задач учитывается психология школьников и поддерживается их интерес к участию в олимпиаде. Большое внимание учеников и повышенный интерес привлекают задачи, тексты которых несут новые, неизвестные факты и сведения об изучаемых на уроках веществах, реакциях, теориях. Это могут быть сведения из истории химии, развития химических производств родного края, об использовании химической наукой методов исследования состава, строения и свойств веществ. При необходимости учитель может самостоятельно составить олимпиадные задачи или же произвести частичное преобразование задач из школьного задачника. Работы учащихся можно оценивать по-разному. Обычно оценка каждого задания проводится по балльной системе, когда полностью решенная задача оценивается в определенное число баллов, в зависимости от числа действий в решении задачи. Каждое логическое действие в решении ученика оценивается определенным числом баллов (обычно одно действие – один балл), которые впоследствии суммируются, составляя оценку всей задачи. Подведение результатов химической олимпиады необходимо провести торжественно в присутствии всех учащихся и учителей на общешкольной линейке или вечере, объявить по школьному радио. Гласность результатов проведенной олимпиады — одно из важнейших условий дальнейшего привлечения учащихся к участию в ней в последующие годы. Учащиеся, набравшие наибольшее количество баллов в заочном и очном туpax школьной олимпиады, получают право на участие в районной химической олимпиаде. Последующая же работа учителя химии состоит в более тщательной подготовке этих учащихся к следующему этапу химической олимпиады. Продуманная организация олимпиады в школе, методически обоснованный подбор задач, четко разработанная система оценок и своевременная обработка результатов, поощрение победителей способствуют пропаганде в школе химических знаний, привитию интереса и любви к химии, повышают успеваемость и качество знаний по предмету. Пример олимпиадных заданий (г. Саратов; 9 кл.) №1. Массовая доля водорода в некоторой кислоте составляет 3,06%. Рассчитайте массовую долю калия в калиевой соли этой же кислоты. О какой кислоте может идти речь? Где могут применяться эти вещества? Каковы их физические и химические свойства? /12 баллов/ №2.Сухая смесь порошков меди и малахита поместили в железный тигель без крышки, взвесили и прокалили. Когда тигель с содержимым остыл, его вновь поместили на весы: масса осталась без изменения. Вычислите массовые доли (в процентах) веществ в исходной смеси и в содержимом тигля после прокаливания. Какие реакции могут протекать, если к исходной смеси прилить немного концентрированной азотной кислоты? /12 баллов/ ПРАКТИЧЕСКАЯ РАБОТА В шести пронумерованных склянках находятся соли: KI, Na2SO4, KNO3, NH4Cl, Ba(NO3)2, Pb(NO3)2. Химическим путем без применения дополнительных реактивов (кроме воды) определите, какое вещество находится в каждой склянке. Опишите и объясните логику и последовательность ваших действий, наблюдаемые признаки, уравнения реакций. 8. Домашний эксперимент учащихся Представить себе химию без химических опытов невозможно. Поэтому изучить эту науку, понять ее законы и, конечно, полюбить ее можно только через эксперимент. Естественно, химические реакции лучше всего поводить в специально оборудованных химических кабинетах и лабораториях под руководством учителя, на уроках или на занятиях химического кружка и факультатива. К сожалению, не во всех школах работают химические кружки, не у всех учащихся, интересующихся химией, есть возможность посещать дополнительные занятия в школе. Поэтому только домашний химический эксперимент может восполнить тот пробел в обучении химии в современных условиях, когда программы перенасыщены теоретическим материалом, учителя отказываются от проведения практических работ, а лабораторные опыты вообще стали редкостью в школьной практике. Следует приветствовать и поддерживать тех авторов учебников и рабочих тетрадей, которые включают в тексты параграфов те или иные опыты и наблюдения, которые учащиеся должны выполнить вне урока, в домашних условиях. Трудно переоценить значение такого эксперимента на формирование интереса к химии и мотивации к изучению этого предмета. Домашний эксперимент имеет огромное значение в углублении и расширении знаний, совершенствовании специальных умений и навыков, в общем развитии учащихся. В связи с этим, учителю химии следует помочь школьникам в организации проведения домашнего химического эксперимента. При этом следует учесть несколько факторов. Во-первых, учитель должен побеседовать с родителями по всем вопросам организации домашнего эксперимента по химии, прежде всего по проблеме обустройства места для проведения опытов в домашних условиях. Во-вторых, учащиеся должны твердо знать и неукоснительно выполнять правила техники безопасности лабораторных работ. В-третьих, учителю химии необходимо методически и практически помочь школьнику в приобретении необходимого оборудования для проведения опытов, приготовлении растворов и получении некоторых веществ из пищевых продуктов, средств бытовой химии и т. д. В-четвертых, необходимо наметить программу проведения учебных опытов и план исследовательского эксперимента по определенной тематике. В-пятых, следует научить юных химиков проводить соответствующие наблюдения и оформлять результаты опытов в лабораторном журнале. Приведем варианты некоторых опытов для домашнего эксперимента школьников. Опыты с железом. 1. В две пробирки налейте по несколько капель раствора поваренной соли (5%), в одну добавьте несколько капель раствора щелочи. Подберите к пробиркам пробки. Зачистите до блеска железный гвоздь длиной 10-15 см и введите его через обе пробки так, чтобы часть гвоздя со шляпкой закрыть пробкой в одной пробирке, а острие гвоздя закрыть в другой пробирке. Часть гвоздя (середина) должна оставаться между сосудами и контактировать с окружающим воздухом. Пробирки с гвоздем поместите в положении лежа. Таким образом, вы проведете одновременно три варианта опыта коррозии железа: во-первых, - обычные условия; во-вторых, - влажная соленая атмосфера; в-третьих, - влажная щелочная атмосфера. Наблюдайте состояние поверхности трех участков гвоздя в течение нескольких дней и сделайте выводы. 2. В три пробирки налейте раствор поваренной соли, подкисленный уксусной кислотой. В первую пробирку добавьте таблетку уротропина (лекарственный препарат) и растворите ее; во вторую – добавьте несколько капель иодной настойки до появления желтой окраски. В каждую пробирку опустите зачищенный до блеска железный гвоздь, чтобы один конец его выступал из раствора. Проследите, как влияют добавки на коррозию железа в условиях опыта, и сделайте выводы. 3. Поместите несколько мелких гвоздей (кнопки, скрепки) в пробирку и добавьте 3-5 мл соляной кислоты (1:1). Что наблюдали? Запишите уравнение реакции. Добавьте в реагирующую смесь несколько кристалликов медного купороса. Что наблюдали? Дайте объяснение. 4. Налейте в пробирку 4-6 мл раствора медного купороса, добавьте в раствор порошок железа. Что наблюдали? Запишите уравнение реакции. После окончания реакции слейте раствор сульфата железа (II) в другую пробирку и сохраните для следующего опыта. Железный порошок, покрытый рыхлым слоем меди, промойте 2 раза чистой водой, высушите на листе бумаги и отделите порошок меди. 5. К раствору сульфата железа (II) (опыт 4) добавьте несколько капель раствора щелочи. Взболтайте полученную смесь. Что наблюдали? Запишите уравнения реакций. 6. Небольшую порцию осадка из опыта 5 нагрейте на жестяном совочке. Что наблюдали? Запишите уравнение реакции. Иод и его свойства. 1. Налейте в пробирку несколько капель иодной настойки и осторожно выпарите. Вставьте в пробирку стеклянную палочку и продолжайте осторожно нагрев. Обратите внимание на цвет паров в пробирке и на кристаллики, осаждающиеся на палочке. Опишите наблюдения. 2. Чем отличается возгонка иода от возгонки хлорида аммония? 3. Разбавьте 2-3 мл иодной настойки до 10-15 мл водой и разлейте полученный раствор в несколько пенициллиновых пузырьков или пробирок по 3 мл. К каждой порции раствора добавьте какой-либо металл в виде порошка или мелких опилок (приготовьте с помощью напильника), например, железо, алюминий, медь, олово и т. д. Опишите наблюдаемые изменения и запишите соответствующие уравнения реакций. 4. Металлическую пластинку очистите от загрязнения и покройте тонким слоем лака для ногтей (попросите у мамы). Штопальной иглой, процарапывая лак, сделайте на пластинке надпись или рисунок. Смочите пластинку раствором иода и оставьте на некоторое время. После реакции промойте пластинку в воде, высушите тряпочкой и снимите лак специальной жидкостью. На пластинке останется вытравленный рисунок. Опишите, что у вас получилось. Запишите уравнение реакции. 5. Налейте в пробирку до 1/3 объема воды и добавьте несколько капель иодной настойки. Прилейте к раствору половинный объем бензина или растворителя для масляных красок и хорошо взболтайте смесь. Что вы видите после разделения жидкостей на два слоя? Можно ли на основании данного опыта судить о различной растворимости иода в воде и в органическом растворителе? Опыты с глицерином. 1. Растворы глицерина в воде замерзают при низких температурах. Налейте в четыре пенициллиновые скляночки по 0,5 мл глицерина, в первую – добавьте столько же воды, во вторую – 1 мл воды, в третью – 1,5 мл воды, а в четвертую – 2 мл воды. Выставите растворы на холод или в морозильную камеру, отметьте температуру и установите, какие растворы при этом не замерзли. 2. Смочите конец железной проволоки или стеклянной палочки в глицерине и внесите в пламя. Глицерин загорается. Обратите внимание на характер пламени и дайте объяснение. Запишите уравнение реакции. 3. Налейте в пробирку 2 мл раствора гидроксида натрия, 2-3 капли раствора медного купороса, затем по каплям добавляйте глицерин до растворения осадка. Запишите уравнения проведенных реакций и ваши наблюдения. 4. Немного (1-2 мл) глицерина, купленного в аптеке, нагрейте (осторожно!) в ложке для удаления из него воды. После охлаждения прибавьте к глицерину щепотку перманганата калия. Через 1-2 мин глицерин вспыхивает и сгорает ярким пламенем. (Если в вашем распоряжении будет безводный глицерин, то предварительный нагрев излишен). Опишите ваши наблюдения. 9. Профессиональная ориентация школьников на профессии, связанные с химией Профориентация – важнейшая задача учителя химии (как и других учителей предметников). Плох тот учитель, у которого нет учеников и последователей. Чтобы ученик выбрал в будущем профессию химика, медика, технолога, лаборанта или учителя химии необходимо, прежде всего, возбудить у школьника интерес к химии. В первую очередь эта задача решается на уроках. На различных внеклассных мероприятиях интерес должен перерастать в заинтересованность; затем в стремление познать большее и научиться большему; далее у ученика появляется потребность в постоянной деятельности по совершенствованию своих знаний и умений по химии; наконец он (ученик) решает свой профессиональный выбор в пользу химии. Большую роль в профориентации могут сыграть экскурсии, специальные встречи с профессионалами, тематические вечера «Я бы в химики пошел». Немаловажно работать в этом направлении не только с учениками, но и с родителями. На всех этапах учитель должен помогать ученику в удовлетворении его образовательных запросов: Вопросы и задания для закрепления, уточнения, систематизации и обобщения темы 1. Найдите в учебно-методической литературе рекомендации и сценарии по проведению различных внеклассных мероприятий (месячник химии, декада химии, неделя химии, тематический химический вечер, общественный смотр знаний, выпуск стенгазеты, устный химический журнал, химический кружок, классный час, диспут, вечер вопросов и ответов, встреча с известными людьми, исследовательская работа учащихся, научно-практическая конференция, олимпиада школьников по химии и т. д.). Проанализируйте содержание литературного источника и составьте его краткий конспект, обратив особое внимание на методику организации внеклассных мероприятий. 2. Разработайте по заданию преподавателя оригинальный сценарий внеклассного мероприятия и обсудите его содержание и методику организации на практическом занятии. Приложения к лекции «Методика внеклассной работы по химии» Примеры загадок  Высказывание («расшифруйте эту гигантскую формулу»)  Пример занимательных химических опытов Медные монеты или изделия тщательно очищают от грязи, промывают раствором соды и опускают в разбавленный раствор нитрата серебра. После получения серебряного покрытия изделие промывают в воде и полируют суконной тряпочкой. ЗАТВЕРДЕВАНИЕ ЖИДКОСТИ В химический стакан наливают 20-50 мл силикатного клея (силикат натрия), добавляют 2-3 мл раствора соляной кислоты (1:1) и тут же перемешивают стеклянной палочкой. Через несколько секунд жидкость загустеет, и ее уже нельзя вылить из стакана. Палочка держится в загустевшей массе вертикально, не падая. «ВОДА» ЗАЖИГАЕТ КОСТЕР На асбестовую сетку ставится небольшая фарфоровая чашечка с небольшим количеством смеси перманганата калия с концентрированной серной кислотой. На фарфоровую чашечку и вокруг нее накладывают сухие лучинки, имитирующие костер. Для зажигания полученного костра, смачивают ватку «водой» (этиловым спиртом) и выжимают над ним так, чтобы капли попали в чашечку. Спирт воспламеняется, поджигая затем и лучинки. «САМОВОЗГОРАНИЕ» КОСТРА В сухую фарфоровую чашечку насыпают 3-5 г порошка перманганата калия, ставят на асбестовую сетку и обкладывают со всех сторон сухими лучинками. Непосредственно перед проведением опыта к перманганату калия добавляют 3-5 капель безводного глицерина и сетку с чашкой устанавливают на демонстрационном столике. Через 1-2 минуты глицерин воспламеняется, от него загораются лучинки. Пример оформления стенной газеты 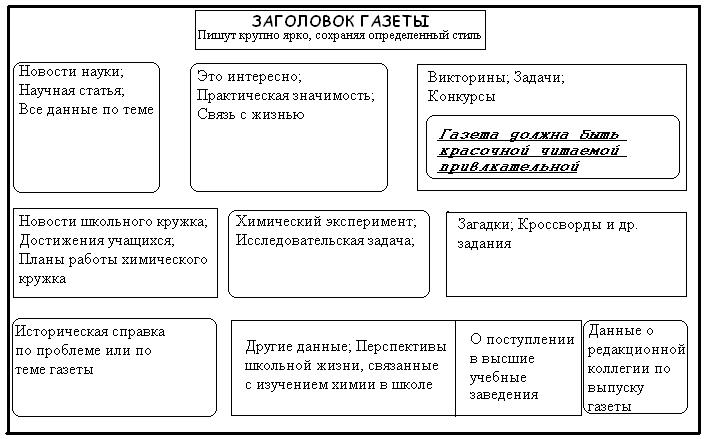 Игра «ХИМИЯ - ЭТО СТРАНА ЧУДЕС» Цель. Заинтересовать учащихся, повысить уровень их внимания к изучаемому материалу. Описание игры. Для этой игры потребуется тридцать небольших карточек из плотной бумаги. На одной стороне этих карточек пишутся химические символы и названия различных химических элементов или сложных веществ. Ведущий просит одного из учеников назвать любое число от 1 до 10. Предположим, что названо число 4. Ведущий убирает из стопки любые четыре карточки, оставшиеся отдает ученику и просит их пересчитать и определить в полученном числе сумму цифр. Далее ведущий предлагает ученику запомнить ту карточку снизу, номер которой равен этой сумме. Затем ведущий забирает все карточки и начинает откладывать их сверху по одной, произнося по буквам фразу: «Х-и-м-и-я - э-т-о с-т-р-а-н-а ч-у-д-е-с» так, чтобы на каждую произнесенную букву откладывалась одна карточка. Карточка, которая выпадает при произнесении последней буквы, переворачивается надписью вверх. Это и будет та карточка, которую запомнил ученик. Объяснение игры. Принцип игры состоит в том, что для любого числа от 20 до 29 разность между этим числом и суммой его цифр равна 18. Поэтому выбранная карта всегда будет в стопке девятнадцатой сверху, если их общее количество будет в пределах указанных чисел. Этот предел обеспечивается первой частью игры. Поскольку в фразе «химия - это страна чудес» содержится девятнадцать букв, а на каждую произнесенную букву убирается одна карточка, то последняя буква фразы и укажет на замеченную зрителем карточку, то есть на соответствующий химический элемент. Естественно, что наука химия в этой игре ни при чем. |
