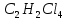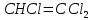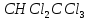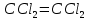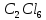контрольная. Орг химия. Тема Стехиометрия и материальные расчеты химических реакций
 Скачать 26.01 Kb. Скачать 26.01 Kb.
|
|
Задачи решена неверное, откуда вы взяли такие данные?? В условиях одно, в решении совсем другие значения! Тема 1. Стехиометрия и материальные расчеты химических реакций Вариант 2 В реакторе протекают реакции: 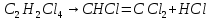 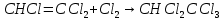 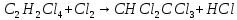 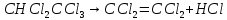 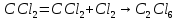 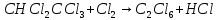 Записать уравнения суммарных независимых реакций образования ключевых продуктов; по суммарным реакциям рассчитать материальный баланс процесса, если в реактор подают 50 кмоль/ч тетрахлорэтана и 34 кмоль/ч хлора; степень конверсии тетрахлорэтана составляет 0,92, а выходы трихлорэтилена, тетрахлорэтилена и гексахлорэтана по тетрахлорэтану равны соответственно 0,28; 0,60 и 0,02. Рассчитать выход пентахлорэтана и селективности для получаемых продуктов по тетрахлорэтану. Решение: Введем обозначения и перепишем в буквенном виде систему химических уравнений: A B + Z (1) B + Y C (2) A + Y C+ Z (3) C D + Z (4) D + Y E (5) C + Y E + Z (6) Составим стехиометрическую матрицу:
Приведение этой матрицы к виду Гаусса дает:
Ранг матрицы равен r=4, то есть в этой системе имеется четыре независимые реакции. Стехиометрические коэффициенты соответствуют этим четырем суммарным реакциям: A B+Z (1) A+Y C+Z (2) A+YD+2Z (3) A+2Y E+2Z (4) 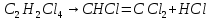 (1) (1)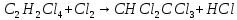 (2) (2)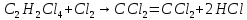 (3) (3)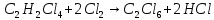 (4) (4)с четырьмя ключевыми веществами: B, C, D и Е. Для вычисления мольных потоков реагентов и продуктов реакции (Fi,0 и Fi) воспользуемся уравнением парциального молярного баланса сложных реакций: Fi/FA,0 = βi + Σ(ν'ij/|ν'Aj|)xi, где βi = Fi,0/FA,0 , ν'ij - стехиометрические коэффициенты суммарных реакций с участием i-го компонента в j-той реакции. Учитывая, что выход каждого продукта (xi) равен: xi= |ν'A/ν'i| Fi/FA,0 запишем выражения для отношения мольных потоков всех компонентов реакционной массы на выходе из реактора к начальному мольному потоку тетрахлорэтана (Fi/FA,0): FB/FA,0 = 0,28; FD/FA,0 = 0,60; FE/FA,0 = 0,02; FA/FA,0 = 1 - (0,28+ 0,60 + 0,02) = 0,1; FY/FA,0 = 0,34 - 0,28 - (2/|-1|)0,02 = 0,02; FZ/FA,0= 0,28 + 0,60 + (2/|-1|)0,02 = 0,92 Отсюда вычислим мольные потоки реагентов и продуктов реакции на выходе из реактора: FB = 14; FD = 30; FE = 2; FC = 0; FA= 10; FY = 2; FZ = 46 Для проверки составим таблицу материального баланса процесса:
Степень конверсии тетрахлорэтана и хлора равны: ХA = 0.92 ХY = 1 - FY/FY,0 = 1-2/34 = 0.941 Селективности по винилхлориду и дихлорэтилену равны: ФAD = |νA/νD| FD/(FA,0ХA) = 30/92 = 0.33 ФAE = |νA/νE| FE/(FA,0ХA) = 2/92 = 0.022 Тема 2. Определение констант равновесий газофазных реакций по термодинамическим данным Определить Кр газофазной реакции дегидрирования этанола в ацетальдегид при температуре Т(К), используя термодинамические данные: С2Н5ОН(г) ---> СН3СОН(г)+Н2(г) Т=470 К Решение: Если исходные реагенты находятся в стандартном состоянии (ai =1), второй член уравнения превращается в нуль и получается известная изотерма Вант-Гоффа для идеальных газов: 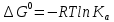 где ΔG0 – стандартное изменение энергии Гиббса при химической реакции. При равновесии ΔG (а не ΔG0) равна нулю, и знак ΔG определяет направление реакции, а именно, при ΔG<0 возможно самопроизвольное протекание реакции, ΔG>0 – невозможно. Стандартная энергия Гиббса связана с энтальпией и энтропией реакции известным уравнением: 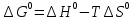 Константу равновесия для идеальных газов Ка находят из уравнения, иногда ее выражают как функцию температуры: 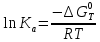 По справочнику находим
Из этих данных вычисляем: 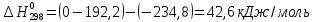 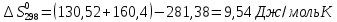 Отсюда при 470 К энергия Гиббса равна: 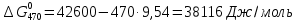 Теперь по уравнению рассчитываем при R = 8,31441 Дж/(моль·К). 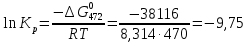 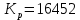 Тема 3. Применение кинетических моделей для выбора и оптимизации условий проведения химических процессов Определить объем проточного реактора идеального смешения, необходимый для достижения степени превращения исходного реагента ХА=0,67 при проведении реакции 2А --> R+S, если заданы СА0=1,6 кмоль/м3, k=11,3 м3/(кмольч) и объемный расход подачи реагентов в реактор v=1,7 м3/ч. Решение: Запишем алгоритм решения. Объем реактора определяем по уравнению: 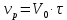 Условное время пребывания τ находим из базового уравнения для реактора смешения 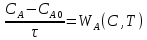 Кинетическое уравнение скорости превращения записываем согласно стехиометрическому уравнению 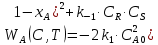 Концентрации продуктов R и S определяем согласно стехиометрии 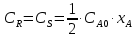 С учетом вышеизложенного выражаем τ из базового расчетного уравнения для РИС-н 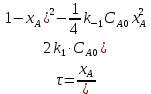 Подставляя найденные значения в уравнение для расчета τ, находим 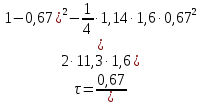 Рассчитываем объем реактора идеального смешения 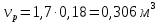 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||