Лаб.раб.1. Лабораторная работа изучение работы реактора идеального смешения периодического действия
 Скачать 167.5 Kb. Скачать 167.5 Kb.
|
|
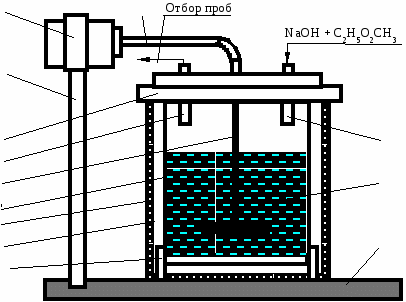
ВЛАДИМИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра химической технологии стекла и керамики по дисциплине “Общая химическая технология” ” Методическая разработка Составитель доктор технических наук, профессор кафедры ХТСК Христофорова И.А. Владимир - 2006 г. 1 ЛАБОРАТОРНАЯ РАБОТА № ИЗУЧЕНИЕ РАБОТЫ РЕАКТОРА ИДЕАЛЬНОГО СМЕШЕНИЯ ПЕРИОДИЧЕСКОГО ДЕЙСТВИЯ Цель работы: изучение работы реактора идеального смешения; исследование кинетики реакции и начального мольного соотношения реагентов на показатели процесса. ТеоретическАЯ ЧАСТЬ Реактор смешения периодического действия характеризуется единовременной загрузкой реагентов в аппарат и отсутствием потоков. Вследствие этого режим работы реактора является нестационарным: концентрации реагентов изменяются во времени, при этом во всех точках реактора концентрации постоянны в фиксированный момент времени вследствие интенсивного перемешивания. По достижении заданной степени превращения аппарат разгружается. Время проведения химической реакции, необходимое для достижения заданной степени превращения, определяется характеристическим уравнением:  где сА,0 – начальная концентрация реагента А; сА – текущая концентрация реагента А; wr,A – скорость химической реакции, являющаяся функцией концентрации (степени превращения); хA – степень превращения реагента А. Изучение работы данного реактора проводится на примере реакции омыления этилового эфира уксусной кислоты (этилацетата) раствором гидроксида натрия: СН3СООС2Н5 + NаОН = СН3СООNа + С2Н5ОН. Это необратимая реакция второго порядка. Кинетическое уравнение имеет вид: где сА,0 – текущая концентрация этилацетата; сВ,0 – текущая концентрация гидроксида натрия; k – константа скорости реакции. Текущие концентрации, а, следовательно, и скорость реакции, являются переменными величинами (изменяются во времени), их значения выражаются через значение степени превращения реагента следующим образом: сА = сА,0(1 – хА), сВ = сВ,0 – сА,0хА, wrА = kсА,0(1 – хА)(сВ,0 – сА,0хА). В случае, если начальное мольное соотношение равно 1, т.е. сА= сВ,0, хА = хВ, сА,0 = сВ = сА,0(1 – хА), то wrА = kсА,0(1 – хА)2. 2 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Задание 1. Изучить теоретические основы данной работы [1-3], ознакомиться с оборудованием и методикой проведения эксперимента. 2. Получить у преподавателя допуск к работе и задание на проведение лабораторной работы (массу навески, начальное мольное соотношение ингредиентов). 3. В соответствии с заданием провести эксперимент по изучению работы реактора идеального смешения. 4. Сделать необходимые расчеты и построить графики зависимости параметров реакционной смеси от времени. 5. Рассчитать теоретическое значение достигаемой степени превращения по тому или иному ингредиенту. 6. Составить отчет о работе и защитить его. 2.2. Приборы, оборудование материалы 0,1 М водный раствор этилацетата; 0,1 М водный раствор NаОН; 0,1 н. раствор НСl; 0,1% спиртовой раствор фенолфталеина; поддон со льдом; колбы для отбора проб на 250 мл (6 шт.); колбы для титрования на 250 мл (6 шт.); пипетка на 10 мл; бюретка с ценой деления 0,1 мл; секундомер. 2.3. Методика проведения эксперимента 1. Этилацетат и гидроксид натрия отмерить мерным цилиндром в заданном количестве. 2. Залить в реактор необходимое количество раствора этилацетата и включить мешалку реактора (рис. 1). 3. Быстро залить в реактор раствор NaOH в требуемом количестве. Включить секундомер. 4. Через 20 – 30 с после начала реакции отобрать в чистую сухую колбу около 10 мл реакционной смеси. Далее с интервалом в 20 − 30 с отобрать еще 5 проб. Для снижения скорости реакции после отбора пробы рекомендуется ставить колбы с пробами на поддон со льдом. 5. После окончания отбора проб выключить установку. 6. Каждую пробу довести дистиллированной водой до 100 мл и перенести пробу для титрования в количестве 10 мл. в колбы для титрования. 7. В каждую пробу добавить 2 капли индикатора и оттитровать непрореагировавшую щелочь 0,1 н. раствором соляной кислоты. Полученные данные занести в табл. 1. 3
Рис.1. Лабораторная установка реактора смешения периодического действия: 1 - гибкий вал; 2 - электродвигатель; 3 - вертикальная стойка; 4 - крышка реактора; 5 - патрубок отбора проб; 6 - мешалка; 7 - внутренний цилиндр реактора; 8 - внешний цилиндр реактора; 9 - воздушная прослойка; 10 - подставка; 11- основание;12 - реакционная смесь; 13 - патрубок ввода реагентов Таблица 1 Результаты проведенных опытов
8. По результатам титрования проб реакционной смеси рассчитать текущие концентрации NаОН в реакторе, соответствующие времени отбора проб: где VНСl – объем НСl, пошедший на титрование, мл; СНСl – концентрация НСl, используемой в качестве титранта, моль/л; Vр — объем пипетки, используемой для отбора проб, мл. Текущая концентрация этилацетата рассчитывается с учетом его начальной концентрации после смешения с NаОН и количества этилацетата, вступившего в химическую реакцию в соответствии со стехиометрическим уравнением (равно количеству прореагировавшей щелочи): сэ-а,т = сэ-а,0 – (сNaOH,0 – сNaOH,т), где сэ-а,т и сNаОН,т – текущие концентрации этилацетата и щелочи, моль/л; сэ-а,0 и сNaOH,0 – начальные концентрации этилацетата и щелочи после смешения реагентов, моль/л; сисх. э-а и сисх. NаОН – концентрации исходных реагентов, моль/л; Vэ-а и VNаОН – объемы исходных реагентов, взятые для реакции, мл. Рассчитав текущие концентрации щелочи и этилацетата, определите значения степеней превращения исходных веществ в соответствующие моменты времени: Данные расчетов занести в табл. 2. Таблица 2 Данные расчетов
9. Рассчитать производительность Р реактора (моль/мин) по количеству полученного уксуснокислого натрия: где cicl = х.р. + всп – время цикла, мин; х.р. – время проведения химической реакции, мин; всп – время вспомогательных операций (загрузки и выгрузки), принимается равным 0,5 мин; сNaОН,0 − начальная концентрация NaOH, моль/л; хNaOH − конечная степень превращения NaOH; V − объем реактора, л. 10. Исходя из значений х.р и начальных концентраций реагентов, рассчитать по характеристическому уравнению РИС – п теоретическое значение достигаемой степени превращения для опыта, в котором начальное мольное соотношение равно 1:1. Значение константы скорости реакции для соответствующей температуры взять из справочника физико-химических величин. Сравнить теоретическое значение степени превращения с полученным экспериментально. 11. По данным табл. 2 построить графики зависимости параметров реакционной смеси сА, сВ, хА, хВот времени. 12. Сравнивая данные, полученные в различных опытах, проведенных при различных начальных мольных соотношениях реагентов, сделать вывод о влиянии этих условий на достигаемую степень превращения реагентов. Требования техники безопасности
Отчет должен включать в себя следующее: Титульный лист. Цель работы. 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Задание 2.2. Приборы, оборудование, материалы. 2.3. Методика проведения эксперимента. 2.4. Экспериментальные данные. 2.5. Обработка экспериментальных данных. 3. ВЫВОД СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ 6 Контрольные вопросы 1. Чем характеризуется реактор идеального смешения периодического действия? 2. Расскажите о методике проведения эксперимента. 3. Запишите уравнение реакции взаимодействия веществ, применяемых в данной работе. 4. Напишите формулы для определения текущих концентраций этилацетата и гидроксида натрия. 5. Напишите формулы для определения текущих значений этилацетата и гидроксида натрия. 6. Каким образом ведут расчет производительности реактора? 7. Нарисуйте и опишите графики зависимостей текущих концентраций и степеней превращения ингредиентов от времени. СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ 1. Александрова Г.Г., Вольфкович С.И. и др. Практикум по химической технологии. М.: изд-во Моск. ун-та, 1968. 366 с. 2. Лабораторные работы по общей химической технологии: Метод. указания / Сост. Гришина Е.П. Владимир: ВлГУ, 1997. С. 3-7. 3. Практикум по общей химической технологии / Под ред. проф. Мухленова И.П. М.: Высш. шк., 1973.423 с. ВЛАДИМИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра химической технологии стекла и керамики ЛАБОРАТОРНАЯ РАБОТА № 2 по дисциплине “Общая химическая технология” “ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛУЧЕНИЯ ХЛОРА И КOH” Методическая разработка Составитель доктор технических наук, профессор кафедры ХТСК Христофорова И.А. Владимир - 2006 г. 1 Цель работы: знакомство с работой модельной установки для электролитического получения хлора и гидроксида калия и с методикой исследования этого процесса. 1. Теоретическая часть Электролиз раствора КCl − наиболее типичный пример электрохимического процесса в водном растворе. Это также наиболее простой и экономичный метод одновременного получения трех ценных продуктов − хлора, водорода и гидроксида калия из дешевого и широко распространенного сырья. Газообразные продукты электролиза раствора КCl − хлор и водород − при любом способе электролиза (с применением разделительной диафрагмы и без нее) отличаются высокой концентрацией и чистотой. Производимый в процессе гидроксид калия также получается высококонцентрированным и химически чистым. Водный раствор хлорида калия в результате диссоциации содержит ионы К+, Cl-, Н+ и ОН- : КCl К+ + Cl- и Н2О Н+ + ОН- . При электролизе такого раствора теоретически возможен разряд катионов К+ и Н+ на катоде, анионов Cl- и ОН- на аноде. Какие из этих ионов и в какой последовательности будут в действительности разряжаться на электродах, зависит от величины и соотношения потенциалов разряда ионов в растворе КCl: на катоде 2Н+ + 2е = Н2 (а) на аноде 2Сl- - 2е = Сl2. (б) Равновесный потенциал выделения кислорода в насыщенном растворе КCl 2 В результате первичного процесса (а) у катода остаются ионы ОН-, которые в равновесии с ионами К+ образуют гидроксид калия: ОН- + К+ КOH. Суммарный процесс электролиза может быть представлен схемой: 2КCl + 2H2O = Cl2 + H2 + 2КOH. В результате разряда ионов ОН- на аноде, хотя и в незначительной степени, выделяется кислород по уравнению: 2ОН- - 2е = Н2О + 1/2 О2 и при взаимодействии кислорода с углеродом анода идет вторичный процесс: С + О2 = СО2. Газообразный хлор, частично растворяясь в анолите и взаимодействуя с водой и щелочью, образует гипохлорит, хлорат и хлорид калия по уравнениям реакций: Cl2 + H2O HClO + HCl HClO + КOH = КClO + H2O HCl + КOH = КCl + H2O 2КClO КClO3 + 2КCl. Все эти побочные процессы снижают выход по току по основным продуктам, особенно окисление КClO до КClO3, на которое затрачивается наиболее значительная доля электрического тока. Для предотвращения возникновения вторичных процессов или их уменьшения необходимо, чтобы продукты электролиза не смешивались, поэтому применяют пористую диафрагму, которая разделяет катодное и анодное пространства. 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Задание 1. Изучить теоретические основы данной работы [1], ознакомиться с конструкцией установки и методикой проведения эксперимента. 2. Получить у преподавателя допуск к работе и задание на проведение лабораторной работы. 3. В соответствии с заданием провести эксперимент по получению электролитическим методом хлора и гидроксида калия. 4. Провести анализ католита. Рассчитать выход продукта по току. 5. Составить материальный баланс по иону калия. 6. Составить отчет о работе. 2.2. Приборы, оборудование, материалы Установка для электролитического получения хлора и гидроксида калия, вода дистиллированная, хлорид калия, раствор метилового оранжевого, 0,5 н. раствор серной кислоты, пероксид водорода, 1 стакан, мерный цилиндр, коническая колба на 200 мл, бюретка, секундомер, технические весы. 3 2.3. Методика проведения эксперимента 1. Приготовить раствор хлорида калия с концентрацией, заданной преподавателем. 2. Провести электролиз раствора хлорида кадия на установке, представленной на рис. 1, по следующей методике: раствор хлорида калия залить в емкость 6. Убедиться, что установка готова к работе. Установить с помощью трансформатора 10 напряжение (контроль вести за током по амперметру 11), заданное преподавателем. Электролиз вести в течение заданного времени. Постоянно следить за силой тока по амперметру! Затем установку отключить от электрической сети. Перелить анолит и католит в отдельные емкости и замерить их объем.  3. Провести анализ католита на содержание КOH по следующей методике. Берут пипеткой 20 мл раствора и переносят их в коническую колбу, емкостью 200 мл. Пробу разбавляют дистиллированной водой, прибавляют несколько капель раствора метилового оранжевого и титруют 0,5 н. раствором серной кислоты. Если метиловый оранжевый от действия гипохлорида калия обесцвечивается, то последний необходимо разрушить несколькими каплями раствора пероксида водорода. Содержание КOH в растворе (г/л) рассчитывается по формуле: СКOH = где а − количество миллилитров 0,5 н. раствора кислоты, пошедшего на титрование; 0,056 − количество граммов КOH в 1 мл нормального раствора. 4. Рассчитать катодный выход продукта по току по следующей методике. Выход по току определяется соотношением: 4 где m0 − практически полученное количество продукта, г; m − теоретическое количество продукта, которое могло бы выделиться в процессе электролиза, г. Если через раствор в процессе опыта протекал ток I в продолжении часов, то m = I . . ЭВ, где ЭВ − электрохимический эквивалент вещества (для КОН равен 2,089 г/А.ч). Полученное количество продукта m0 определяется по концентрации и количеству катодной жидкости: m0 = CКOH . VK, где CNaOH − концентрация КOH в католите, г/л; VK − объем раствора в катодном пространстве, л. Отсюда вычисляется катодный выход. 5. Составить материальный баланс. Для процесса получения щелочи и хлора удобнее всего составить материальный баланс по иону калия. При этом в баланс не вводится материал электродов, количества образующихся газов − хлора, кислорода и т.д. Баланс калия в процессе электролиза составляется по следующей форме: Таблица Материальный баланс по иону калия
5 Отчет должен включать в себя следующее: Титульный лист. Цель работы. 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Задание 2.2. Приборы, оборудование, материалы. 2.3. Методика проведения эксперимента. 2.4. Экспериментальные данные. 2.5. Обработка экспериментальных данных. 3. ВЫВОД СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ Контрольные вопросы 1. Что такое электролиз и для чего его применяют? 2. Расскажите о процессе электролиза хлорида калия. 3. Влияет ли концентрация исходного раствора на выход готовых продуктов и каким образом? 4. Каким образом влияют силовые характеристики тока на выход готового продукта? 5. Объясните конструкцию и принцип работы модельной установки электролиза. 6. Каким образом ведут расчет количества компонентов, образовавшихся в результате электролиза раствора. 7. Опишите принцип составления материального баланса. СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ 1. Копылев Б.А., Трабер Д.Г., Сычев М.М., Григор В.А. Руководство к практическим занятиям по общей химической технологии. Л: гос. научно-техн. изд-во хим. лит-ры, 1957. 316 с. 2. Александрова Г.Г., Вольфкович С.И. и др. Практикум по химической технологии. М.: изд-во Моск. ун-та, 1968. 366 с. 3. Практикум по общей химической технологии / Под ред. проф. Мухленова И.П. М.: Высш. шк., 1973.423 с. ВЛАДИМИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Кафедра химической технологии стекла и керамики ЛАБОРАТОРНАЯ РАБОТА № 3 по дисциплине “Общая химическая технология” “ПРИГОТОВЛЕНИЕ И ИСПЫТАНИЕ ПЛЕНКООБРАЗУЮЩИХ ВЕЩЕСТВ” Методическая разработка Составитель доктор технических наук, профессор кафедры ХТСК Христофорова И.А. Владимир - 2006 г. 1 Цель работы: получить полимерные пленки на основе перхлорвиниловой смолы, определить некоторые физические и химические свойства. 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ К пленкообразующим относятся вещества, которые способны при нанесении их на какую-либо поверхность высыхать с образованием твердой эластичной пленки. Они широко применяются для защиты металлических изделий от коррозии, для окраски различных предметов и сооружений с приданием им красивого внешнего вида, для специальной предохранительной окраски подземных и подводных сооружений, машин, судов, железнодорожного подвижного состава, автотранспорта и т.п. Пленки должны быть хорошо связаны с поверхностью материала, обладать высокой механической прочностью, эластичностью, газо- и водонепроницаемостью, нерастворимостью и неплавкостью. Образование пленки из первоначального раствора представляет собой процесс перехода линейных макромолекул в молекулы трехмерной (пространственной) структуры, который большей частью протекает в присутствии катализаторов. Пространственные полимеры образуются связыванием линейных длинных цепей, соединенных друг с другом химическими связями в виде поперечных мостиков из атомов или групп атомов. В полимерах подобного типа “сшивающие” цепи (мостики), как правило, короче во много раз основных цепей. Соединения с трехмерной структурой резко отличаются по своим свойствам от линейных и разветвленных полимеров и при большом количестве связывающих мостиков являются твердыми, неплавкими и нерастворимыми в различных растворителях, стойкими по отношению к внешним воздействиям (температура, световые лучи и т.п.). Исходные материалы-пленкообразователи, применяемые для получения лакокрасочных покрытий, обычно представляют собой высокополимерные соединения относительно низкой степени полимеризации и со сравнительно небольшим молекулярным весом. Это обуславливается необходимостью получения растворов (для удобства их нанесения на обрабатываемую поверхность) с небольшой вязкостью. Требуемые механические, антикоррозионные и другие свойства образующихся пленок достигаются в результате дальнейшей полимеризации исходных высокомолекулярных соединений, протекающей непосредственно на обработанной поверхности изделий. Таким образом, получение пленкообразователя в результате реакции полимеризации или поликонденсации в большинстве случаев (в отличие от получения пластмасс) представляет собой жидкостной гомогенный процесс, осуществляемый в обогреваемых реакторах смешения. В некоторых случаях, когда один из исходных реагентов находится в твердой фазе, процесс осложняется расплавлением или растворением его, проводимым в дополнительном аппарате или в основном реакторе. 2 Применение же пленкообразователей, заключающееся в образовании готового “продукта” - защитного покрытия, представляет собой сложный многофазный процесс, в результате которого жидкая фаза пленкообразователя превращается в гомогенную твердую фазу − при отсутствии дополнительных компонентов − или в твердую массу из нескольких фаз, если к пленкообразователю предварительно добавляют другие ингредиенты − краски, наполнители, пластификаторы и т.п. В качестве пленкообразователей могут быть использованы соединения, которые характеризуются высокой полимеризационной способностью при обычных условиях или при небольшом повышении температуры. К таким веществам принадлежат высыхающие масла (главным образом, растительные), эфиры целлюлозы, синтетические и натуральные каучуки, белки (клеи, желатина, казеин), искусственные и природные смолы, некоторые продукты переработки нефти, а также асфальты, пеки и каучук. Большое распространение в качестве пленкообразующих веществ получили лаки, т.е. растворы высокомолекулярных соединений, в том или ином растворителе (спирт, ацетон, бензол, ксилол, скипидар, дихлорэтан и др.). Растворитель после нанесения пленки должен легко и быстро испаряться. В зависимости от природы пленкообразователя, а также растворителя различают смоляные или спиртовые лаки, целлюлозные лаки и масляные лаки. Пленкообразующие вещества применяют иногда в чистом виде, но чаще в виде красок и эмалей. Масляными красками называются растертые на олифах суспензии различных минеральных или органических красителей. Лаковыми красками (эмалями) называются пигменты, растертые в лаках. Пригодность тех или иных пленкообразователей для применения в различиных условиях эксплуатации изделий устанавливают на основании их физических и химических свойств. Из физических свойств чаще всего определяют цвет, влажность, плотность, вязкость, растворимость, скорость высыхания и температуру размягчения. Из химических свойств наиболее важное значение имеют кислотное число, число омыления, эфирное число и др. Наибольшее значение с точки зрения широкого применения в химической промышленности имеют лаки бакелитовые (на основе фенолоформальдегидных смол), битумные (асфальтовые), перхлорвиниловые, глифталевые и пентафталевые. Эти виды лаков обладают особой высокой устойчивостью по отношению ко многим химическим реагентам. 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Задание 1. Изучить теоретические основы данной работы [3], ознакомиться с методикой проведения эксперимента. 2. Получить у преподавателя допуск к работе и задание на проведение лабораторной работы. 3 3. В соответствии с заданием провести эксперимент по получению пленкообразующего покрытия. 4. Определить скорость высыхания лака, его растворимость в различных растворителях. 5. Составить отчет о работе. 2.2. Приборы, оборудование, материалы Перхлорвиниловая смола, метиленхлорид (или другой растворитель), стакан емкостью 150-200 см3, стеклянная палочка, стеклянная пластина (2 шт), пробирки с пробками, набор растворителей, термошкаф, технические весы, секундомер, водяная баня. 2.3. Методика проведения эксперимента 1. Приготовить раствор (лак) перхлорвинила в метиленхлориде с концентрацией, заданной преподавателем, из расчета 10 г. Взвешенные ингредиенты помещают в стакан и тщательно перемешивают стеклянном палочкой до однородной массы (работы производить в вытяжном шкафу!). Далее незамедлительно провести испытания на определение скорости высыхания лака. 2. Методика определения скорости высыхания лака. Высыхание лака представляет собой сложный физико-химический процесс. Скорость высыхания лака зависит от следующих условий: атмосферных влияний, способа приготовления лака и т.п. Из атмосферных условий на скорость высыхания лаков влияют свет, температура и влажность воздуха. Для определения скорости высыхания лака применяют стеклянную пластинку. Пластинка должна быть хорошо вымытой и высушенной. На пластинку наливают небольшое количество лака, и раскачивая пластинку, распределяют его тонким ровным слоем по всей поверхности. После этого помещают ее в горизонтальное место (в вытяжном шкафу!). Второй образец приготавливают аналогичным образом и устанавливают в сушильный шкаф при температуре 40 − 60 ºС (по заданию преподавателя) для высыхания пленки при повышенной температуре. Отмечают время нанесения слоя и затем время полного высыхания пленки (по секундомеру). При полном высыхании пленка просыхает по всей толщине нанесенного слоя и при нажатии пальцем не получается отлипа. Для определения полного высыхания время от времени пробуют пальцем на отлип. 3. Для определения других растворителей для перхлорвиниловой смолы и получения лаков на ее основе, смола подвергается испытаниям на растворимость. Определение растворимости имеет большое значение для подбора растворителя при приготовлении лака, а также при использовании уже готового лакового покрытия в различных агрессивных средах. В качестве растворителей могут выступать различные органические вещества. 4 Растворимость смолы в том или ином растворителе определяют следующим образом: 0,5 г смолы помещают в пробирку, куда наливают 5 г растворителя (навески могут быть изменены преподавателем). Пробирку закрывают пробкой и сильно многократно взбалтывают в течение 5 − 7 мин. Если растворения смолы при этом не происходит, пробирку помещают в кипящую водяную баню и после нагревания вновь сильно взбалтывают. В отчете замечают температуру растворения смолы, а также растворимость или нерастворимость смолы в том или ином растворителе. Полученные данные сравнить со справочными. 4. Составить отчет о проделанной работе. Отчет должен включать в себя следующее: Титульный лист. Цель работы. 1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Задание 2.2. Приборы, оборудование, материалы. 2.3. Методика проведения эксперимента. 2.4. Экспериментальные данные. 2.5. Обработка экспериментальных данных. 3. ВЫВОД СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ Контрольные вопросы 1. Какие вещества относятся к пленкообразующим? 2. С какой целью применяют пленкообразователи? 3. Назовите исходные вещества, применяемые для пленкообразователей? 4. Опишите процесс образования пленки из раствора смолы. 5. Какие физические и химические свойства различают у пленкообразующих веществ и изделий из них? 6. Расскажите методику приготовления и получения пленкообразующий материалов. 7. Какие свойства определяют у пленкообразующих материалов? Расскажите методики их определения. СПИСОК ИСПОЛЬЗУЕМЫХ ИСТОЧНИКОВ 1. Копылев Б.А., Трабер Д.Г., Сычев М.М., Григор В.А. Руководство к практическим занятиям по общей химической технологии. Л: гос. научно-техн. изд-во хим. лит-ры, 1957. 316 с. 2. Александрова Г.Г., Вольфкович С.И. и др. Практикум по химической технологии. М.: изд-во Моск. ун-та, 1968. 366 с. 3. Практикум по общей химической технологии / Под ред. проф. Мухленова И.П. М.: Высш. шк., 1973.423 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||