Вариант 7. Тема строение атома
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
ТЕМА 5. РАСТВОРЫ. ДИСПЕРСНЫЕ СИСТЕМЫ 5.1. Найдите массу соли BaCl2, необходимую для приготовления раствора объемом V =0,3л с массовой долей 2. Плотность раствора ρ 1015 кг/м3 . Вычислите молярную концентрацию эквивалента, молярную концентрацию, моляльность и титр этого раствора. 1. Определяем молярную массу и молярную массу эквивалента BaCl2 М (BaCl2) = 208 г/моль, Э (BaCl2) = 208/2=104г/моль. 2. Находим массу BaCl2, необходимую для приготовления 0,3 л его раствора с массовой долей 2 %. Массовая доля ω показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Масса раствора равна произведению объема раствора (V) на его плотность (ρ) m = 0,3·10-3 м3 · 1015 кг/м3 = 0,304 кг. В 100 кг раствора содержится 2 кг BaCl2. В 0,304 кг раствора содержится х кг BaCl2, х=0,006 кг BaCl2 3. Находим молярную концентрацию раствора. Молярная концентрация раствора СМ показывает количество растворенного вещества, содержащегося в 1 л раствора. В 0,3 л раствора содержится 6,1 г BaCl2. В 1 л раствора содержится х г BaCl2, Х=20,33 г Молярная концентрация СBeCl2=20,33/208=0,1 моль/л 4. Находим молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальная концентрация) раствора показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора. cэк(BaCl2) = 20,33/104=0,2 моль/л 5. Находим моляльность раствора. Моляльность раствора cm (моль/кг) показывает количество растворенного вещества, находящееся в 1 кг растворителя. Масса воды равна 304 г – 20,33 г = 283,67 г. Количество BaCl2 равно 0,03 моль В 283,67 г Н2О растворено 0,03 моль BaCl2. В 1000 г Н2О растворено х моль BaCl2, Х=0,11 моль/кг. 6. Находим титр раствора. Титр раствора Т показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л раствора содержится 20,33 г BaCl2. Т = 20,33/1000= 0,02033 г/мл. 5.2. Напишите уравнение электролитической диссоциации раствора плавиковой кислоты HF и найдите концентрации ионов Н+ и кислотного остатка в моль/л в растворе нормальной концентрации с0,01 моль/л, если известна константа диссоциации Кдисс= 6,8·10-4 Решение: НF ←→ Н+ + F − . Сион = С · α · n, где С – молярная концентрация электролита; α –степень диссоциации; n – число ионов данного вида. Степень диссоциации приближенно находим из выражения упрощенного закона Оствальда α = (Kдисс/с)1/2=(6,8·10-4/0,01)1/2=0,26 cH+ = cF- = 0,01·0,26 = 2,6·10-3 моль/л. 5.3. Рассчитайте рН раствора соединения NaOH основания и концентрации ионов Н+ и ОН− в растворе, содержащем m 0,1г соединения в объеме V 250мл раствора (α = 1). Р е ш е н и е Находим молярную концентрацию раствора NaОН. Молярная масса NaОН равна 40 г. сNaOH= 0,1/40·0,25= 0,01 моль/л Концентрация ОН− - ионов равна сNaОН = 0,01 моль/л. рОН раствора рассчитываем по формуле рОН = - lg aOH- = − lg γOH- ⋅[OH- ], для расчета γOH- определяем ионную силу раствора I = 1/2 ∑сi ⋅ zi2 =1/2 (cNa+ ⋅ z2Na+ + c OH- ⋅ z2OH- ) =1/2(0,01·12 + 0,01·12) = 0,01. Из табл.П 6 находим γOH- = 0,90. Следовательно, рОН = lg(0,90·0,01) = 2,05. рН = рКв – рОН = 14 – 2,05 = 11,95. 5.4. Составьте ионное и молекулярное уравнения реакции гидролиза Соли (NH4)2S, выражение для константы гидролиза и оцените величину рН раствора. Соль сульфида аммония диссоциирует, образуя ионы (NH4)2S ←→ 2 NH4+ +S2− . Ионы NH4+ и ион S2− взаимодействуют с ионами воды, образуя малорастворимое соединение NH4OH и малодиссоциирующее соединение Н2S. Соли, образованные при взаимодействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью. (NH4)2S + H2O = NH4OH +H2S Kг=Кв/(Кд(NH4OH)Кд(H2S) рН раствора (NH4)2S зависит от соотношения Кд (NH4OH) и Кд (H2S). Из табл. П 4 следует Кд (NH4OH) > Кд (H2S), что, следовательно реакция среды щелочная. 5.5. Образуется ли осадок труднорастворимого соединения, если смешать равные объемы растворов двух солей AgNO3 и Na2S концентрацией с 0,0001 моль/л? ПР( Ag2S) 5,7·10-51 Р е ш е н и е При смешении равных объемов растворов объем стал в 2 раза больше, а концентрация каждого из растворенных веществ уменьшилась вдвое, то есть 0,5·10-4 моль/л; Концентрации ионов Ag+ , NO3− ,Na+ и S2− cоответственно равны cAg+ = 0,5·10-4 моль/л; cNO3- = 0,5·10-4 моль/л; cNa+ = ·10-4 моль/л; сS2- = 0,5·10-4 моль/л. ПР=(2aAg+)2aS2-=(2·0,5·10-4·)2 0,5·10-4=0,5·10-12 Ионная сила раствора равна I = 1/2 ( сAg+ ⋅ zAg+2 + cNO3-⋅ z 2NO3- + cNa+ z 2Na+ + cS2- ⋅ zS2-2 ) = 1/2 (0,5·10-4 ·1 + 0,5·10-4 ·1+·10-4 ·1+0,5·10-4 ·4)= 4·10-4 = 0,0004. Учитывая коэффициенты активности для Ag+ и S2− (табл.П 6), рассчитываем активности этих ионов в растворе а Ag+ =γAg+СAg+ = 0,975·0,5·10-4 =0,488 ·10-4 моль/л а NO3- =γNO3-СNO3- = 0,975·0,5·10-4 =0,488·10-4 моль/л а Na+ =γNa+СNa+ = 0,975·10-4 =0,975·10-4 моль/л а S2- =γS2-СS2- = 0,903·0,5·10-4 =0,452·10-4 моль/л ПР=(2aAg+)2aS2-=(2·0,488 ·10-4)20,452·10-4 =0,43·10-12<5,7·10-51 Значит осадок не образуется. ТЕМА 6. ОСНОВЫ ЭЛЕКТРОХИМИИ 6.1.7, 6.2.7, 6.3.7, 6.4.7, 6.5.7 6.1. Для данного окислительно-восстановительного процесса: а) составьте реакции окисления и восстановления; б) укажите окислитель и восстановитель; в) составьте сокращенное ионное и полное молекулярное уравнения ионно-электронным методом; г) покажите переход электронов; д) рассчитайте Е0298 и ∆G0298 е) ук;ажите возможное направление протекания процесса; ж) составьте гальванический элемент на основе данной реакции. FeCl3 + MnCl2 + KCl + H2O → FeCl2 + KMnO4 + HCl По приведенной схеме делаем вывод, что процесс протекает в кислой среде (присутствует HCl, рН< 7). Находим степени окисления всех элементов данной схемы: Fe3+Cl -3 + Mn2+Cl-2 + K+Cl- + H2O → Fe2+Cl2 + K+Mn7+O4 + HCl Составляем возможные уравнения реакций окисления и восстановления, находим значения их стандартных электродных потенциалов: 5 Fe3+ 1 Mn2+ + 4H2O  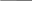 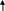 Составляем сокращенное ионное уравнение процесса и показываем переход электронов: 5Fe3+ + Mn2+ +4 H2O → 5Fe3+ + MnO4- + 8H+ 5e Составляем сокращенное ионное уравнение процесса и показываем переход электронов: 5Fe3+ + Mn2+ +4 H2O → 5Fe3+ + MnO4- + 8H+ 5eПереходим к полному молекулярному уравнению, показываем переход э    лектронов: 5Fe3+Cl 3 + Mn2+Cl2 + KCl + 4H2O → 5Fe2+Cl2 + KMn7+O4 + 8HCl лектронов: 5Fe3+Cl 3 + Mn2+Cl2 + KCl + 4H2O → 5Fe2+Cl2 + KMn7+O4 + 8HCl 5e Рассчитываем Е0298 и ∆G0298 данной реакции: Е 0298 = φ 0окислителя - φ 0 восстановителя = - 0,44 – ( -1,51) = -1,04 В. ∆G 0298 = - zF Е298 = - 2 · 96500 · -1,04 · 10-3 = - 200,72 кДж/моль . Переход электронов от восстановителя к окислителю можно осуществить как при сливании вместе растворов, так и через внешнюю цепь. В данном случае надо составить гальванический элемент с инертными, например, графитовыми электродами: (-) С |Fe3+|| Mn2+ ,H2O | C (+). При наличии внешней цепи начнется составленная выше окислительно-восстановительная реакция. Ее отличие от процесса в растворе: переход электронов от восстановителя к окислителю осуществляется через внешнюю цепь, а не непосредственно; окисление и восстановление протекают в разных сосудах, разделенных друг от друга диафрагмой. 6.2. Расчет электродвижущей силы гальванического элемента в стандартных условиях по известной реакции в элементе. Дана реакция, протекающая в гальваническом элементе. Рассчитайте Е0298 по данным ∆G0298, составьте схему элемента, реакции на электродах. O2 (г) + 2Sn (к) + 2H2O (ж) = 2Sn(OH)2 (к) Находим табличные значения ∆G0298 участников реакции: O2 (г) + 2Sn (к) + 2H2O (ж) = 2Sn(OH)2 (к) ∆G 298, кДж/моль 0 0 -237,2 -492,37 Рассчитываем ∆G298 для реакции в целом: ∆G298 = Σпрод-Σисх=-429,37-2(-237,2)=45,03 кДж/моль. Полученное значение ∆G298> 0 указывает, что реакция не может протекать самопроизвольно в прямом направлении. Величину Е0298 рассчитаем по формуле Томсона Е0298=-∆G0298/zF=-45,03·103/2·96500=-0,23 Составляем возможные уравнения реакций окисления и восстановления, находим значения их стандартных электродных потенциалов: 2 H2O +O2 1 Sn + 2OH- Cхема элемента имеет следующий вид (-) Sn(к) | Sn(OH)2(к) ||, H2O(p) | O2 (+) 6.3. Составьте схему гальванического элемента, образованного двумя данными металлами, погруженными в растворы солей с известной активностью ионов; рассчитайте ЭДС этого элемента и ∆G0 298 Cd, In CdBr2, In(NO3)3 a(Cd2+ )=0,02 M; a(In3+) =0,01 M Р е ш е н и е Равновесие для первого электрода Cd | CdBr2 (0,02 M). Токообразующая реакция Cd0 = Cd2+ + 2е. φCd2+ /Cd0 = φ0Cd2+ /Cd0 + 0,059/2 lg aCd2+ = -0,403 + 0,059/2 lg0,02 = -0,453 B. Аналогично, для второго электрода In | In(NO3)3 (0,01 M). Токообразующая реакция In = In3+ + 3е. φ In3+ /In0 = φ0In3+ /In0 + 0,059/3 lg aIn3+ = -0,126 + 0,059/3 lg 0,01 = -0,165 B. При составлении гальванического элемента более отрицательным электродом будет система Cd | Cd2+, более положительным – In | In3+. Схема гальванического элемента примет следующий вид (-) Cd | CdBr2 (0,02 M) || In(NO3)2 (0,01 M) | In (+). При наличии внешней цепи на электродах протекают следующие реакции Cd0 = Cd2+ + 2е окисление восстановитель Анод I   n- 3е = In3+ восстановление окислитель Катод Реакция в элементе в целом Cd0 + In3+ = Cd2+ + In0. n- 3е = In3+ восстановление окислитель Катод Реакция в элементе в целом Cd0 + In3+ = Cd2+ + In0.  3 е 3 е Электродвижущая сила этого элемента E298 = φ Cd2+ /Cd0 - φ In3+ / In0 = = -0,165-(-0,453)= 0,288B. 6.4. При электролизе раствора данной соли металла MnCl2током I, 1,12 А, масса 0,94катода возросла на m г. Учитывая, что выход металла по току Bi, 39%, рассчитайте, какое количество электричества и в течение какого времени пропущено. Составьте схему электролиза. Р е ш е н и е Составляем схему электролиза с нерастворимым анодом. Электрохимическая система имеет следующий вид (- ) Fe | MnCl2, H2O | Ti (+). В качестве покрываемого металла выбрано железо; нерастворимого анода – титан. В растворе присутствуют следующие ионы и молекулы MnCl2 ←→ Mn2+ + Cl− (электролитическая диссоциация); MnCl2 + 2H2O = Mn(OH)2 + HCl (гидролиз); Mn2+ + 2Н2О = Mn(ОН)2↓ + 2Н+, рН < 7, среда кислая. Следовательно, при составлении схемы электролиза надо учитывать ионы Mn2+, Cl− , Н+, молекулы MnCl2, H2O, Mn(OH)2. Реакции на электродах А: 2Н2О = О2 + 4Н+ + 4е ; К: Mn2+ + 2е = Mn0 2Н+ + 2е = Н2. Из-за выделения водорода на катоде совместно с восстановлением ионов Mn(II) выход по току металла меньше 100 %. Схема электролиза водного раствора MnCl2 с нерастворимым анодом: (–) Катод (+) Анод (нерастворимый) ← Mn2+ → H2O ← H+ → Cl Mn2+ + 2 2H+ + 2 Далее составляем схему электролиза с растворимым анодом. Электрохимическая система: (-) Fe |MnCl2, H2O | Mn (+). Реакции на электродах: А: 2Mn0 = 2Mn2+ + 4е. К: Mn2+ + 2е = Mn0, 2Н+ + 2е = Н2. Схема электролиза водного раствора MnCl2 c растворимым анодом: (–) Катод (+) Анод ← Mn2+ → H2O ← H+ → Cl → Fe0 Mn2+ + 2 2H+ + 2 Количество электричества по закону Фарадея составит Q=It=mzF/ABi=0,94·2·96500/55·0,39=8457,809 Кл Оно пропущено в течении времени t=Q/I=8457,809/1,12·3600=2,1 ч 6.5. Установите, в какой последовательности вероятно восстановление на катоде при электролизе данных ионов, пользуясь значениями стандартных электродных потенциалов и перенапряжений. Объясните, когда возможно совместное восстановление металла и водорода на катоде. Чем отличается последовательность электрохимических реакций на аноде от аналогичной последовательности на катоде? Cu2+,H+,Au3+,Re3+,Pb2+ Решение: Находим значения стандартных электродных потенциалов соответствующих электрохимических систем и перенапряжений Рассчитываем значения катодных потенциалов в реальных условиях электролиза, под током ϕik = ϕk0 − ηk .
Последовательность разряда ионов на катоде устанавливаем исходя из того, что на катоде восстанавливаются в первую очередь ионы с наиболее положительным электродным потенциалом соответствующей электрохимической системы.
Отсюда видно, что на катоде будут восстанавливаться в первую очередь ионы Au3+. При повышенных плотностях тока, в случае, если достигается предельный ток по ионам Au3+, может начаться восстановление ионов Cu2+, что используют, в частности, при электролитическом рафинировании металлов, далее восстанавливается свинец. Восстановления водорода в обычных условиях совместно с металлом –золотом не происходит, оно возможно лишь при плотностях тока, намного превышающих предельную по ионам Au3+. Анодное поведение рассматриваемых ионов прямо противоположно катодному: на аноде в первую очередь будут идти процессы окисления в электрохимических системах с наиболее отрицательным электродным потенциалом. |
