Вариант 7. Тема строение атома
 Скачать 0.61 Mb. Скачать 0.61 Mb.
|
|
ТЕМА 3-4. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ 3.1.7., 3.2.7, 3.6.7, 3.32 3.1. Вычислите, сколько тепла выделится при сгорании 100 литров (н.у.) углеводорода. Реакция горения протекает по уравнению : C4H8(г) + 6O2(г) = 4CO2(г) + 4H2O(ж) + 2718,51 кДж Р е ш е н и е В данном термодинамическом уравнении дано значение стандартной энтальпии сгорания ∆Н0сгор , то есть тепловой эффект реакции окисления 1 моля (22,4 л) газообразного бутена (С4Н8). 100 л газа в нормальных условиях (н.у.) соответствуют 22,4/100 молям газа, следовательно, при сгорании 100 л газа выделится (2718,51·22,4/100)=⋅608,9 кДж тепла (зависимостью ∆Н от температуры пренебречь). 3.2.Рассчитайте изменение внутренней энергии (кДж) в химической реакции. Т а б л и ц а 3.5
где n – число молей газообразных веществ. По закону Гесса определяем энтальпию химической реакции R = 8,31·10-3 Дж/моль·К; Т = 298 К; ΔU = 254,26 – 8,31·298·10-3 = 251,78 кДж. 3.6. Вычислите ∆Н0298 (кДж/моль), ∆S0298 (Дж/моль·К), ∆G0298 (кДж/моль) для нижеуказанных реакций. Возможна ли реакция при Р = 1атм и Т = 298 К? Определите температуру равновесия реакции и константы равновесия при 298 и 1000 К. О чем свидетельствуют значения Травн и Кравн ? 4HCl (г) + O2 (г) = 2Cl2 (г) + 2H2O (г) ΔH = 2·0+2·(-241,84)− (4(-92,30) + 0) = -114,48 кДж. ΔS По второму закону термодинамики: ΔG ΔG Рассчитаем температуру начала реакции, т.е. Травн. Для этого исходим из условия термодинамического равновесия: ΔG 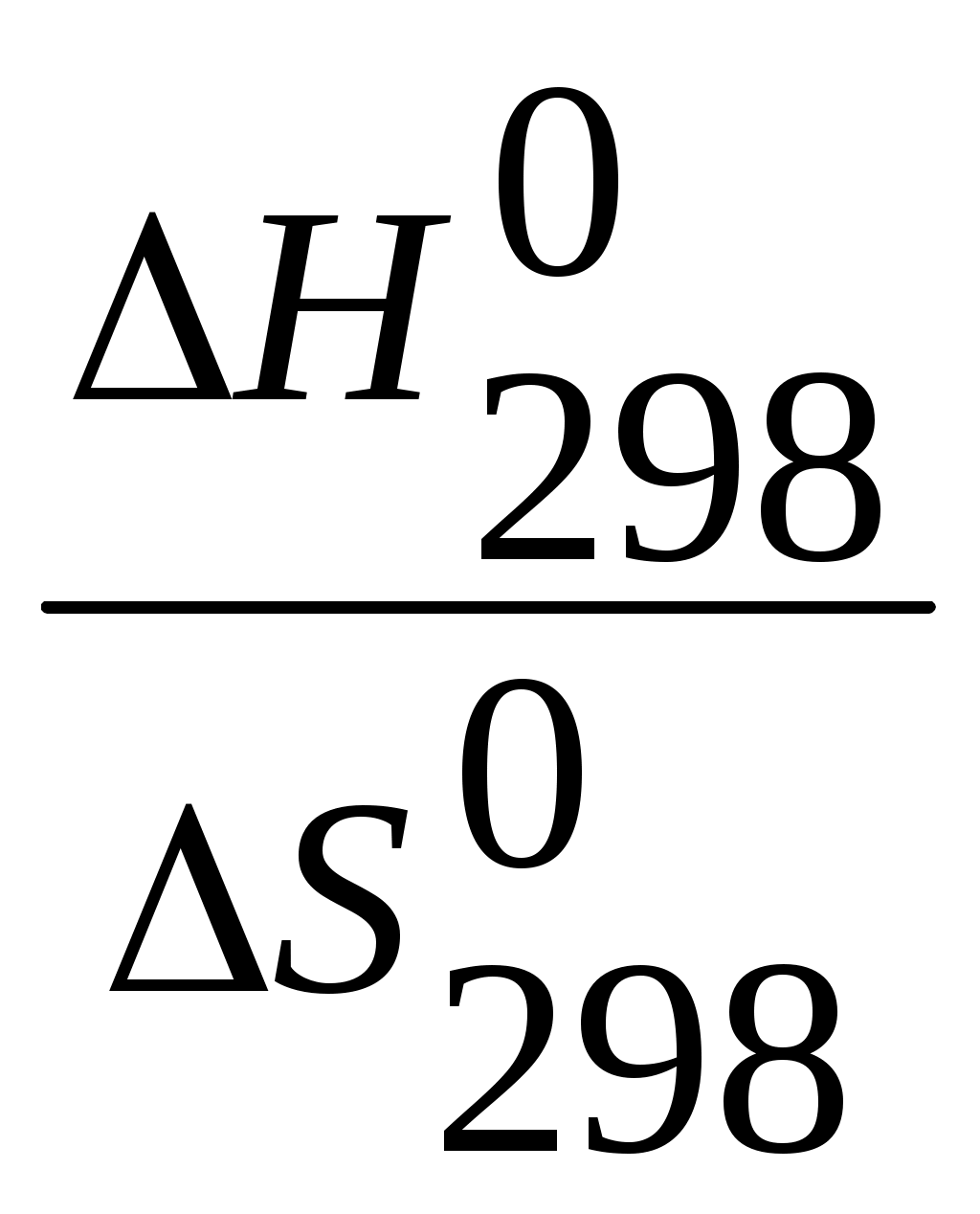 = = Большое значение свидетельствует, что при стандартных условиях идет практически только прямая реакция. K равн при 1000 К определяем по формуле: Следовательно при T=1000 К реакция идет с большей скоростью в обратном направлении. Ответ: ∆Н0298 = -114,48 кДж; ∆S0298 =- 0,152 Дж/К; ∆G0298 = -152,62 кДж; Травн = 753,15 К; K 298 равн = 1027; K1000равн = 1,04. 3.32. Какое количество продуктов необходимо употребить в день при определенном массовом соотношении, чтобы удовлетворить суточную энергетическую потребность организма? (Для расчетов пользуйтесь таблицей калорийности пищевых продуктов, значения которой приведены в ккал/100 г). Суточная норма в ккал студентов: мужчины – 3300 ккал/сут, женщины – 2800 ккал/сут. Т а б л и ц а 3.8
Р е ш е н и е По таблице калорийности пищи (табл. П.2) находим калорийность указанных продуктов: овсяная каша – 356 ккал/100 г , щука -72 ккал/100 г, маслята – 23 ккал/100 г, масло сливочное -734 ккал/100 г: булочка 250 ккал/100 г. Так как массовое соотношение продуктов 4:2:2:1:3, то за единицу употребления пищи принимаем следующие значения: 400 г овсяная каша: 200 г щука: 200 г маслята:100 г масло сливочное:300 г булочка. При употреблении такого количества пищи вы будете получать следующее количество энергии (Q) (ккал): Q = 4·356+2·72+2·23+1·734+3·250= 3098 ккал. Если вы юноша, то в среднем потребляйте Qср. = 3300 ккал/сут, если девушка, то Qср. = 2800 ккал/сут. Найдем коэффициент умножения продуктов (n) n = Qср./Q. Для юноши, тогда n = 3300/3098 = 1,09 раза, значит вам необходимо умножить единицу потребления пищевых продуктов на величину 1,09, т. е. макаронных изделий необходимо употребить 436 г овсяная каша: 218 г щука: 218 г маслята:109 г масло сливочное 327 г булочка. Это то количество продуктов, которое вы должны употребить для удовлетворения суточной энергетической потребности организма, при определенном массовом соотношении данных продуктов. 3.10. Укажите, какие из фазовых переходов будут экзотермическими, какие – эндотермическими: 1) Hg(тв)= Hg(ж); 2) Na(тв)= Na(ж); 3) I2(г) = I2(тв); 4) C(графит) = C(алмаз); 5) Br2(г) = Br2(ж); 6) S(ромб) = S(г). При фазовых превращениях «твёрдое вещество» → «жидкость» → «газ» теп- лота поглощается, т. е. это процессы эндотермические Q < 0, ΔH > 0 потому, что каждое последующее состояние по сравнению с предыдущим характеризуется увеличением подвижности частиц, образующих вещество. Такая возрастающая подвижность частиц связана с частичным разрывом связей в структуре вещества, что требует затраты энергии. Это реакции 1,2,4,6 Обратный переход сопровождается выделением те- плоты – процессы экзотермические Q > 0, ΔH < 0. Переход вещества из аморфного состояния в кристаллическое сопровождается выделением тепла (Q > 0, ΔH < 0), что связано с упрочнением связи. Если кристаллическое вещество превращается в аморфное, то теплота поглощается (Q < 0, ΔH > 0), эта теплота идёт на разрушение кристаллической решётки. Реакции 3,5 Химическая кинетика 4.1. Постройте кинетическую кривую расходования вещества А и определите графически начальную скорость (V0), порядок (n) и константу скорости (k) для реакции вашего варианта (табл. 4.5, 4.6). Т а б л и ц а 4.5
Р е ш е н и е 1) Строим кинетическую кривую расходования вещества А в координатах «концентрация – время» (рис. 4.1), проводим касательную к начальному участку кривой и определяем начальную скорость реакции с, моль/л 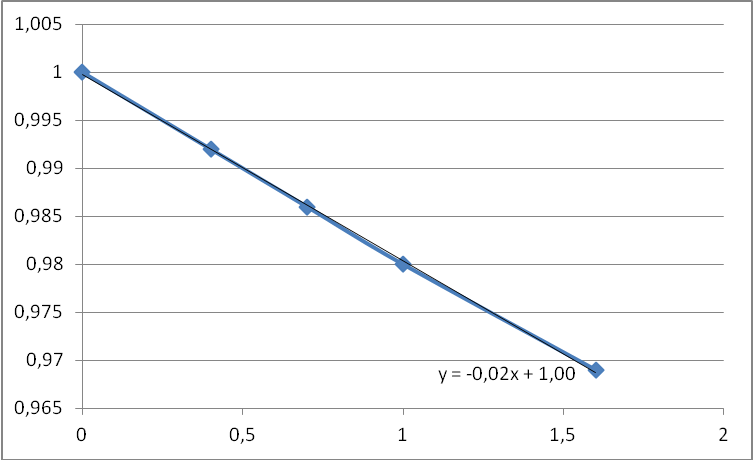   с сРис. 1. Кинетическая кривая расходования вещества А 2) Находим порядок реакции (n) и константу скорости (k) по кинетической кривой расходования вещества А. Для этого спрямляем кинетическую кривую в координатах «ln c – τ» (для реакции 1-го порядка) (рис. 4.2) или в координатах «1/c – τ» (для реакции 2-го порядка) (рис. 4.3). Т а б л и ц а 4.2
ln c 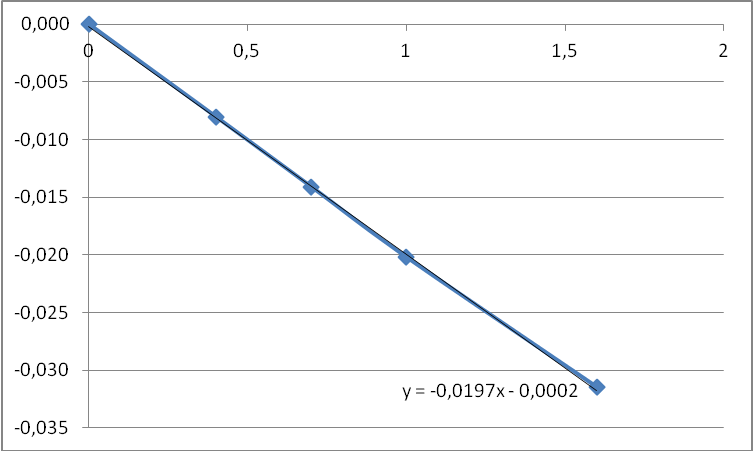 τ, c τ, cРис. 2 . Изменение концентрации вещества А во времени для реакции 1-го порядка 1/c 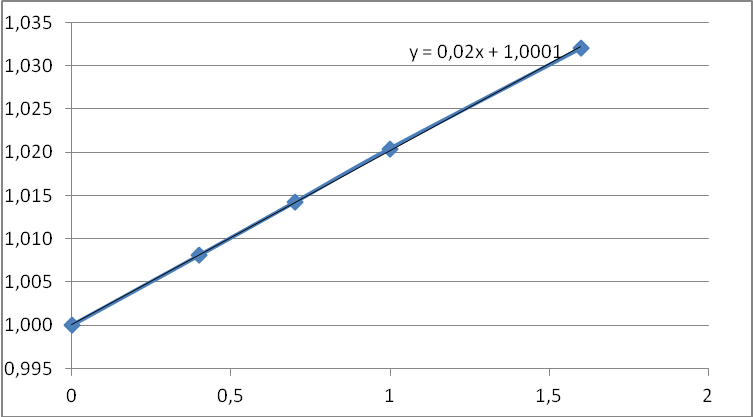 τ, c τ, cРис. 3. Изменение концентрации вещества А во времени для реакции 2-го порядка Для реакции 1-го порядка ln c = ln c0 – k·τ; k = Отрезок, отсекаемый на оси ординат – ln c0, а tg α = k. Как видно из рис. 4.2, реакция расходования вещества А не является реакцией 1-го порядка. Для реакции 2-го порядка 1/c = 1/c0 + kτ. Отрезок, отсекаемый на оси ординат – 1/c0, tg α = k = Как видно из рис. 3, реакция расходования вещества А является реакцией 2-го порядка. Таким образом V0 = 0,02 моль/л·с; k=0,02 л/моль·с. 4.3.Определите порядок и молекулярность реакции. Напишите выражение для определения скорости реакции PCl5 (г) = PCl3 (г) + Cl2 (г) Р е ш е н и е Порядок реакции определяется суммой величин показателей степени при значениях концентраций исходных веществ в кинетическом уравнении: V1 = K1[PCl5] Реакция первого порядка. Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. Реакция одномолекулярная Выражение для определения скорости реакции первого порядка V = K·CА, где СА– концентрация реагента СО. 4.4.2. В табл. 4.11 приведен температурный коэффициент γ=2,5 химической реакции для вашего варианта. При температуре 15 оС реакция заканчивается за τ=12,5 мин. Определите время протекания реакции при температуре 35 оС. Р е ш е н и е V35= V15· γ Таким образом, скорость реакции при повышении температуры на 20оС увеличится в 3 раза. Время уменьшится в 3 раза. 4.5. Напишите выражение и вычислите константу равновесия обратимой реакции, исходные и равновесные концентрации компонентов в системах (величины, которые нужно вычислить, обозначены через Х). Определите, в какую сторону сместится равновесие обратимой реакции при повышении температуры; как изменится скорость прямой и обратной реакций, если объем газовой смеси изменить в n раз (табл. 4.13).
Составим схему:
Находим константу равновесия: Обозначим Х2= [I2]=0,3+0,2=0,5 моль/л. 2) Так как ΔН > 0, то данная реакция является эндотермической и при повышении температуры равновесие сместится вправо. 3) Запишем выражение для скорости прямой реакции до изменения объема газовой смеси Vпр=Kc[H2][I2] Уменьшение объема газовой смеси в 2 раза равносильно увеличению давления и концентрации в 2 раза: Скорость прямой реакции уменьшится в 4 раза. Скорость обратной реакции определяется формулой Vобр=Kc[HI]2 Уменьшение объема газовой смеси в 2 раза равносильно увеличению давления и концентрации в 2 раза: Скорость обратной реакции уменьшится в 4 разf. Таким образом, при уменьшении объема газовой смеси в 2 раза, скорость прямой реакции уменьшается в 4 раз, а обратной в 4 раза. В целом равновесие данной реакции не смещается. 4.12. Во сколько раз необходимо повысить давление в газовой химической системе 2А + В = С, чтобы скорость образования вещества С возросла в 64 раза? Решение: V=k[A]2[B], если считать концентрации А и В одинаковыми, то: V2/V1= k[хA]2[хB] /k[A]2[B]=64=[х]3 Х=4. Ответ: в 4 раза | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
