КУРСОВАЯ. Тема Свойства паров
 Скачать 95.05 Kb. Скачать 95.05 Kb.
|
Глава 6. Стр. 147- 171 сделать сравнительную таблицу. Свойства паров, жидкостей и твердых тел. Парообразование (испарение и кипение). Конденсация. Удельная теплота парообразования. Насыщенный и ненасыщенный пар, их свойства. Влажность воздуха и ее измерение. Плавление и отвердевание тел. Удельная теплота плавления. Удельная теплота сгорания топлива. Уравнение теплового баланса для простейших тепловых процессов. Поверхностное натяжение жидкостей. Сила поверхностного натяжения. Смачивание. Капиллярные явления. Кристаллические и аморфные тела. Механические свойства твердых тел. Виды деформаций. Модуль Юнга. Парообразование (испарение и кипение). Конденсация. Удельная теплота парообразования. Жидкое состояние вещества характеризуется ближним порядком расположения молекул. Из-за малой сжимаемости жидкости сохраняют свой объем, благодаря текучести принимают форму сосуда. Парообразование – процесс перехода вещества из жидкого состояния в газообразное, сопровождающийся поглощением энергии. Испарение – вид парообразования, происходит с поверхности жидкости при любой температуре. Интенсивность испарения зависит от: площади поверхности жидкости; температуры жидкости; наличия ветра. Кипение – процесс интенсивного парообразования, происходящий по всему объему жидкости при постоянной температуре, называемой температурой кипения. Условие кипения: кипение происходит при температуре, когда давление насыщенного пара жидкости становится равным атмосферному или немного превышает его. Температура кипения зависит от: давления газа над поверхностью жидкости; наличия примесей. Кипение наступает при определенной температуре лишь тогда, когда жидкость содержит маленькие пузырьки растворенного в ней воздуха или другого газа. Если таковые отсутствуют (жидкость предварительно очищена длительным кипячением), то жидкость можно нагреть до температуры более высокой, чем обычная точка кипения. Такая жидкость называется перегретой. Конденсация – процесс перехода вещества из газообразного состояния в жидкое, сопровождается выделением энергии. Удельная теплота парообразования – скалярная физическая величина, характеризующая способность вещества к испарению; численно равна количеству теплоты, необходимому для преобразования единицы массы жидкости в пар при температуре её кипения. Количество теплоты, необходимое для испарения массы т жидкости, вычисляется по формуле: 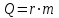 , где r – удельная теплота парообразования. , где r – удельная теплота парообразования.B системе SI: 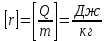 . .Удельная теплота конденсации равна удельной теплоте парообразования. Насыщенный и ненасыщенный пар, их свойства. Динамическое равновесие пара и жидкости – состояние, при котором число молекул, вылетающих из жидкости в единицу времени, равно числу молекул, возвращающихся в нее за то же время. Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным. Свойства насыщенного пара: насыщенный пар имеет при данной температуре наибольшее число молекул в единице объема (наибольшую плотность) и оказывает наибольшее давление. давление насыщенного пара при неизменной температуре – величина постоянная (закон Гей-Люссака неприменим, т.к. объем не зависит от температуры); давление насыщенного пара не зависит от его объема; концентрация молекул насыщенного пара в закрытом объеме с жидкостью неизменна при данной температуре, независимо от занимаемого объема; давление насыщенного пара возрастает с повышением температуры; законы Бойля-Мариотта и Шарля к насыщенному пару неприменимы вследствие изменения массы газа при изобарическом и изотермическом процессах. Пар, не находящийся в динамическом равновесии со своей жидкостью, называют ненасыщенным. Ненасыщенным будет пар над поверхностью жидкости, если испарение преобладает над конденсацией. Плотность ненасыщенного пара меньше, чем плотность насыщенного пара. С 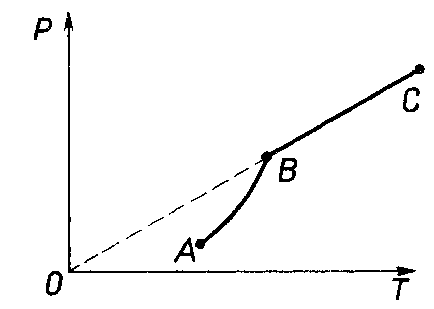 остояние насыщенного пара приближенно описывается уравнением состояния идеального газа, его давление определяется формулой остояние насыщенного пара приближенно описывается уравнением состояния идеального газа, его давление определяется формулой 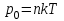 . .К участку АВ данный закон неприменим, т.к. в закрытом сосуде возрастает концентрация молекул пара, меняется масса пара. Когда вся жидкость испарится, пар при дальнейшем нагревании перестает быть насыщенным и его давление при постоянном объеме будет возрастать прямо пропоционально абсолютной температуре – участок ВС. Критическая температура – это температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным п 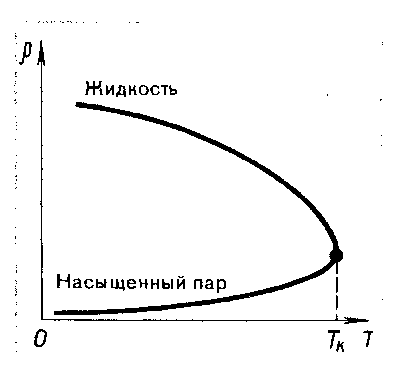 аром. аром.При температуре выше критической ни при каких давлениях газ нельзя обратить в жидкость. Влажность воздуха и ее измерение. Парциальным давлением водяного пара называют давление, которое оказывал бы водяной пар, если бы другие газы в смеси отсутствовали. Абсолютная влажность воздуха – скалярная физическая величина, характеризующая количество водяного пара, содержащегося в 1 м3сухого воздуха. Абсолютная влажность воздуха измеряется количеством водяного пара (в граммах), содержащегося в 1 м3сухого воздуха: 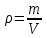 . .Относительная влажность воздуха – скалярная физическая величина, численно равная отношению абсолютной влажности к количеству пара, необходимого для насыщения 1 м3воздуха при той же температуре: 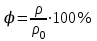 ; ;из уравнения Менделеева-Клапейрона 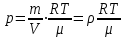 , то есть p ρ: , то есть p ρ: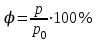 , ,где 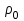 и и 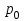 плотность и давление насыщенного пара при данной температуре соответственно. плотность и давление насыщенного пара при данной температуре соответственно.Снижением температуры можно довести относительную влажность воздуха до 100%, не изменяя количество водяного пара в нем. Температуру, при которой относительная влажность воздуха становится равной 100% (воздух оказывается насыщенным водяным паром), называют точкой росы. Приборы для определения относительной влажности воздуха: конденсационный гигрометр; волосяной гигрометр; психрометр. Плавление и отвердевание тел. Удельная теплота плавления. Удельная теплота сгорания топлива. Уравнение теплового баланса для простейших тепловых процессов. Твердыми в физике считают тела, имеющие дальний порядок распределения молекул (кристаллическую решетку) и определенную температуру плавления. Плавление – процесс перехода вещества из твердого (кристаллического) состояния в жидкое, происходящий при постоянной температуре (при неизменном давлении) – температуре плавления, сопровождающийся поглощением энергии. При нагревании твердого тела, с приближением к температуре плавления, силы притяжения между молекулами кристалла уменьшаются настолько, что начинает разрушаться кристаллическая решетка – происходит переход вещества в жидкое состояние. После достижения температуры плавления вся подведенная к телу энергия идет на увеличение потенциальной энергии молекул и преодоление связей между ними, а кинетическая энергия молекул и температура тела остаются неизменной. Удельная теплота плавления – скалярная физическая величина, численно равная количеству теплоты, необходимому для превращения 1 кг кристаллического вещества при температуре плавления в жидкость при той же температуре. 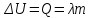 ; в системе SI: ; в системе SI: 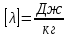 . .Удельная теплота сгорания топлива q – скалярная физическая величина, численно равная количеству теплоты, выделившемуся при полном сгорании 1 кг топлива. 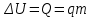 ; в системе SI: ; в системе SI: 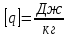 . .Уравнение теплового баланса: 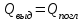 - при отсутствии потерь; - при отсутствии потерь; – при наличии потерь. – при наличии потерь.П  оверхностное натяжение жидкостей. Сила поверхностного натяжения. оверхностное натяжение жидкостей. Сила поверхностного натяжения.Поверхность - это граница между двумя контактирующими средами. Поверхность жидкости - это граница между жидкостью и газом (насыщенным паром вещества жидкости). Молекулы, находящиеся в поверхностном слое жидкости, имеют меньшее число соседей, нежели молекулы, находящиеся в объеме. Поэтому они испытывают действие не скомпенсированных, направленных вовнутрь сил притяжения со стороны остальной части жидкости. Это является причиной того, что поверхностный слой оказывает на всю жидкость большое внутреннее давление. Для изотермического перехода молекулы из объема на поверхность последняя должна выполнить работу против сил внутреннего давления. Поэтому потенциальная энергия молекулы в поверхностном слое больше, чем в объеме. Требование минимума потенциальной энергии в условиях равновесия достигается минимизацией поверхности. Для изотермического увеличения поверхности на малую величину ΔS надо выполнить работу А. Эта работа пропорциональна ΔS: 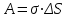 . .Коэффициент поверхностного натяжения (σ) – скалярная физическая величина, являющаяся основной термодинамической характеристикой поверхности; численно равна минимальной работе, которую необходимо выполнить, чтобы образовать 1 м2 новой поверхности: 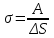 , в системе SI: , в системе SI: 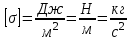 . .Е 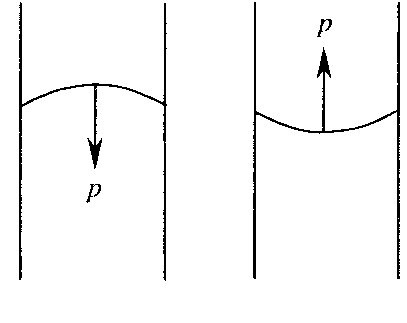 сли поверхность жидкости ограничена периметром смачивания, то сли поверхность жидкости ограничена периметром смачивания, то 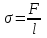 , ,где l – длина периметра смачивания, F – сила поверхностного натяжения, действующая на длине периметра смачивания. Давление насыщенного пара над искривленной поверхностью жидкости превышает давление пара над плоской поверхностью на величину 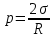 , , где р – дополнительное (Лапласово) давление, σ – коэффициент поверхностного натяжения, R – радиус сферической поверхности. Для сферической поверхности р>0, если мениск выпуклый, р<0,если мениск вогнутый. Смачивание. Капиллярные явления. Если в широкий сосуд налито большое количество жидкости, то форма 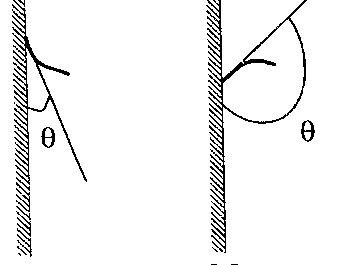 ее поверхности определяется силой тяжести, которая обеспечивает плоскую и горизонтальную поверхность. У самых стенок сосуда поверхность жидкости искривлена так, что образует мениск. Линия, по которой мениск пересекается с твердым слоем стенки, называется периметром, а угол θ – между смоченной поверхностью стенки и мениском – краевым углом. ее поверхности определяется силой тяжести, которая обеспечивает плоскую и горизонтальную поверхность. У самых стенок сосуда поверхность жидкости искривлена так, что образует мениск. Линия, по которой мениск пересекается с твердым слоем стенки, называется периметром, а угол θ – между смоченной поверхностью стенки и мениском – краевым углом.Если θ < 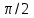 , то жидкость смачивает стенку, если θ > , то жидкость смачивает стенку, если θ >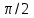 – не смачивает, если θ = 0 – смачивание идеальное. – не смачивает, если θ = 0 – смачивание идеальное.Если расстояние между поверхностями, ограничивающими жидкость, сравнимы с радиусом кривизны поверхности жидкости, то такие сосуды называются капиллярными. Явления, происходящие в таких сосудах, называются капиллярными явлениями. Изменение высоты уровня жидкости в капиллярах называется капиллярностью. У 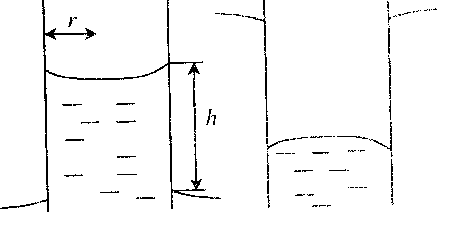 ровень жидкости в капилляре выше (ниже), чем в сосуде на величину h, если жидкость смачивает (не смачивает) стенки сосуда. ровень жидкости в капилляре выше (ниже), чем в сосуде на величину h, если жидкость смачивает (не смачивает) стенки сосуда.Высота подъема жидкости в капилляре определяется формулой Жюрена: 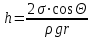 , ,где θ – краевой угол, ρ – плотность жидкости, g – ускорение свободного падения, r – радиус капилляра. Кристаллические и аморфные тела. Кристаллические тела имеют дальний порядок расположения молекул, имеют определенную температуру плавления, неизменную при постоянном давлении. Кристаллы характеризуются значительными силами межмолекулярного взаимодействия и сохраняют постоянными объем и форму. Монокристалл – твердое тело, представляющее собой один кристалл (кусочки сахара в сахарном песку, кусочки соли, горного хрусталя и т.д.). Анизотропия свойств монокристаллов – неодинаковость физических (механических, тепловых, электрических, магнитных, оптических) свойств в разных направлениях. Поликристаллы – тела, состоящие из множества сросшихся между собой монокристаллов (металлы). Изотропия свойств – одинаковость физических свойств по всем направлениям; присуща поликристаллам и аморфным телам. Аморфные тела – твердые тела, имеют ближний порядок расположения молекул ("переохлажденные жидкости"), не имеют определенной температуры плавления, пластичны, изотропны. Жидкие кристаллы – вещества с двойной природой – и жидкости, и твердого тела. Имеют дальний порядок расположения молекул в одном направлении (в отличие от любых трех взаимно перпендикулярных направлений в твердых телах) – одноосный дальний порядок. Жидкие кристаллы текучие и образуют капли, имеющие не сферическую, а удлиненную форму. По механическим свойствам напоминают жидкости, вязкость которых колеблется от жидкого клея до твердого стекла. Механические свойства твердых тел. Виды деформаций. Модуль Юнга. Деформация – явление изменения формы или объема твердого тела под действием внешних сил. Механическое напряжение (σ) – скалярная физическая величина, характеризующая состояние деформированного тела, численно равная отношению модуля силы упругости F к площади поперечного сечения тела S: 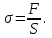 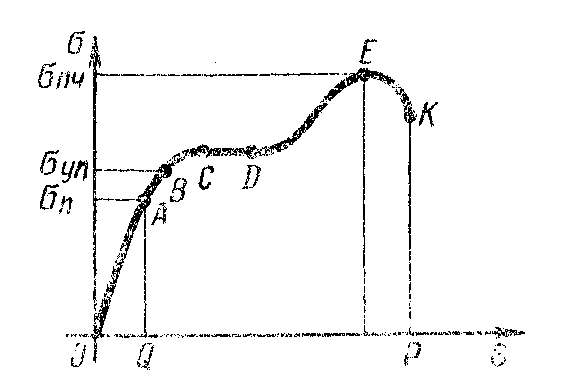 В системе SI за единицу механического напряжения принимают 1 Па, как и для давления: 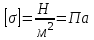 . .Предел пропорциональности ( 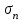 ) – точка А на диаграмме растяжений; напряжение, при котором еще выполняется закон Гука. ) – точка А на диаграмме растяжений; напряжение, при котором еще выполняется закон Гука.Упругость – свойство твердых тел восстанавливать свою форму и объем после прекращения действия силы. Остаточная деформация остается в теле после прекращения действия силы. Пластичность – свойство твердых тел приобретать остаточную деформацию. Предел упругости ( 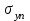 ) – точка В на диаграмме растяжений; напряжение, при котором в теле начинает возникать остаточная деформация. ) – точка В на диаграмме растяжений; напряжение, при котором в теле начинает возникать остаточная деформация.Прочность – способность материала сопротивляться разрушению и остаточной деформации, возникающим вследствие внешних влияний. Предел прочности ( 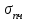 ) – точка Е на диаграмме растяжений. ) – точка Е на диаграмме растяжений.Запас прочности (коэффициент безопасности) – число, показывающее, во сколько раз предел прочности превышает допустимое значение. Абсолютное удлинение: 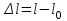 . .Относительное удлинение 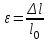 . .Модуль Юнга Е (модуль упругости) – скалярная физическая величина, характеризующая способность вещества к упругой деформации, численно равен такому механическому напряжению, при котором длина образца увеличилась бы в два раза. В системе SI: 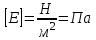 . .Виды деформаций: Растяжение (сжатие – отрицательное растяжение). Для случая упругих деформаций растяжения сформулирован закон Гука: при малых деформациях механическое напряжение прямо пропорционально механическому напряжению: 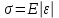 . .Деформации растяжения подвергаются тросы при поднятии грузов, буксировке, балки строительных ферм и т.д.; деформации сжатия – колонны и фундаменты зданий, стены домов и т.д. Сдвиг – возникает под действием сил, приложенных к двум противоположным граням тела. Закон Гука для деформации сдвига: угол сдвига α прямо пропорционален силе, приходящейся на единицу площади тела: 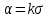 , k – коэффициент сдвига. , k – коэффициент сдвига.Кручение – возникает в стержне, один коней которого закреплен, а к другому приложены две равные, но противоположно направленные силы. Закон Гука: угол закручивания φ прямо пропорционален моменту силы М и длине стержня l: 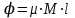 , μ – коэффициент кручения. , μ – коэффициент кручения.Изгиб – деформация под действием силы F, характеризующаяся стрелой прогиба h. |
