Тема выпускной квалификационной работы Анализ ассортимента, свойства и применение термопластичных фторсодержащих полимеров
 Скачать 383.55 Kb. Скачать 383.55 Kb.
|
3 Термодинамический анализ реакции полимеризации ТФХЭРеакция полимеризации трифторхлорэтилена: Поскольку в литературных источниках отсутствуют некоторые термодинамические данные о полимере произведем их расчет по Сато и Шоудля твердого и жидкого агрегатного состояния при Т= 298 К [27]. Таблица 6 – групповые вклады в мольную теплоемкость для ПТФХЭ
Приближение для температурной зависимости теплоёмкости для политрифторхлорэтилена записывается в следующем виде: 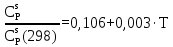 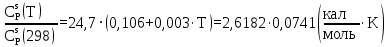 Для перевода калорий в Джоули воспользуемся коэффициентом Россини, равному 1 кал=4,184 Дж 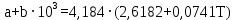 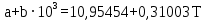 Таблица 7 – групповые вклады в мольную теплоемкость для ТФХЭ
Приближение для температурной зависимости теплоёмкости для трифторхлорэтилена записывается в следующем виде: 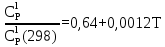 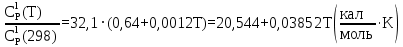 Для перевода калорий в Джоули воспользуемся коэффициентом Россини, равному 1 кал=4,184 Дж 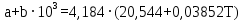 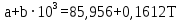 Рассчитаем изобарно-изотермический потенциал образования целевого продукта, для этого суммируем групповые вклады. Таблица 8 – групповые вклады в мольную теплоемкость для ПТФХЭ
Получаем: 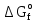 (ПТФХЭ)= -147999-8,8Т (кал/моль) (ПТФХЭ)= -147999-8,8Т (кал/моль) Или: 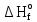 ,298= -620,115 кДж/ моль; ,298= -620,115 кДж/ моль; S°298= -36,872Дж/К Таблица 9 – групповые вклады в мольную теплоемкость для ТФХЭ
Получаем: 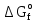 (ТФХЭ)= -129799+19,2Т (кал/моль) (ТФХЭ)= -129799+19,2Т (кал/моль) Или: ∆Н°f,298= -543,857 кДж/ моль; S°298= 80,448 Дж/К Таблица 10 – Термодинамические свойства веществ целевой реакции
По входным данным рассчитаем значения энатльпии (2), энтропии (3) и энергии Гиббса (4) при 298 К: 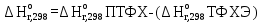 (2) (2)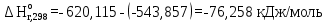 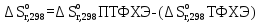 (3) (3)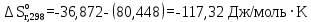 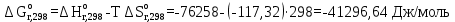 (4) (4)По следствию изменения закона Гесса рассчитаем вириальные изменения коэффициентов теплоёмкости 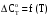 (5) : (5) :∆I = i(Продукт) – (i(ХЭД)+i(ДМАТЭГ)) (5) 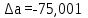 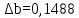 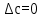 При помощи уравнения Кирхгофа рассчитаем аналитическую зависимость энтальпии от температуры 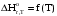 (6): (6):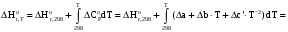 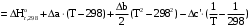 (6) (6)Рассчитываем аналитическую зависимость изменения энтропии от температуры 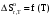 (7): (7):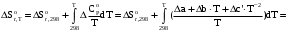 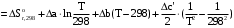 (7) (7)По уравнению изотермы Вант-Гоффа рассчитываем изменение энергии Гиббса (8): 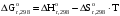 (8) (8)Из уравнения (9) выводим зависимость константы равновесия от температуры 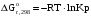 (9) (9)Получаем (10): 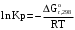 (10) (10)Найдём зависимость значений 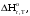 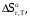 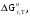 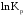 в температурном интервале 298-398 К, результаты занесем в таблицу в температурном интервале 298-398 К, результаты занесем в таблицу Таблица 11 – результаты термодинамического анализа
Построим графики зависимостей 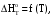 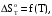 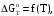 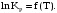 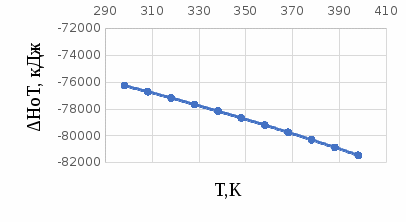 Рисунок 2 - График зависимости 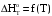 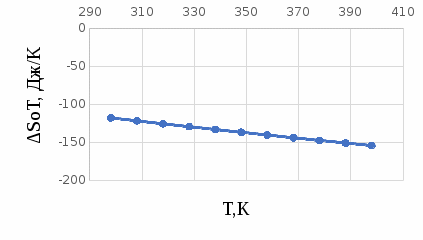 Рисунок 3 - График зависимости 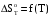 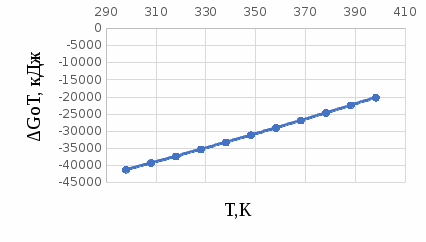 Рисунок 4 - График зависимости 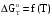 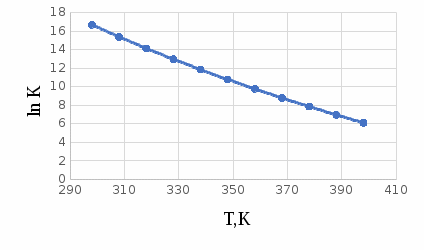 Рисунок 5 - График зависимости 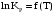 На основании проведенного термодинамического анализа можно сделать следующие выводы: 1. В исследуемом интервале температур изменение энтальпии реакции ∆H0T<0, следовательно, реакция является экзотермической (проходит с выделением тепла). Тепловой эффект реакции с увеличением температуры уменьшается. 2. Изменение энергии Гиббса в интервале температур от 298 до 398 К имеет отрицательное значение (∆G0T<0), то есть реакция самопроизвольно протекает в прямом направлении. 3. Согласно уравнению изобары Вант-Гоффа 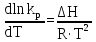 в случае экзотермической реакции температурный коэффициент константы равновесия в случае экзотермической реакции температурный коэффициент константы равновесия 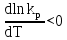 , и с ростом температуры константа равновесия уменьшается, что соответствует рассчитанным значениям. Высокие значения константы равновесия также говорят о смещении равновесия реакции в сторону образования продуктов. , и с ростом температуры константа равновесия уменьшается, что соответствует рассчитанным значениям. Высокие значения константы равновесия также говорят о смещении равновесия реакции в сторону образования продуктов. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

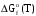 , (кал/моль)
, (кал/моль)