курсовая работа по теоритическим основам горения и тушения. КП Олзобоев 18 вариант. Теоретические основы процессов горения и тушения курсовая работа исследование пожаровзрывоопасности горючих жидкостей на примере пропилбензола
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
ВведениеПропи́лбензо́л, н-пропилбензол (C9H12) — органическое химическое соединение класса ароматических углеводородов. При нормальных условиях бесцветная жидкость. Характерными чертами его являются большая устойчивость бензольного ядра и особая склонность к реакциям замещения, а не присоединения. Пропилбензол можно получить по реакции Фриделя-Крафтса, бензола с первичным галогенпроизводным пропана но с низким (30% - 36%) выходом. При этом образующийся в ходе реакции первичный карбкатион перегруппировывается в более устойчивый вторичный. Н-пропилбензол применяется в различных органических синтезах для получения производных, ацетона, фенолов; в производстве пластмасс, резин и каучуков. Может использоваться в качестве растворителя красок и лаков, добавки в топлива. Является изомером кумола. Применяется в качестве добавки к моторным топливам для повышения октанового числа, в органическом синтезе для получения ацетона и фенола и в качестве растворителя. Неагрессивен по отношению к алюминию, нержавеющим сталям. Токсичен. Исходные данныеВещество: Пропилбензол. Химическая формула: C9H12. Температура кипения: 159,20С. Остаточное содержание кислорода в ПГ 15,2% Константы уравнения Антуана: А=6,29713, В=1627,827, С=220,499. 3. ОПРЕДЕЛЕНИЕ ХАРАКТЕРИСТИК ГОРЕНИЯХарактер свечения пламениТаблица 1. Характер свечения пламени в зависимости от (С) и (Н).
Определим характер свечения пламени пропилбензола. Массовые доли углерода и кислорода в молекуле пропилбензола составляют: Мr ( 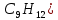 = 9*12+1*12=120 = 9*12+1*12=120 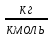 (С) = 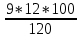 =90 %; =90 %;Массовая доля углерода >75%, а кислорода в данном элементе нет, следовательно, пламя при горении пропилбензола яркое, коптящее. 3.2 Теоретический и практический расход воздуха на горениеАлгоритм расчета теоретического количества воздуха зависит от агрегатного состояния вещества и его химической природы. Для удобства вычислений горючие вещества подразделяют на три основные группы: индивидуальные химические соединения с известной химической формулой; конденсированные горючие вещества неизвестного химического строения, но с известным элементным составом; смесь газов или паров. 3.2.1 Горючее-индивидуальное химическое соединениеВ этом случае теоретическое количество воздуха Vв° определяется непосредственно из уравнения материального баланса с помощью известного следствия из закона Авогадро. Определим расчет теоретического количества воздуханагорение пропилбензола: 1.Уравнение реакции горения пропилбензола в воздухе: C9H12 +12(О₂ + 3,76 N₂) = 9СО₂ +6Н₂О + 12· 3,76 N₂ 2.По уравнению на 1 кмоль пропилбензола расходуется (12 + 12*3,76) = 57,12 кмоля воздуха, значит, Vв° =57,12  . Известно, что 1 кмоль газа при нормальных условиях занимает объем 22,4 . Известно, что 1 кмоль газа при нормальных условиях занимает объем 22,4 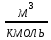 , поэтому необходимый объем воздуха на 1 кмоль пропилбензола будет равен: , поэтому необходимый объем воздуха на 1 кмоль пропилбензола будет равен: 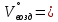 22,4*57,12 = 1279,488 22,4*57,12 = 1279,488 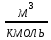 . .3.Молекулярная масса пропилбензола: Мr ( 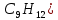 = 9*12+1*12=120 = 9*12+1*12=120 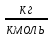 ,т.е. масса 1 кмоль равна 120 кг. ,т.е. масса 1 кмоль равна 120 кг. 4. 1 кг пропилбензола: 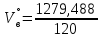 =10,66 =10,66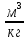 . . Таблица 2 - Теоретический расход воздуха на горение пропилбензола
В общем виде ход приведенных вычислений можно записать с помощью простых формул: 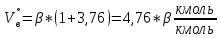 где β - стехиометрический коэффициент воздуха (кислорода) в уравнении материального баланса. 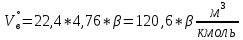 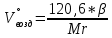 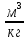 . .где Мr - молекулярная (атомная) масса горючего, кг/кмоль. Если нужно привести теоретический объем воздуха к условиям, отличным от нормальных, то используется известная формула объединенного газового закона: 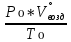 = = 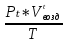 Определим расчет объема воздуха для сгорания 6,4 кг пропилбензола при t = 20 °С и нормальном давлении, если α = 2,8. 1.Уравнение реакции горения пропилбензола в воздухе: C9H12 +12(О₂ + 3,76 N₂) = 9СО₂ +6Н₂О + 12· 3,76 N₂ 2.Молярная масса пропилбензола: Мr ( 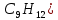 = 9*12+1*12=120 = 9*12+1*12=120  3.Объем кмоль газа при заданных условиях: 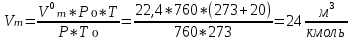 4.Практический объем воздуха, необходимый для сгорания 6,4 кг пропилбензола: 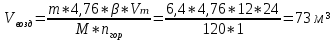 5.Практический расход воздуха: 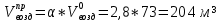 | ||||||||||||||||||||||||||

 пропилбензола
пропилбензола