курсовая работа по теоритическим основам горения и тушения. КП Олзобоев 18 вариант. Теоретические основы процессов горения и тушения курсовая работа исследование пожаровзрывоопасности горючих жидкостей на примере пропилбензола
 Скачать 1.04 Mb. Скачать 1.04 Mb.
|
3.5 Стехиометрическая концентрация в паровоздушной смесиСтехиометрическая концентрация горючего в смеси - такая концентрация горючих паров или горючего газа в горючей смеси (горючее + окислитель), при которой количественное соотношение горючего и окислителя соответствует коэффициентам в уравнении химической реакции. объемная стехиометрическая концентрация (в %): ϕ стех. объём.= 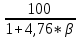 , %; , %;массовая стехиометрическая концентрация (в кг/м3): ϕ стех. объём.= 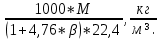 Для пересчета массовой концентрации в объемную, или наоборот, применяются формулы: 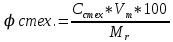 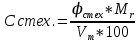 Определимобъемнуюимассовуюстехиометрическуюконцентрациюпропилбензолапри нормальных условиях. 1.Запишем уравнение реакции горения пропилбензола: C9H12 +12(О₂ + 3,76 N₂) = 9СО₂ +6Н₂О + 12· 3,76 N₂ β=12 2. Определим объемную стехиометрическую концентрацию: ϕ стех. объём.=  =1,72 %; =1,72 %;3.Молярная масса Мr ( 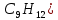 = 9*12+1*12=120 = 9*12+1*12=120 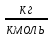 4. Определим массовую стехиометрическую концентрацию: ϕ стех. масс.= 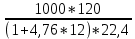 =92,17 % =92,17 % 3.6 Расчет температуры горенияЗа адиабатическую температуру горения принимается температура, при которой численное значение энтальпии продуктов сгорания совпадает с тепловым эффектом реакции. Таблица 3. Энтальпия (теплосодержание) газов при постоянном давлении.
Таблица 4. Алгоритм расчета температуры горения.
Вычислимдействительнуютемпературугоренияпропилбензола 1.Запишем уравнение реакции горения пропилбензола: C9H12 +12(О₂ + 3,76 N₂) = 9СО₂ +6Н₂О + 12· 3,76 N₂ β=12 2.По уравнению реакции горения определяем количество кмоль продуктов горения:   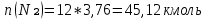 ∑Vпгi=9+6+47,12=60,12 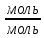 3.Рассчитаем Qнизш: Qнизш = Ʋ∑Qпр. реакции - Ʋ∑Qисх.в-ва Q(СO₂) =396,6  Q(Н₂O) =242,2  Q( 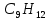 ) =-46,22 ) =-46,22 Qнизшее( 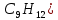 = (9*396,6+6*242,2)-(-46,22)=5068,82 = (9*396,6+6*242,2)-(-46,22)=5068,82 4.Определим среднее значение энтальпии: Hсредн= 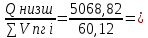 84,31 84,31  5.Методом подбора подставим значения максимально нам подходящие: Т1=24000С 6.Рассчитываем теплосодержание продуктов горения при температуре Т1: H(СO₂)=133,0  H(Н₂O)=109,6  H(N₂)=81,5  Q1 = ∑Hi*Vпгi= 9*133,0+6*109,6+81,5*45,12=5331,88  5331,88> 5068,82 7.Рассчитываем теплосодержание продуктов горения при температуре Т2: Т2=23000С H(СO₂)=126,9  H(Н₂O)=104,2  H(N₂)=77,8  Q2 = ∑Hi*Vпгi= 9*126,9+6*104,2+77,8*45,12=5277,636  5277,36> 5068,82 Т3=22000С H(СO₂)=120,8  H(Н₂O)=98,8  H(N₂)=74,1  Q3 = ∑Hi*Vпгi= 9*120,8+6*98,8+74,1*45,12=5023,392  5023,392˂ 5068,22˂5277,636-неравенство выполняется, следовательно, находим Тгор.: Тгор= Т3 + 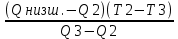 ; 0C ; 0CТгор=2200+ 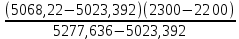 = 2218 0С = 2218 0С | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

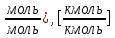
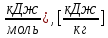
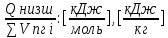
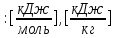
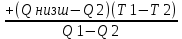 0С
0С