Теоретические вопросы вариант 6. Теоретические вопросы. Вариант Задание Атомномолекулярное учение. Теория Резерфорда, е достоинства и недостатки
 Скачать 89.04 Kb. Скачать 89.04 Kb.
|
|
Теоретические вопросы. Вариант 6. Задание 1. Атомно-молекулярное учение. Теория Резерфорда, еѐ достоинства и недостатки. Резерфорд предложил Планетарную модель атома: В центре атома находится маленькое плотное положительное Ядро, а вокруг его вращаются отрицательные электроны. Размер атома определяется диаметром орбиты вращения электронов вокруг ядра. В целом атом электронейтрален. Данная модель хорошо согласовалась со всеми известными явлениями, включая и опыты по рассеянию a-частиц. Строение 3-х первых атомов таблицы Менделеева по Резерфорду: Н - 1 протон, 1 электрон; Не 2 протона, 2 нейтрона, 2 электрона; Li - 3 протона, 4 нейтрона, 3 электрона. Из всех опытов Резерфорд пришел к следующим представлениям о строении атомов. Внутри атома имеется положительно заряженное ядро, заряд которого +ze, причем в ядре сосредоточен весь положительный заряд атома. С ядром связана и большая часть массы атома. Заряд ядра совпадает с порядковым номером элемента в таблице Менделеева. Так как атом нейтрален, то в атоме кроме положительно заряженного ядра есть электроны, причем суммарный заряд электронов равен положительному заряду ядра. Положительно заряженное ядро и электроны, входящие в состав атома, определяют внутриатомное эл. поле, которое в свою очередь характеризует межатомные взаимодействия. Т.к. атом является устойчивой системой, то конфигурация электронов в атоме является устойчивой. Однако никакое устойчивое распределение зарядов не может быть статическим. На основании этого Резерфорд пришел к выводу, что электроны должны вращаться вокруг ядра. Однако модель Резерфорда явилась не универсальной. Недостатки: 1) атом Резерфорда излучает непрерывно, то спектр излучения атома должен быть сплошным. Опыт показывает, что спектры носят линейчатый характер. 2) Согласно законам электродинамики электрон, вращаясь вокруг ядра, обладая нормальным ускорением, должен непрерывно излучать электромагнитные волны => его энергия и расстояние между электроном и ядром должны непрерывно убывать. Т.к. из эксперимента известно, что атом излучает в течении τ=10-8 с, то атом Резерфорда может существовать в течении этого времени, а после электрон упадет на ядро и атом прекратит свое существование. Эти недостатки имели принципиальное значение. Они показали, что движение электронов в атомах подчиняется иным законам, не нашедшим отражения в классической физике. Достоинства модели Резерфорда: Хорошо описывает геометрическое строение атома. Задание 2. Гибридизация атомных орбиталей. Типы гибридизации. Пространственное расположение гибридных атомных орбиталей. Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии орбиталей данного атома с возникновением того же числа новых (гибридных) орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при образовании ковалентных связей. Гибридные орбитали имеют форму объёмной несимметричной восьмёрки, сильно вытянутой в одну сторону от атомного ядра: . Такая форма обусловливает более сильное, чем в случае чистых атомных орбиталей, перекрывание гибридных орбиталей с орбиталями (чистых или гибридных) других атомов и приводит к образованию более прочных ковалентных связей. Поэтому энергия, затрачиваемая на гибридизацию атомных орбиталей, с избытком компенсируется выделением энергии за счёт образования более прочных ковалентных связей с участием гибридных орбиталей. Название гибридных орбиталей и тип гибридизации определяются числом, типом участвующих в гибридизации атомных орбиталей, например: sp-, sp2-, sp3, sp2d- или sp3d2-гибридизация. Направленность гибридных орбиталей, а следовательно, и геометрия молекулы зависят от типа гибридизации. На практике обычно решается обратная задача: вначале экспериментально устанавливается геометрия молекулы, после чего описывается тип и форма гибридных орбиталей, участвующих в её образовании. sp-Гибридизация.Две гибридных sp-орбитали в результате взаимного отталкивания располагаются относительно атомного ядра таким образом, что угол между ними составляет 180° (рис. 1). 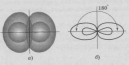 Рисунок - 1 Взаимное расположение в пространстве двух sp-гибридных орбиталей одного атома: а - поверхности, охватывающие области пространства, где вероятность пребывания электрона составляет 90 %; б - условное изображение. В результате такого расположения гибридных орбиталей молекулы состава АХ2, где А является центральным атомом, имеют линейное строение, то есть ковалентные связи всех трёх атомов располагаются на одной прямой. Линейную конфигурацию вследствие sp-гибридизации валентных орбиталей атомов имеют также молекулы ВеН2, Ве(СН3)2, ZnCl2, CO2, HC≡N и ряд других. sр2-Гибридизация.Рассмотрим гибридизацию одной s- и двух р-орбиталей. В этом случае в результате линейной комбинации трёх орбиталей возникают три гибридные sр2-орбитали. Они располагаются в одной плоскости под углом 120° друг к другу (рис. 2). sр2-Гибридизация характерна для многих соединений бора, который, как показано выше, в возбуждённом состоянии имеет три неспаренных электрона: один s- и два р-электрона. При перекрывании sр2-орбиталей атома бора с орбиталями других атомов образуются три ковалентные связи, равноценные по длине и энергии. Молекулы, в которых валентные орбитали центрального атома находятся в состоянии sр2-гибридизации, имеют треугольную конфигурацию. Углы между ковалентными связями равны 120°. В состоянии sр2-гибридизации находятся валентные орбитали атомов бора в молекулах BF3, BC13, атомов углерода и азота в анионах СО32-, NO3-. 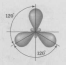 Рисунок 2 - Взаимное расположение в пространстве трёх sр2-гибридных орбиталей. sр3-Гибридизация.Очень большое распространение имеют вещества, в молекулах которых центральный атом содержит четыре sр3-орбитали, образующиеся в результате линейной комбинации одной s- и трёх р-орбиталей. Эти орбитали располагаются под углом 109˚28′ друг к другу и направлены к вершинам тетраэдра, в центре которого находится атомное ядро (рис. 3а). Образование четырёх равноценных ковалентных связей за счёт перекрывания sр3-орбиталей с орбиталями других атомов характерно для атомов углерода и других элементов IVA-группы; это обуславливает тетраэдрическую структуру молекул (СН4, CC14, SiH4, SiF4, GeH4, , GeBr4 и др). 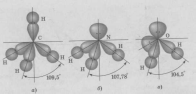 Рисунок - 3 Влияние несвязывающих электронных пар на геометрию молекул: a – метана (несвязывающих электронных пар нет); б – аммиака (одна несвязывающая электронная пара); в – воды (две несвязывающие пары). Неподелённые электронные пары гибридных орбиталей. Во всех рассмотренных примерах гибридные орбитали были "заселены" одиночными электронами. Однако нередки случаи, когда гибридная орбиталь "заселена" электронной парой. Это оказывает влияние на геометрию молекул. Поскольку несвязывающая электронная пара испытывает воздействие ядра только своего атома, а связывающая электронная пара находится под действием двух атомных ядер, несвязывающая электронная пара находится ближе к атомному ядру, чем связывающая. В результате этого несвязывающая электронная пара сильнее отталкивает связывающие электронные пары, чем те отталкивают друг друга. Задание 3. Общая теория растворов и растворителей. Способы выражения концентрации растворов. Концентрация раствора – это величина, отражающая пропорции между растворенным веществом и растворителем. Такие качественные понятия, как «разбавленный» и «концентрированный», говорят только о том, что раствор содержит мало или много растворенного вещества. Для количественного выражения концентрации растворов часто используют проценты (массовые или объемные), а в научной литературе – число молей или химических эквивалентоврастворенного вещества на единицу массы или объема растворителя либо раствора. Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные. 1.Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы. ωв =mв-ва/mр-ра*100% 2.Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах. φ= V1/V V1- объём растворённого вещества, л V- общий объём раствора, л. 3.Молярная концентрация (молярность) — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации CM, которое принято обозначать М. ν — количество растворённого вещества, моль; V — общий объём раствора, л. 4.Моляльность - количество растворённого вещества (число молей) в 1000 г растворителя. Сm=n/m1*1000 Сm=n/m2-m3*1000 Сm=m3/M(m2-m3)*1000, где m1-масса раствора, m2-масса растворителя, m3-растворенного вещества. 5.Мольная доля-отношение число гр. молекул данного вещества к общему числу гр. молекул всех веществ в растворе. Мольную долю выражают в долях единицы. N=n2/(n1+n2), где n1-число растворителя, n2-число грамм молекул растворенного вещества. 6.Титр раствора — масса растворённого вещества в 1 мл раствора. Где m1— масса растворённого вещества, г; V — общий объём раствора, мл; 7.Нормальность - количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов) Сн=m/mЭ*V, где m-растворенного вещества, mЭ-масса эквивалентов. Задание 4. Реакции ионного обмена. Условия их необратимости. Реакции ионного обмена– ионные реакции, при которых сложные вещества обмениваются составными частями, а изменения степеней окисления элементов не происходит. Необратимые ионные реакции – реакции, в результате которых образуется газ осадок или малодиссоциирующее вещество (например, вода). Для записи полных ионных уравнений используется таблица растворимости В растворах электролитов реакции протекают между ионами. Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления. Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. Условия течения реакций в растворах электролитов до конца: 1) в результате реакции выпадает осадок: 2) в результате реакции выделяется газ: 3) в результате реакции образуется малодиссоциирующее вещество: Задание 5. Химические источники тока. Гальванические элементы. Химические источники электрического тока или гальванические элементы преобразуют энергию, выделяющуюся при протекании окислительно-восстановительных реакций, в электрическую энергию. Гальванические элементы служат источниками постоянного тока. Они подразделяются на химические и концентрационные. Простейший химический гальванический элемент можно составить из двух металлических электродов, имеющих различные электродные потенциалы, и соединенных в замкнутую цепь. На электроде, который имеет меньшее значение электродного потенциала, будет происходить процесс окисления. Такой электрод называется иначе анодом. На электроде, который имеет большее значение электродного потенциала, будет происходить процесс восстановления. Такой электрод называется иначе катодом. Рассмотрим более подробно принцип работы гальванических элементов на примере элемента, составленного из цинкового и медного электродов. Такой элемент называется иначе элементом Якоби-Даниэля (рис. 6). 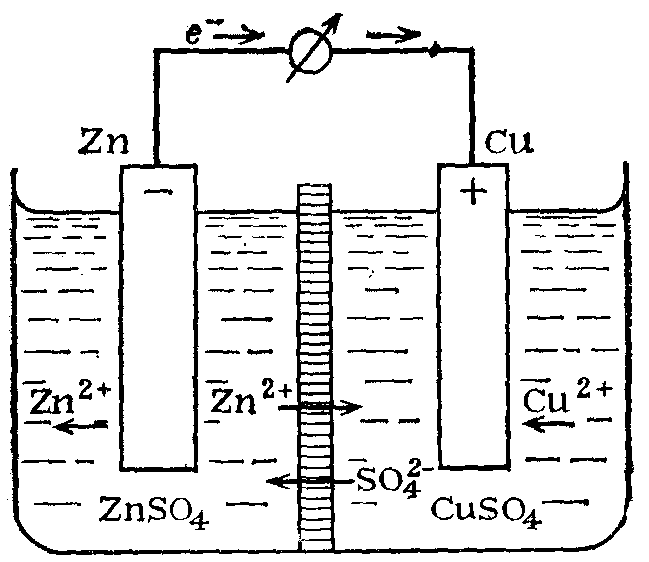 Рисунок 6 - Схема медно-цинкового гальванического элемента Каждый электрод состоит из металлической пластинки, опущенной в раствор соли: ZnSO4 и CuSO4, соответственно. Растворы солей отделены друг от друга пористой перегородкой, сквозь которую легко могут проходить ионы металлов и SO42-. Часто вместо пористой перегородки используют «солевой мостик» – стеклянную изогнутую трубку, заполненную насыщенным раствором KCl (рис. 7). В этом случае электроды не контактируют друг с другом, каждый из них находится в отдельном сосуде, которые соединяются с помощью солевого мостика. 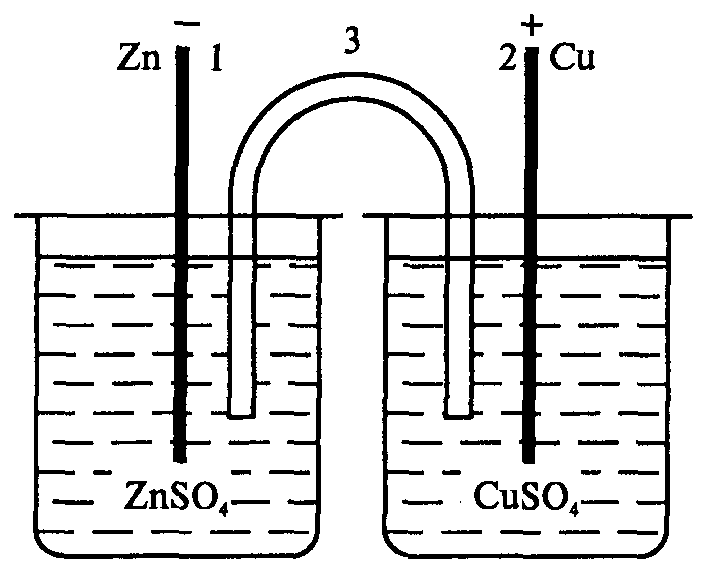 Рисунок 7 - Схема медно-цинкового элемента с солевым мостиком. 1 – цинковая пластинка; 2 – медная пластинка; 3 – солевой мостик При этом на цинковом электроде происходит процесс окисления: Zn0– 2ē =Zn2+, в результате которого ионы цинка с пластинки переходят в раствор. Избыточные электроны по металлическому проводнику с цинковой пластинки переходят на медную и восстанавливают содержащиеся в растворе ионы Cu2+ Cu2++ 2ē =Cu0, которые в виде нейтральных атомов оседают на пластинке. Остающиеся свободные сульфат-ионы медного электрода и появившиеся в избытке ионы Zn2+цинкового электрода через пористую перегородку или солевой мостик перемещаются навстречу друг другу. Таким образом, в цепи осуществляется перенос электрических зарядов и возникает электрический ток. В этом элементе электрическая энергия получается в результате протекания химической реакции Zn+CuSO4=Cu+ZnSO4 Основной характеристикой гальванического элемента является электродвижущая сила ЭДС, от которой зависит сила тока в цепи. Она равна разности электродных потенциалов ЭДС = Е2– Е1, где Е1 и Е2 – соответственно, потенциал анода и катода. Для гальванического элемента Якоби-Даниэля электродвижущая сила равна э.д.с. = ЕCu–EZn Чем выше значение э.д.с. элемента, тем больше сила тока в его цепи. Согласно уравнению Нернста, потенциал медного и цинкового электродов рассчитывается по формулам: ECu =ECu0+ EZn=EZn0+ Вычитая второе уравнение из первого получим выражение для расчета э.д.с. медно-цинкового гальванического элемента э.д.с. = ECu0–EZn0+ |
