|
|
ответы по машиностроению. Теория сварочных процессов
ТЕОРИЯ СВАРОЧНЫХ ПРОЦЕССОВ
1
|
Агрегатные состояния вещества, условия для изменения агрегатного состояния и свойства веществ в разных агрегатных состояниях.
|
Агрегатное состояние — это состояние вещества, которое зависит от температуры и давления. В природе вещества встречаются в трёх агрегатных состояниях: твёрдом, жидком и газообразном.
В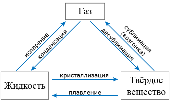 ещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии — жидким веществом или жидкостью, в газообразном — газообразным веществом или газом. При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях. ещество, находящееся при стандартных условиях в твёрдом состоянии, называется твёрдым веществом, в жидком состоянии — жидким веществом или жидкостью, в газообразном — газообразным веществом или газом. При одинаковых условиях (температуре и давлении) различные вещества могут находиться в разных агрегатных состояниях.
Переходы между агрегатными состояниями
Многие вещества при изменении условий могут переходить из одного агрегатного состояния в другое.
Пример. При температуре ниже 0 °C вода превращается в лёд, т. е. переходит из жидкого состояния в твёрдое.
Переход вещества из газообразного состояния в жидкое называется конденсацией. Переход вещества из жидкого состояния в газообразное называется испарением.
При увеличении температуры вещества испарение становится интенсивнее. И, наконец, при определённой температуре испарение становится настолько интенсивным, что жидкость закипает. Такая температура называется температурой кипения вещества. Испарение и кипение — это два способа перехода жидкости в газообразное состояние.
Испарение происходит с поверхности жидкости, а при кипении жидкость переходит в газообразное состояние, как с поверхности, так и внутри неё.
Когда говорят о веществах в газообразном состоянии, иногда помимо термина газ используется и слово пар. Газ и пар очень похожи между собой. Они представляют собой разновидности газообразного состояния вещества. Разница между газом и паром в том, что газ имеет температуру выше критической или равную ей, а пар — ниже.
В быту под словом пар обычно подразумевают именно водяной пар.
Переход вещества из жидкого состояния в твёрдое называется кристаллизацией. Переход вещества из твёрдого состояния в жидкое называется плавлением.
Переход вещества из твёрдого состояния сразу в газообразное называется возгонкой или сублимацией. Переход из газообразного состояния в твёрдое называется десублимацией.
При всех этих явлениях частицы вещества не разрушаются. Таким образом, вещество, изменяя агрегатное состояние, не превращается в другое вещество.
Одни вещества могут иметь любое из трёх агрегатных состояний, другие — нет.
Взаимные переходы веществ из одного агрегатного состояния в другое в виде схемы:
| | |
Газообразное
|
Жидкое
|
Твердое
|
1. Способность принимать объем и форму сосуда.
2. Сжимаемость.
3. Быстрая диффузия (хаотичное движение молекул).
4. Екинетич. > Епотенц.
|
1. Способность принимать форму той части сосуда, которую занимает вещество.
2. Неспособность расширяться до заполнения сосуда.
3. Незначительная сжимаемость.
4. Медленная диффузия.
5. Текучесть.
6. Екинетич. = Епотенц.
|
1. Способность сохранять свойственную форму и объем.
2. Незначительная сжимаемость (под давлением).
3. Очень медленная диффузия за счет колебательных движений частиц.
4. Отсутствие текучести.
5. Екинетич. < Епотенц.
|
2
|
К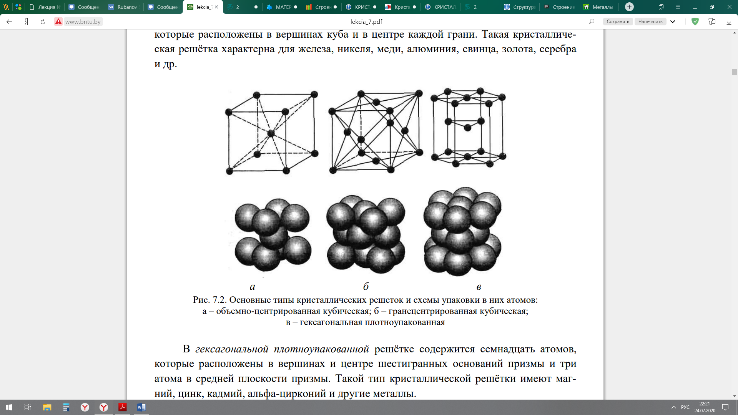 ристаллическая структура твердых металлов. Силовое взаимодействие и тепловое движение атомов. ристаллическая структура твердых металлов. Силовое взаимодействие и тепловое движение атомов.
|
Внутреннее строение металлов. Поскольку металлы в твердом состоянии в отличие от аморфных веществ имеют кристаллическое внутреннее строение, то образующие их элементарные частицы (атомы) в процессе кристаллизации из расплавленного (жидкого) состояния группируются в строго определенной последовательности. Для описания такого строения французским ученым О. Браве (Auguste Bravais) было введено понятие кристаллической (пространственной) решётки, т. е. математической системы точек в пространстве. Условно кристаллическая решётка представляет собой воображаемый элемент объёма, образованный минимальным количеством атомов, многократное повторение которого в пространстве позволяет построить весь кристалл. Всего существует 14 различных типов кристаллических решёток. Металлы преимущественно кристаллизуются в одном из трёх типов структур: объёмноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ). Для изображения кристаллической решётки пользуются упрощенными схемами (рис. 7.2). В объёмно-центрированной кубической решётке содержится девять атомов: восемь расположены в вершинах куба и один – в центре объёма. Такую решётку имеют молибден, вольфрам, ванадий и другие металлы.
В гранецентрированной кубической решётке находится четырнадцать атомов, которые расположены в вершинах куба и в центре каждой грани. Такая кристаллическая решётка характерна для железа, никеля, меди, алюминия, свинца, золота, серебра и .др. Рис. 7.2. Основные типы кристаллических решеток и схемы упаковки в них атомов: а – объемно-центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная плотноупакованная
В гексагональной плотноупакованной решётке содержится семнадцать атомов, которые расположены в вершинах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такой тип кристаллической решётки имеют магний, цинк, кадмий, альфа-цирконий и другие металлы. При этом линии на схемах и точечное расположение атомов в узлах кристаллической решётки являются условными. В действительности атомы имеют определенные размеры, колеблются с большой частотой в узлах решётки и могут соприкасаться друг с другом внешними слоями электронных оболочек. Основными параметрами кристаллической решётки являются период, коэффициент компактности, координационное число и базис. Полиморфные превращения в металлах. Сущность полиморфизма (от греч. рolymorphos – многообразный) состоит в том, что под влиянием определенных процессов (изменение температуры, давления) некоторые вещества, в том числе и ряд металлов, способны изменять свою кристаллическую решётку при сохранении химического состава, т. е. существовать в различных кристаллических формах. Это явление называется полиморфизм или аллотропия. С физической точки зрения превращение металла из одной формы в другую обусловливается внутренней перегруппировкой молекул, которая ведет к изменению его кристаллической структуры и свойств. При этом различ- 7 ные формы кристаллической решётки одного металла называют полиморфными модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определённого для данного металла интервала температур. Температура, при которой происходит превращение одной кристаллической модификации в другую, называется температурой полиморфного превращения. Полиморфизм (аллотропия) характерен для железа, олова, кобальта, титана и некоторых других металлов. Медь, алюминий не претерпевают полиморфных превращений. Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз. Например, кобальт при разных температурах может иметь гранецентрированную или гексагональную кристаллическую решётку, железо – объёмно-центрированную или гранецентрированную кубическую решётку. Полиморфные модификации обозначают строчными греческими буквами α, β, γ и т. д. Низкотемпературную модификацию железа называют α-, при более высокой – β-, затем γ-модификацией. Температуры перехода одной модификации железа в другую (911ºС и 1392ºС) называются критическими точками (табл. 7.2). При этом углерод и другие компоненты и примеси меняют положение критических точек на температурной шкале. В результате полиморфного превращения образуются новые кристаллические зерна, имеющие другой размер и форму. Поэтому такое превращение называют ещё перекристаллизацией, и сопровождается оно скачкообразным изменением всех свойств металлов и сплавов: плотности, теплоемкости, тепло- и электропроводности, прочности и др. На практике полиморфизм используется в технологическом процессе при термической обработке металлов.
Теплово́е движе́ние — процесс хаотичного (беспорядочного) движения частиц, образующих вещество. Чем выше температура, тем больше скорость движения частиц. Чаще всего рассматривается тепловое движение атомов и молекул.Характерная скорость теплового движения частицы может быть выведена из распределения Максвелла.
Хаотичность — важнейшая черта теплового движения. Важнейшими доказательствами существования движения молекул является Броуновское движение и диффузия.
|
3
|
Межатомные силы связи: ионные, ковалентные, металлические, молекулярные. Их природа и влияние на свойства материалов, используемых при сварке.
|
Между атомами в твердых телах действуют силы притяжения и отталкивания. Первые удерживают атомы вместе, при этом образуется целостный материал, вторые не дают атомам слиться. Твердые вещества существуют при равновесии сил притяжения и отталкивания.
Природа сил отталкивания одинакова во всех твердых веществах. Силы отталкивания возникают, когда атомы достаточно сближаются, так, что орбиты их внешних электронов перекрываются. При этом положительные заряды ядер атомов уже не полностью экранируются, вследствие чего между ними возникают силы отталкивания.
В отличие от сил отталкивания, имеющих одинаковую природу, природа сил притяжения различна и именно она определяет свойства материала. Различают четыре вида связи: ионную, ковалентную, металлическую и связь Ван–дер–Ваальса.
Ионная связь. Ионная связь присуща соединениям, образованным разнородными атомами. Внешние электроны атомов одного элемента переходят на внешние орбиты атомов другого элемента, образуя устойчивые электронные конфигурации.
В качестве типичного примера вещества с ионным типом связи можно привести поваренную соль –  . Натрий принадлежит к первой группе периодической системы, на его внешней орбите находится один электрон. Хлор – элемент седьмой группы, на его внешней орбите расположено семь электронов. Переход одного атома натрия на орбиту хлора приводит к образованию двух ионов, с устойчивой конфигурацией, обладающих разными зарядами. Межатомные силы притяжения – электростатические, ионная связь является сильной. . Натрий принадлежит к первой группе периодической системы, на его внешней орбите находится один электрон. Хлор – элемент седьмой группы, на его внешней орбите расположено семь электронов. Переход одного атома натрия на орбиту хлора приводит к образованию двух ионов, с устойчивой конфигурацией, обладающих разными зарядами. Межатомные силы притяжения – электростатические, ионная связь является сильной.
Твердое вещество с ионным типом связи образуется только в том случае, когда каждый положительный ион имеет своими ближайшими соседями только отрицательные ионы и наоборот. Таким образом, атомы в веществе располагаются строго упорядоченно.
Ионный тип связи характерен для химических соединений. Наиболее известным и широко распространенным материалом с ионным типом связи является стекло, основой которого являются окислы различных элементов.
Ковалентная связь. Ковалентная связь устанавливается в результате образования устойчивых соединений путем обобществления электронов определенными атомами. Примером такой связи может служить молекула газа, образованная двумя атомами, имеющими каждый по семь электронов на внешней орбите (например, хлор). Устойчивая конфигурация молекулы образуется в результате обобществления по одному электрону каждого из двух атомов. Образование устойчивых структур определяется правилом  , где N – число электронов на внешней орбите.(N<=4).Так, при образовании молекулы кислорода обобществляется два электрона, т.к. на его внешней орбите находится шесть электронов. , где N – число электронов на внешней орбите.(N<=4).Так, при образовании молекулы кислорода обобществляется два электрона, т.к. на его внешней орбите находится шесть электронов.
Ковалентная связь характерна для многих кристаллических твердых тел. Примером может служить алмаз – кристаллическая модификация углерода с ковалентной связью. Углерод имеет четыре валентных электрона. Образование алмаза осуществляется при обобществлении по одному электрону четырьмя атомами.
Механическая прочность ковалентной связи обычно достаточно велика вследствие ее направленного характера.
Ковалентные связи характерны для пластмасс.
Металлическая связь. Атомы металлов имеют небольшое количество (один или два) внешних (валентных) электронов, которые слабо связаны с ядром. При сближении атомов электроны, находящиеся на внешних оболочках, теряют связь со своими атомами, они коллективизируются, т.е. становятся достоянием всех атомов данного металла, образуя «электронный газ». Положительно заряженные ионы располагаются на таком расстоянии друг от друга, что силы притяжения между отрицательно заряженными электронами и положительно заряженными ионами уравновешиваются силами отталкивания между ионами.
Наличие электронного газа определяет свойства металла: высокие тепло– и электропроводность. Отсутствие сильных направленных связей между атомами определяет одно из важнейших свойств металлов – их пластичность, т.е. способность изменять форму без разрушения. Поэтому при изготовлении металлопродукции широко применяют методы пластического деформирования – ковка, прокат, волочение.
Силы Ван–дер–Ваальса. Происхождение этих сил связано с тем, что атомы являются малыми диполями. Среднее во времени пространственное распределение электронов в атоме симметрично относительно ядер, но в каждый конкретный момент центр отрицательных зарядов может не совпадать с ядром, имеющим положительный заряд, что и образует диполь. Взаимодействие диполей приводит к появлению сил притяжения. Это взаимодействие несколько усиливается вследствие того, что наличие диполя, образованного одним атомом, способствует появлению диполя у соседнего атома.
Силы Ван–дер–Ваальса существуют между всеми атомами. Они слабы и оказываются важными только при отсутствии более сильных связей других типов, рассмотренных выше. Эти силы являются основными при взаимодействии больших органических молекул, являющихся основой полимеров.
|
4
|
Физические процессы в дуговом разряде. Электрический разряд в газах.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
|
 Скачать 189.77 Kb.
Скачать 189.77 Kb.