Термохимический эффект химических реакций. Расчеты по ТХУ. Тепловой эффект химической реакции
 Скачать 202.1 Kb. Скачать 202.1 Kb.
|
|
Тепловой эффект химической реакции. В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела. Любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q). Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений: 2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж 2 H2(г) + O2(г) = 2 H2О(ж) + Q Это уравнение реакции называется термохимическим уравнением. Здесь символ "+Q" означает, что при сжигании водорода выделяется теплота. Эта теплота называется тепловым эффектом реакции. В термохимических уравнениях часто указывают агрегатные состояния веществ. Реакции протекающие с выделением энергии называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского "экзо" – наружу). Например, горение метана: CH4 + 2O2 = CO2 + 2H2O + Q Реакции протекающие с поглощением энергии называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании. C + H2O = CO + H2 – Q Тепловые эффекты химических реакций нужны для многих технических расчетов. Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (рис. 1).   Рис 1. Самая мощная в мире российская ракета "Энергия" перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах - водороде и кислороде. Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя? Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект - это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу. В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии. Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей - спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы - калории (1 кал = 4,1868 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: "калорийность 320 ккал/100 г". Расчёты по термохимическим уравнениям (ТХУ) Алгоритм 1 - Расчёты по термохимическим уравнениям (ТХУ) Задача 1. По термохимическому уравнению 2Cu + O2 = 2CuO + 310 кДж вычислите количество теплоты, выделившейся в результате окисления 4 моль меди. Алгоритм решения 1. Над формулами веществ надпишем сведения, взятые из условия задачи, а под формулой – соотношение, отображаемое уравнением реакции 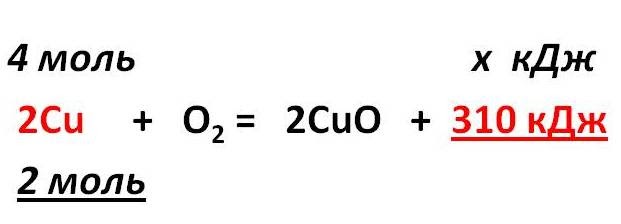 2. Находим выделившееся количество теплоты, решая пропорцию: 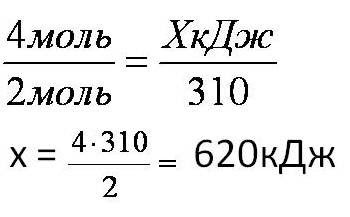 Ответ: Количество выделившейся теплоты 620 кДж. Алгоритм 2 - Расчёты по термохимическим уравнениям (ТХУ) Задача 2. По термохимическому уравнению С + O2 = CO2 + 412 кДж вычислите количество теплоты, выделившейся в результате окисления угля кислородом, объём которого равен 44,8л при н.у. Алгоритм решения 1. Вычислим количество вещества кислорода: 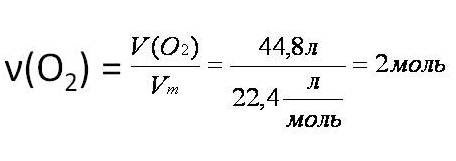 2. Над формулами веществ надпишем ν(О2) и х кДж, а под формулой – соотношение, отображаемое уравнением реакции 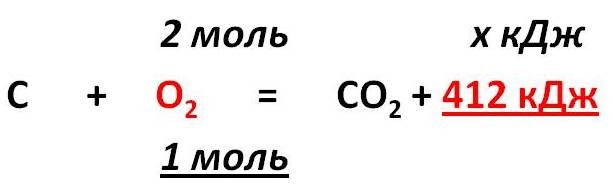 3. Находим выделившееся количество теплоты, решая пропорцию: 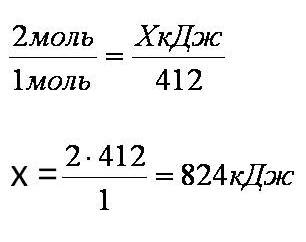 Ответ: Количество выделившейся теплоты 824 кДж. Алгоритм 3 - Расчёты по термохимическим уравнениям (ТХУ) Задача 3. При сжигании магния массой 3г выделяется 75,15кДж теплоты. Составьте термохимическое уравнение реакции горения магния. Алгоритм решения 1. Составим химическое уравнение реакции горения магния: 2Mg + O2 = 2MgO 2. Вычислим количество вещества магния: 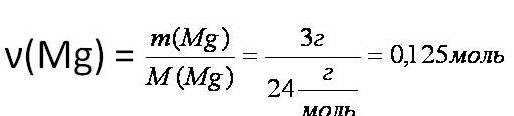 3. Над формулами веществ надпишем ν(Mg) и 75,15 кДж, а под формулой – соотношение, отображаемое уравнением реакции 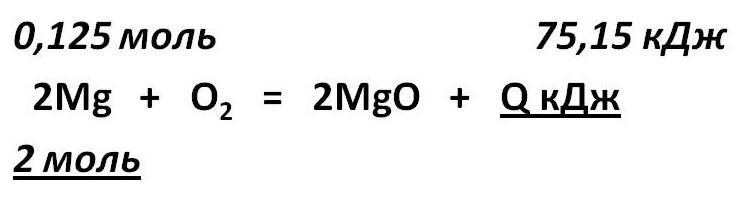 4. Решая пропорцию, находим тепловой эффект (Q = х) реакции: 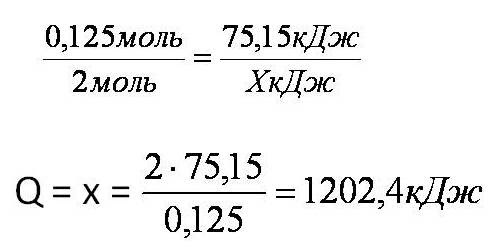 Ответ: термохимическое уравнение имеет вид: 2Mg + O2 = 2MgO + 1202,4кДж Алгоритм 4 - Расчёты по термохимическим уравнениям (ТХУ) Задача 4. По термохимическому уравнению: N2(г) + O2(г) = 2NO(г) – 180,7кДж, вычислите объём вступившего в реакцию азота при н.у., если при его окислении поглотилось 45,2 кДж теплоты. Алгоритм решения 1. Над формулами веществ надпишем сведения, взятые из условия задачи, а под формулой – соотношение, отображаемое уравнением реакции 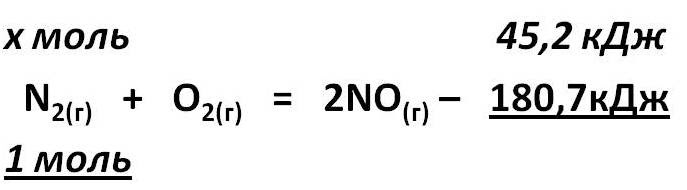 2. Вычислим количество вещества азота ν(N2) = х моль, решив пропорцию: 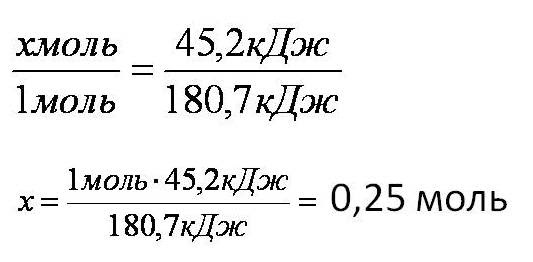 3. Вычислим объём азота по формуле: V = ν ∙ Vm V(N2) = 0,25 моль ∙ 22,4 л/моль = 5,6л Ответ: V(N2) = 5,6л. Ссылка на источник https://www.sites.google.com/ |
