Ответы на вопросы к вступительному экзамену по теме Термическая обработка. Термическая обработка. Термическая обработка
 Скачать 2.1 Mb. Скачать 2.1 Mb.
|
|
Диаграмма состояния – это графическое изображение состояния сплавов. Зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава, выбрать режимы литья, термической обработки и обработки давлением. Экспериментальное построение диаграмм состояния возможно благодаря тому, что любое фазовое превращение сплава отмечается изменением различных свойств (электросопротивления, удельного объёма и т.д.) либо тепловым эффектом. Диаграммы строят для равновесного состояния сплавов, которое соответствует минимальному значению свободной энергии системы. Такое состояние достигается при малых скоростях охлаждения или нагрева. Диаграммы состояния сплавов строят в координатах "концентрация компонентов – температура". Температуру откладывают по оси ординат, а концентрацию компонентов – по оси абсцисс. Причем слева направо увеличивается количество компонента В, а справа налево – компонента А. Таким образом, в начале координат находится чистый компонент А (абсцисса равна нулю – содержание компонента В = 0%); при значении абсциссы, равному 100%, имеем чистый компонент В. Общее содержание компонентов в сплаве равно 100%, каждая точка на оси абсцисс соответствует определенному содержанию обоих компонентов. При построении диаграмм состояния обычно используют метод термического анализа. Данный метод заключается в построении кривых охлаждения сплавов известного состава в координатах «температура – время», и по остановкам и перегибам на этих кривых, вызванными тепловым эффектом превращений, определяют критические точки сплава – температуры, при которых происходят структурные превращения в сплавах. Затем строят диаграммы состояния так, как было описано выше.  Диаграмма состояния для сплавов с неограниченной растворимостью компонентов в твердом состоянии  Рисунок 10. Диаграмма состояния для сплавов с неограниченной растворимостью компонентов и кривая охлаждения Компоненты: A и B. Фазы: жидкий раствор L и твердый раствор  . .Если два компонента неограниченно растворяются в жидком и твердом состояниях, то возможно существование только двух фаз – жидкого раствора L и твердого раствора  ; трёх фаз быть не может. Кристаллизация при постоянной температуре не наблюдается и горизонтальной линии на диаграмме нет. Верхняя линия – ликвидус, нижняя - солидус. Выше линии ликвидус все сплавы находятся в жидком состоянии, ниже солидуса – в твердом (кристаллическом). ; трёх фаз быть не может. Кристаллизация при постоянной температуре не наблюдается и горизонтальной линии на диаграмме нет. Верхняя линия – ликвидус, нижняя - солидус. Выше линии ликвидус все сплавы находятся в жидком состоянии, ниже солидуса – в твердом (кристаллическом).Описание кривой охлаждения: выше точки 1 сплав находится в жидком состоянии (жидкий раствор L). В точке 1 отмечается перегиб – начало кристаллизации, в точке 2 снова отмечается перегиб – окончание кристаллизации. Между точками 1 и 2 система состоит из жидкого расплава L и твёрдой фазы в виде кристаллов  . Ниже точки 2 происходит полное охлаждение сплава – твёрдого раствора . Ниже точки 2 происходит полное охлаждение сплава – твёрдого раствора  . .Диаграмма состояния сплава с ограниченной растворимостью компонентов в твердом состоянии и наличием эвтектического превращения  Рисунок 11. Диаграмма состояния сплава с ограниченной растворимостью и наличием эвтектики и кривая охлаждения для сплава состава 20%B и 80%A Компоненты: A, B. Фазы: жидкий раствор L и твердые растворы  и и 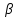 . .В сплавах такого рода возможно существование жидкой фазы L, твердого раствора компонента В в компоненте А - α- твердый раствор и твердого раствора компонента А в компоненте В – β-твердый раствор. В таких сплавах возможно нонвариантное равновесие при одновременном существовании трех фаз: L, α., β. В этой системе не образуются фазы, представляющие собой чистые компоненты. Из жидкости могут выделяться только твердые растворы α и β. Около вертикалей А и В находятся области существования твердых растворов α и β (области АDF и BEG). Предельная растворимость компонента В в компоненте А определяется линией DF, а предельная растворимость А в В – линий EG. Сплавы, находящиеся между этими двумя линиями, находятся за пределами растворимости и являются двухфазными, состоящими из фаз α и β. Линия АСВ является на этой диаграмме линией ликвидуса, АDСЕВ – солидуса. Линия DСЕ – линия эвтектических превращений, С – тройная точка. Тройная точка – точка на фазовой диаграмме, где сходятся три линии фазовых переходов. Эвтектическая точка – нонвариантная (при постоянном давлении) точка в системе из n компонентов, в которой находятся в термодинамическом равновесии n твёрдых фаз и жидкая фаза. Жидкая эвтектика представляет собой раствор или расплав, кристаллизующийся при температуре более низкой, чем температура кристаллизации каждого из веществ, входящих в состав смеси. Соответственно, температура плавления твёрдой эвтектики — самая низкая для данной смеси компонентов. Это явление как раз и отражает этимология термина. Описание кривой охлаждения: выше точки 1 сплав находится в жидком состоянии. В точке 1 начинается выделение кристаллов твердого раствора α. В точке 2 кристаллизация заканчивается. Эти кристаллы не претерпевают изменений до точки 3, т.е. наблюдается простое охлаждение сплава. Ниже точки 3 твердый раствор α является пересыщенным и из него начинают выделяться избыточные кристаллы – βII -твердого раствора, которые называются вторичными. Вторичными они называются потому, что процесс кристаллизации протекает в твердой фазе. Кристаллизацию из жидкой фазы называют первичной, соответственно кристаллы - первичные. Линия ЕG, в отличие от линии DF, изображена вертикальной, т.е. растворимость А в В не зависит от температуры. Поэтому вторичных αII- кристаллов нет. Диаграмма состояния сплава с ограниченной растворимостью компонентов в твердом состоянии и перитектикой Компоненты: A и B. Фазы: L,  , β. , β.В сплавах такого рода возможно существование: жидкой фазы L, твердого раствора компонента B в компоненте A – α-твердый раствор, твердого раствора компонента A в компоненте B – β-твердый раствор. При эвтектическом превращении жидкость кристаллизуется с образованием двух твердых фаз. Возможен и другой тип нонвариантного превращения (трехфазного равновесия), когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов L+ β→ α. Реакция подобного типа называется перитектической. Диаграмма с перитектическим превращением показана на рисунке 12. На диаграмме показаны три однофазные области: жидкость L и ограниченные твердые растворы α и β. Линия ABC является линией ликвидус, линия APDB— линией солидус.  Рисунок 12. Диаграмма состояния сплава с ограниченной растворимостью компонентов в твердом состоянии и перитектическим превращением  Рисунок 13. Кривые охлаждения Описание кривой охлаждения I: кристаллизация начинается в точке 1, когда из жидкости выпадают кристаллы β-раствора состава точки b. Затем по мере снижения температуры жидкость меняют свою концентрацию по линии ликвидус от точки 1 до точки G, а кристаллы β – по линии солидус от точки b до точки D. По достижении перитектической горизонтали CPD состав жидкости будет отвечать точке C, а состав кристаллов – точке D. Эти обе фазы реагируют и дают третью фазу α, концентрация которой определяется точкой P – третьей точкой на горизонтали. Количественное соотношение фаз при перитектической реакции, необходимое для образования α-фазы, определяется по правилу отрезков соотношением: Количество β = CP Количество L=PD В рассматриваемом же сплаве количество участвующих в перитектической реакции кристаллов β и жидкости определяется соотношением: Количество β = C2 Количество L= 2D т. е. в данном сплаве имеется избыток β-фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов. Поэтому по окончании реакции в избытке остаются β-кристаллы. Следовательно, в структуре будут продукты перитектической реакции (т. е. α-кристаллы) и оставшиеся избыточные первичные β-кристаллы. Чем ближе точка 2 лежит к точке P, тем меньше в реакции остается избыточных β-кристаллов. Для сплава, отвечающего по концентрации точке Р, соотношение реагирующих при перитектическом превращении жидкости и β-кристаллов таково, что оно как раз достаточно для образования α-кристаллов предельной концентрации. На рис. а показана кривая охлаждения сплава I. Для перитектической кристаллизации (средняя схема) характерно то, что новая α-фаза появляется на границе реагирующей друг с другом жидкости и β-кристаллов. Для сплава I перитектической реакцией заканчивается процесс кристаллизации. Описание для кривой охлаждения II. Отличие кристаллизации этого сплава от кристаллизации сплава I состоит в том, что при перитектической температуре имеется избыток жидкой фазы по сравнению с тем количеством, которое необходимо для образования α-кристаллов концентрации Р. Поэтому перитектическое превращение заканчивается исчерпанием β-твердого раствора, и оставшаяся жидкость в интервале между точками 2'— 3 кристаллизуется в α-фазу. При этом концентрация жидкости изменяется по кривой С—а, а концентрация образующихся α-кристаллов — по Ρ — 3 . Диаграмма состояния сплава с отсутствием растворимости в твердом состоянии и наличием эвтектического превращения  Рисунок 14. Диаграмма состояния сплава с отсутствием растворимости в твердом состоянии и наличием эвтектического превращения Компоненты: A, B. Фазы: жидкий раствор L, кристаллы A и кристаллы B (максимальное значение фаз – 3). АСВ – ликвидус. DСЕ – солидус. При охлаждении по АС начинают выделяться кристаллы А, по СВ – кристаллы В. На линии DСЕ из жидкости концентрации С одновременно выделяются кристаллы А и В, образуя эвтектику. DСЕ – линия эвтектических превращений. Ниже линии АС область двухфазная. Здесь существуют одновременно жидкий раствор L и твердая фаза – кристаллы А.  Рисунок 15. Кривая охлаждения Описание кривой охлаждения: в точке 1 – начало кристаллизации сплава I. На кривой охлаждения наблюдается перегиб. В процессе кристаллизации состав жидкости будет меняться по линии АС. В точке 2 жидкость будет иметь концентрацию точки С. При этой температуре из жидкости одновременно выделяются кристаллы А и В, образуя механическую смесь – эвтектику (А+В), т.е. образуются двухфазные кристаллы. Этот процесс изотермический и происходит по линии DСЕ, которая называется линией эвтектических превращений. С – тройная точка: при данной температуре и данном составе в системе существует 3 фазы: L, А, В. Сплав 1 – доэвтектический. Структура: А + эвтектика (А+В) Сплав 2 – эвтектический. Структура: эвтектика (А+В) Сплав 3 – заэвтектический. Структура В + эвтектика (А + В). Диаграмма состояния для сплавов с промежуточной фазой  Рисунок 16. Диаграмма состояния сплава с промежуточной фазы Компоненты: A, B. Фазы: жидкая фаза L, кристаллы A, кристаллы B, кристаллы AmBn. Точки: А′ – температура плавления и кристаллизации компонента А; В′ – температура плавления и кристаллизации компонента В; С′ – температура плавления и кристаллизации химического соединения АmBn ; Е1 и Е2– точки эвтектики. Линии: А′Е1С′Е2В′ – ликвидус; А′D Е1F и G Е2K В′ – солидус (не касается осей температур и разрывается на ординате химического соединения). Линии DЕ1F и GЕ2K в то же время являются и эвтектическими линиями. Эвтектические равновесия для даннойсистемы представляет собой равновесие жидкости эвтектического состава LE1 с кристаллами (А) и АmBn при температуре t E1: LE1 и равновесие жидкости эвтектического состава LE2 с кристаллами (В) и АmBn при температуре t E2: LE2 Диаграмма состояния сплавов с полиморфным превращением компонентов и эвтектоидным превращением  Рисунок 17. Диаграмма состояния сплавов с полиморфным превращениями компонентов и эвтектоидным превращением Из анализа диаграммы, представленной на рисунке 17, можно заключить, что после кристаллизации всех сплавов данной системы в определенном интервале температур образуется твердый раствор 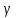 , который при понижении температуры ниже tЭ, испытывает эвтектоидное превращение: , который при понижении температуры ниже tЭ, испытывает эвтектоидное превращение:  . Образовавшуюся смесь двух твердых фаз принято называть эвтектоидом. В связи с переменной растворимостью компонентов в твердых растворах α и β при дальнейшем охлаждении следуют вторичные выделения твердых растворов. Наблюдаемые в микроскоп вторичные выделения . Образовавшуюся смесь двух твердых фаз принято называть эвтектоидом. В связи с переменной растворимостью компонентов в твердых растворах α и β при дальнейшем охлаждении следуют вторичные выделения твердых растворов. Наблюдаемые в микроскоп вторичные выделения  и и 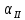 показаны на структурной схеме сплавов, приведенной под диаграммой на рисунке 17. показаны на структурной схеме сплавов, приведенной под диаграммой на рисунке 17. Правило отрезков. Пользуясь диаграммой состояния, можно для любой температуры определить не только число фаз, но и их состав, а также количественное соотношение по правилу отрезков. Применять его можно для двухфазных областей диаграмм. Определение состава фаз  Предположим, что нам нужно определить состав фаз при разных температурах для сплава 1 (сплошная вертикальная линия), который при комнатной температуре состоит из 70% В и 30% А, на пример в точке n. Проведем через точку n – горизонтальную линию –коноду, до пересечения с линиями диаграммы. Точки пересечения l и s проектируем на ось концентраций. Проекция точки l – покажет состав жидкой фазы, проекция т. s – состав твердой фазы. В данном случае при температуре t – состав жидкой фазы: 30% В и 70% А, состав твердой фазы: 90% В, 10% А. Определение количественного соотношения фаз Для определения количественного соотношения фаз, так же проводят коноду. Правило: количество (масса) фаз обратно пропорционально отрезкам проведенной коноды. Если принять, что отрезок ls – количество всего сплава, то отрезок ln соответствует количеству выпавших кристаллов α, а ns – количеству жидкой фазы. Для определения относительного количества фаз пользуются отношениями: Ж/С = ns/ ls Т/С= ln/ ls где Ж – количество жидкой фазы, С - количество всего сплава, Т – количество твердой фазы. Если массу всего сплава (C) принять за 100%, то получим: Ж = ns/ ls · 100% Т = ln/ ls · 100% Из диаграммы находим: ls = 60 единиц, ln = 40 ед., ns = 20 ед. Ж = 20/60 * 100% = 33% Т = 40/60 ·100% = 67% Вопрос 5. Особенности процесса затвердевания в неравновесных условиях. Ликвация в сплавах. Внутрикристаллическая ликвация (ВКЛ). Коэффициент ликвации. Влияние ликвации на структуру и свойства. Факторы, влияющие на развитие ВКЛ. Ее устранение путем термической обработки. Зональная ликвация, прямая и обратная. Ликвация по удельному весу и вследствие расслоения. Меры борьбы. Диаграмма состояния характеризует равновесное состояние сплава, т.е. они описывают структуры сплавов и процессы превращения в сплавах в условиях очень малых скоростей нагревания и охлаждения, при которых успевает пройти диффузия, позволяющая выровнять переменный состав кристаллов твердой фазы, обусловленный различием в температурах затвердевания. В реальных условиях нагрева и охлаждения диффузия проходить не успевает. В этом случае структура сплавов будет отличаться от равновесной, а состав в пределах каждого кристалла и тем более в разных кристаллах будет различаться и тем сильнее, чем более значительно реальные условия нагрева и охлаждения отличаются от равновесного состояния. На диаграммах состояния это обстоятельство находит отражение в появлении дополнительных линий, характеризующих неравновесные условия кристаллизации. В условиях неравновесной кристаллизации сплавы затвердевают ниже равновесной температуры затвердевания. Ликвация – это химическая неоднородность, возникающая в сплаве в процессе (неравновесной) кристаллизации. Ликвация, проявляющаяся в объеме отдельных зерен (кристаллитов, дендритов), называется внутрикристаллической (ВКЛ) или дендритной ликвацией. Если химическая неоднородность наблюдается в объеме всего слитка или отливки, то такая ликвация называется зональной ликвацией. Ликвация любого вида является нежелательным процессом, т. к. ухудшает многие свойства (механические, коррозионную стойкость и др.) сплава как в состоянии полуфабриката, так и в готовом изделии. |
