тесты. Тесты по неорганической химии. Тест по теме Первоначальные химические понятия
 Скачать 1.09 Mb. Скачать 1.09 Mb.
|
Вариант 21. Электронная формула внешнего энергетического уровня атома элемента, имеющего формулы газообразного водородного соединения RH3 и высшего оксида R2O5 (n — номер внешнего энергетического уровня) 1) ns2np5 2) ns2np3 3) ns2np1 4) ns2np2 2. Химическая связь в РН3 и CaCl2 соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная полярная и металлическая 4) ковалентная неполярная и ионная 3. В ряду химических элементов Li — Na — К — Rb металлические свойства 1) усиливаются 2) не изменяются 3) ослабевают 4) изменяются периодически 4. Уксусная кислота и гидроксид натрия относятся к классам 1) минеральных кислот и оснований 2) карбоновых кислот и оснований 3) минеральных кислот 4) карбоновых кислот и минеральных кислот 5. Взаимодействие этана и этилена с хлором относится к реакциям 1) обмена и замещения 2) присоединения и замещения 3) гидрирования и присоединения 4) замещения и присоединения Коэффициенты перед формулами восстановителя и окислителя в уравнении реакции, схема которой Р + КclO3 КС1 + P2O5, 1) 5 и 6 2) 6 и 5 3) 3 и 5 4) 5 и 3 7. Лампочка прибора для испытания веществ на электрическую проводимость загорится при погружении электродов в 1) водный раствор сахарозы и глицерин 2) водный раствор хлорида натрия и уксусную кислоту 3) ацетон и крахмальный клейстер 4) глицерин и гидроксид натрия (расплав) 8. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом железа (III) и серной кислотой равны 1) 16 и 22 2) 22 и 8 3) 28 и 18 4) 14 и 10 9. Сокращенное ионное уравнение реакции NH соответствует взаимодействию веществ 1) NH4C1 и Са(ОН)2 2) NH4C1 и Н2О 3)NH3 и Н2O 4)НN3 и НС1 10. Оксид алюминия не взаимодействует с 1) сульфатом магния 2) гидроксидом натрия 3) соляной кислотой 4) оксидом кальция 11. Укcуcный альдегид реагирует c 1) аммиачным раствором оксида серебра (I) и кислородом 2) гидроксидом меди (II) и оксидом кальция 3) соляной кислотой и серебром 4) гидроксидом натрия и водородом 12. При гидролизе клетчатки (крахмала) могут образовываться 1) глюкоза 2) только сахароза 3) только фруктоза 4) углекислый газ и вода 13. Формула вещества А в схеме превращений +Cl2 NaOH +A С2Н6 X1 X2 С2 Н5Ona 1) С2 Н5OH 2) NaOH 3) Na 4) Na2CO3 14. Качественный состав сульфата железа (III) можно установить, используя растворы, содержащие соответственно ионы 1) SO 15. Качественной реакцией на белок является его взаимодействие с 1) свежеосажденным гидроксидом меди (II) 2) сульфатом меди (II) 3) азотной кислотой 4) гидроксидом натрия 16. Растворение цинка в соляной кислоте будет замедляться при 1) увеличении концентрации кислоты 2) раздроблении цинка 3) разбавлении кислоты 4) повышении температуры 17. Химическое равновесие в системе СН4 (г) + H2O (г) ЗН2 (г) + СО – Qсмещается в сторону продуктов реакции при 1) повышении давления 2) повышении температуры 3) понижении температуры 4) использовании катализатора 18. Гидроксид железа (III) образуется при взаимодействии 1) оксида железа (III) с водой 2) оксида железа (II) с водой 3) хлорида железа (III) с гидроксидом натрия 4) хлорида железа (II) с гидроксидом натрия 19. Промышленный способ получения ацетилена отражает уравнение реакции 1) 2СН4 C2H2 + ЗН2 2) C4Н10 H2C = CH.—СН = СН2 + 2Н2 3) ЗС2Н2 C6H6 4) С2Н5ОН С2Н4+Н2О 20. Гомологами являются 1) пропандиол и этандиол 2) пропанол-1 и пропанол-2 3) глицерин и фенол 4) бутановая кислота и бутаналь 21. Изомерами являются 1) пентанол-1 и бутанол-2 2) изомасляная кислота и уксусная кислота 3) 2-метилпропанол-1 и 2-метилпропанол-2 4) бутаналь и пропаналь 22. Массовая доля (%) растворенного вещества в растворе, полученном при растворении 40г ацетата натрия в 200г воды, равна 1) 8,35 2) 10,0 3) 16,7 4) 20,0 23. Количество дибромэтана, образующегося при взаимодействии 1,12л (н. у.) этилена с 12г брома, равно 1) 0,025 моль 2) 0,05 моль 3) 0,075 моль 4) 0,1 моль 24. Объем (н.у.) оксида серы (IV), который можно получить при обжиге 3т FeS2 (Mг = 120) с выходом 95%, равен 1)532м3 2) 1179м3 3) 1064м3 4) 1120м3 Вариант 3 1. Электронная формула атома 1s22s22p3. Формулы водородного соединения и высшего оксида этого элемента 1) H2S и SO3 2) NH3 и N2O5 3) РНз и P2O5 4) СН4 и CO2 2. Формулы соединений с ионной и ковалентной полярной связью соответственно 1) РНз и СhзОН 2) СаВг2 и СН4 3) F2 и НСНО 4) Р2O5 и НСООН 3. Неметаллические свойства элементов в ряду Si Р S С1 1) не изменяются 2) усиливаются 3) ослабевают 4) изменяются периодически 4. Амфотерными соединениями являются 1) этиламин и серная кислота 2) этанол и нашатырный спирт 3) уксусная кислота и гидроксид кальция 4) аминоуксусная кислота и гидрока алюминия 5. Реакция, уравнение которой 2СНзСООН + 2Na 2CH3COONa + H2 относится к реакциям 1) присоединения, эндотермическим 2) разложения, экзотермическим 3) замещения, экзотермическим 4) обмена, эндотермическим 6. Коэффициент перед формулой восстановителя в уравнении реакции, схема которой Mg + HNO3 N2O + Mg(NO3)2 + H2O, равен 1) 3 2) 4 3) 5 4) 6 7. Слабыми электролитами являются водные растворы 1) хлорида натрия и этанола 2) уксусной кислоты и сероводорода 3) нитрата кальция и уксусной кислоты 4) хлорида кальция и метанола 8. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом бария и серной кислотой равны 1) 9 и 3 2) 10 и 3 3)12 и 6 4) 9 и 9 9. Сокращенное ионное уравнение реакции Al3+ + ЗОН- = А1(ОН)з соответствует взаимодействию 1) хлорида алюминия с водой 2) алюминия с водой 3) хлорида алюминия со щелочью 4) алюминия со щелочью 10. Гидроксид меди (II) реагирует с обоими веществами 1) серной и уксусной кислотами 2) оксидом железа (II) и гидроксидом натрия 3) хлоридом железа (III) и азотной кислотой 4) гидроксидом алюминия и оксидом алюминия 11. Этанол реагирует с обоими веществами 1) метанолом и этиленом 2) кислородом и уксусной кислотой 3) гидроксидом меди (II) и кислородом 4) формальдегидом и водородом 12. Среда раствора в результате гидролиза карбоната натрия 1) щелочная 2) сильно кислая 3) кислая 4) нейтральная 13. Вещество А в схеме превращений t +Н2О +О +Cl2 СН4 X1 X2 Х3 А 1) уксусная кислота 2) аминоуксусная кислота 3) хлоруксусная кислота 4)анилин 14. Качественный состав хлорида железа (III) можно установить, используя растворы, содержащие ионы 1) CNS- и Ag+ 1) ОН- и Ва2+ 3) ОН- и H+ 4) CNS- и Ва2+ 15. Анилин можно обнаружить с помощью раствора 1) хлорной извести 2) хлорида железа (III) 3) гидроксида кальция 4) гидроксида натрия 16. С наибольшей скоростью при комнатной температуре протекает реакция 1) C2H5OH с Na N2 c H2 3) Zn с Н2 SO4 (р-р) 4) CuSO4 (р-р) с NaOH (p-p) 17. Химическое равновесие в системе 2NO + O2 2NO2 + О смещается в сторону продукта реакции при 1) повышении давления 2) повышении температуры 3) понижении давления 4) использовании катализатора . 18. Хлорид меди (II) можно получить, используя реакцию между 1) медью и соляной кислотой 2) сульфатом меди (II) и хлором 3) гидроксидом меди (II) и хлоридом натрия 4) сульфатом меди (II) и хлоридом бария 19. Аммиак в промышленности получают по реакции 1) NH4C1 = NH3 + НС1 2) NH4C1 + NaOH = NH3 + NaCI 3) N2 + 3H2 2NН3 4) 4Mg + 10HNO3 (p-p) = NH4NO3 + 4Mg(NO3)2 + ЗН2О 20. Гомологом ацетилена является 1) 2-метилпропен-1 2) пропадиен 3) 4-метилпентин-1 4) бутадиен 21. Число изомеров среди веществ, формулы которых а) СНз—(СН2)2—O—СН2—СН3, б) НООС—(СН2)3—СНз, в) C2H5—COO—C2H5, г) СН3—(СН2)3—СНО, равно 1) 1 2) 2 3) 3 4) 4 22 .Объем (н. у.) пропилена, необходимый для обесцвечивания 200 г 2%-ного раствора бромной воды, равен 1) 0,28л 2) 0,56л 3) 2,8л 4) 5,6л 23. При пропускании 11,2л (н.у.) аммиака через раствор, содержащий 1 моль азотной кислоты, образуется количество вещества нитрата аммония 1) 0,5 моль 2) 0,75 моль 3) 1,0 моль 4) 1,5 моль 24. Масса серы, которая потребуется для производства 140т серной кислоты с выходом 95,2%, равна 1) 43,5т 2) 45,7т 3) 48,0т 4) 133,3т Вариант 4 1. Электронная формула атома наиболее активного металла 1) 1s22s22p63s23p64s2 2) 1s22s22p63s23p63d104s24p65s2 3) 1s22s22p63s2 4) 1s22s22p63s23p63d104s2 2. Химическая связь в молекулах метана и хлорида кальция соответственно 1) ионная и ковалентная полярная 2) ковалентная полярная и ионная 3) ковалентная неполярная и ионная 4) водородная и ионная 3. Неметаллы, расположенные в порядке усиления их неметалличности, — это 1) азот, углерод, бор 2) сера, хлор, фтор 3) фтор, кислород, хлор 4) бор, кремний, водород 4. Высшие оксиды элементов бериллия, углерода и азота соответственно относятся к оксидам 1) основным, амфотерным и кислотным 2) только кислотным 3) амфотерным, кислотным и кислотным 4) основным, кислотным и амфотерным 5 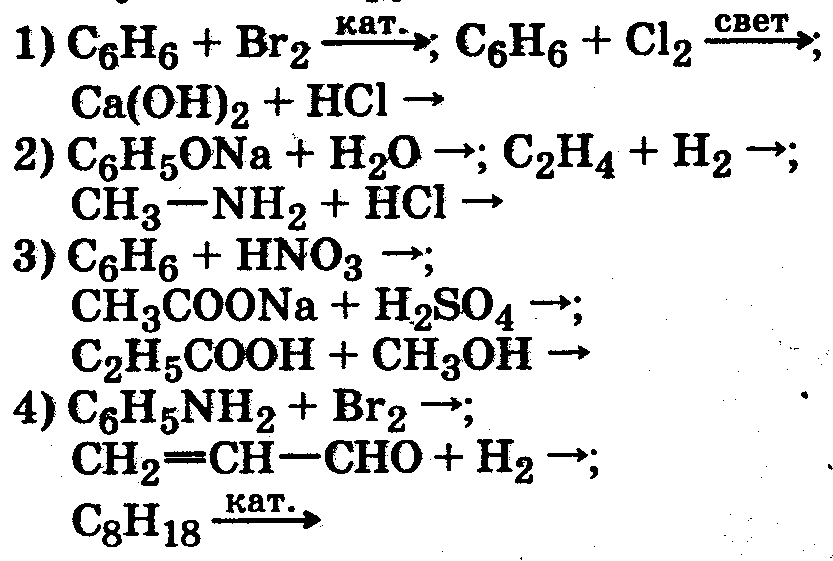 . Реакции замещения, присоединения, обмена соответственно указаны в группе 1) 1 2) 2 3) 3 4) 4 6. В уравнении реакции, схема которой Р + HNO3 + Н2О Н3РO4 + NO, коэффициент перед формулой восстановителя равен 1) 2 2) 3 3) 4 4) 5 7. Не проводят электрический ток оба вещества 1) серная кислота (води. Р-р) и уксусная кислота (водн. Р-р) 2) гидроксид натрия (водн. Р-р) и карбонат кальция 3) кислород (ж) и этанол 4) соляная кислота и бензол 8. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между карбонатом натрия и уксусной кислотой (с образованием углекислого газа) равны 1) 11 и 6 2) 10 и 6 3) 11 и 7 4) 10 и 7 9. Сокращенное ионное уравнение реакции Ва2+ + SO 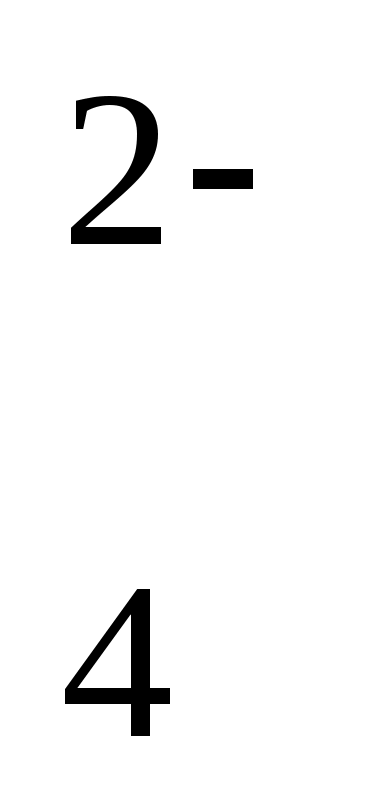 = BaSO4 соответствует взаимодействию веществ = BaSO4 соответствует взаимодействию веществ1) ВаО и H2SO4 2) Ва и H2SO4 3) ВаСОз и K2SO4 4) Ва(NО3)2 и Na2SO4 10. Разбавленная азотная кислота реагирует с обоими веществами 1) медью и гидроксидом цинка 2) железом и оксидом углерода (IV) 3) гидроксидом натрия и нитратом серебра 4) хлоридом серебра и сульфатом бария 11. Одноатомные спирты не взаимодействуют с 1) уксусной кислотой 2) металлическим натрием 3) метаном 4) кислородом 12. При гидролизе метилового эфира пронионовой кислоты образуются продукты 1) СнзОН и СНз—СН2—СООН ; 2) СНз—СН2ОН и СНз—СН2—СООН 3) СнзОН и СНз—СН2 —СН2 —СООН 4) СНз—СН2 —СН2ОН и СHз—CH2 —COOH 13. Вещество А в схеме превращений +Н2О +Н2О +О +CH3OH СaC2 X1 X2 Х3 А 1) диметиловый эфир ; 2) метилацетат ; 3) метилформиат ; 4) этилацетат 14. Качественный состав хлорида бария можно установить, используя растворы, содержащие соответственно ионы 1) SO 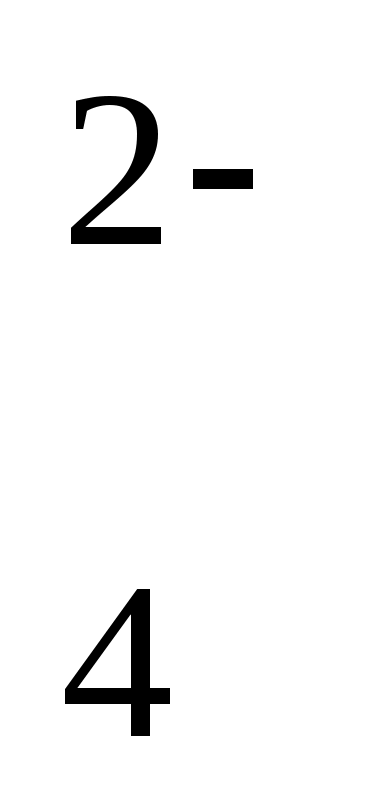 и Ca2+ ; 2) SO и Ca2+ ; 2) SO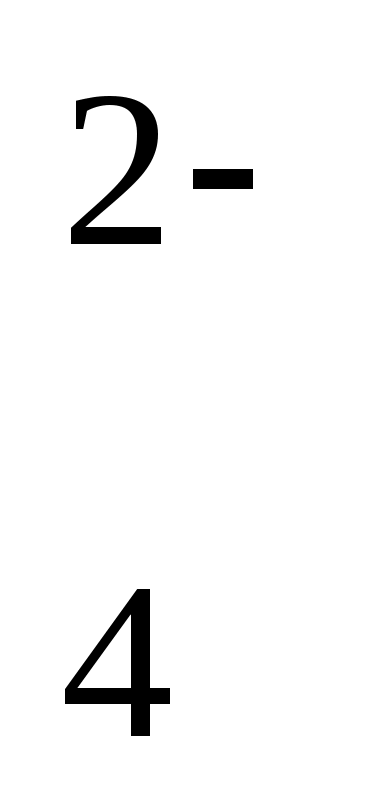 и Ag+ ; 3) ОН- и Ag+ ; 4) ОН- и H+ . и Ag+ ; 3) ОН- и Ag+ ; 4) ОН- и H+ .15. Альдегид можно распознать с помощью 1) оксида железа (II) ; 2) раствора хлорида железа (III) 3) аммиачного раствора оксида серебра (I) ; 4) раствора фенолфталеина 16. С наибольшей скоростью при комнатной температуре протекает реакция 1) этанола с кислородом; 2 ) железа с соляной кислотой 3) железа с концентрированной серной кислотой 4) раствора нитрата серебра с раствором хлорида цинка 17. Химическое равновесие в системе 2SO2 + O2 2Soз + Qсмещается в сторону продукта реакции при 1) понижении температуры ; 2) повышении температуры 3) понижении давления ; 4) использовании катализатора 18. Водород в лаборатории не получают 1) электролизом воды ; 2) взаимодействием кислот с металлами 3) разложением аммиака ; 4) взаимодействием воды с гидридами щелочных металлов 19. Природным сырьем для производства азотной кислоты служит 1) нитрат натрия ; 2) хлорид аммония ; 3) аммиак ; 4) воздух . 20. Гомологом 2-метилпентена -1 является 1) СНз—СH(СНз)—СН2 —СНз ; 2) СНз— (СН2)3 —СН СН2 3) СНз— (СН2) 4—СНз ; 4) СНз—СН2 —СН==СН—СН3 21. Изомерами являются 1) пропионовая кислота и 2-метилпропионовая кислота 2) метиловый эфир уксусной кислоты и пропионовая кислота 3) этанол и этаналь ; 4) пропан и бутан 22. Массовая доля (%) растворенного вещества в растворе, полученном при растворении 20 г сахаа в 140 г воды, равна 1) 6,25 2) 12,5 3)18,75 4)20,0 23. Масса соли, образовавшейся при пропускании 5,6л (н. у.) хлороводорода через раствор, содержащий 11,2г гидроксида калия, равна 1) 5,6г 2) 11,2г 3) 14,9г 4) 18,6г 24. Из 2,50г мрамора было получено 448мл (н.у.) углекислого газа. Массовая доля (% ) карбоната кальция в мраморе равна 1) 20 2) 80 3) 40 4) 60 Вариант 5 1.Символ и формула высшего оксида элемента, электронная формула внешнего и предвнешнего энергетических уровней атома которого 3s23p63d54s1, 1)Сr и СrОз ; 2) К и K2O ; 3) Мn и Мn2O7 ; 4) Se и SeO3 2. Вещества с ковалентной неполярной и ионной связью соответственно 1) азот и фторид калия ; 2) сероводород и метан ; 3) вода и ацетилен 4) сульфат бария и метанол 3. Наибольший радиус имеет атом элемента 1)кальция ; 2) стронция ; 3) бария ; 4) радия. 4.Группа ОН (гидроксил) является функциональной для всех классов веществ группы 1) кислоты, щелочи, фенолы ; 2) фенолы, нерастворимые основания, аминокислоты ; 3) основания, фенолы, спирты ; 4) спирты, амины, щелочи 5.Взаимодействие этилена с водой относится к реакциям 1) присоединения, окислительно-восстановительным ; 2) присоединения, гидратации ; 3) обмена, окислительно-восстановительным 4) обмена, гидратации 6. Не является окислительно-восстановительной реакция 1) Na2Соз + 2НС1 = = 2NaCl + H2O + СО2 ; 2) 2Н2 + O2 = 2Н2О 3) Zn + 2НС1 = ZnCl2 + H2 ; 4) HCHO + 2Cu(OH)2 НСООН + 2CuOH + H2O 7. В уравнении реакции алюминия с соляной кислотой сумма коэффициентов перед формулами неэлектролитов равна 1) 3 2) 4 3) 5 4) 6 8. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между гидроксидом натрия и сульфатом магния равны 1) 10 и 3 2) 12 и 6 3) 10 и 4 4) 12 и 4 9. Сокращенное ионное уравнение реакции 2H+ + СO  = СО2 + H2O соответствует взаимодействию = СО2 + H2O соответствует взаимодействию1) азотной кислоты с карбонатом кальция ; 2) сероводородной кислоты с карбонатом калия ; 3) соляной кислоты с карбонатом натрия 4) серной кислоты с оксидом углерода (IV) 10. Раствор гидроксида натрия реагирует с обоими веществами 1) оксидом кальция и соляной кислотой ; 2) хлоридом железа (III) и углекислым газом ; 3) серной кислотой и карбонатом кальция ; 4) оксидом цинка и хлоридом калия . 11. Конечными продуктами бромирования фенола являются 1) 2-бромфенол ; 2) 2,6-дибромфенол ;3) 2,4-дибромфенол ; 4) 2,4,6-трибромфенол 12. Гидролизу подвергается 1)СНзСООК; 2)КС1; 3) СаСОз ; 4)Na2SО4 . 13. Формулы веществ Х и Y в схеме превращений +C +Н2О +Y СaO X C2H2 C2H2Br2 1) X—Са(ОН)2; Y — Вr2 ; 2) Х — СаС2; Y — Br2 3) Х — Са(ОН)2; Y — НВr ; 4) Х — СаС2; Y — НВr 14. Сульфат-ионы можно обнаружить при помощи катиона 1) Ag+ ; 2) Cu2+ ; 3) Ba2+ ; 4) Feз+ 15. Реакция «серебряного зеркала» характерна для обоих веществ 1) глюкозы и глицерина ; 2) сахарозы и глицерина 3) глюкозы и формальдегида ; 4) сахарозы и формальдегида 16. С наименьшей скоростью ври комнатной температуре протекает реакция между 1) NaCl (1%-ный р-р) и AgNO3 (1%-ный р-р) ; 2) NaCl (1%-ный р-р) и AgNO3 (5%-ный р-р) ; 3) Fe и CuSO4 (1%-ный р-р); 4) NaCl (5%-ный р-р) и AgNO3 (5%-ный р-р) 17.Химическое равновесие в системе CO2 (г) + С (т) 2СО (г) – 173 кДж смещается в сторону продукта реакции при 1) повышении давления ; 2) повышении температуры 3) понижении температуры ; 4) использовании катализатора 18. Для получения углекислого газа в лаборатории обычно используют реакцию 1) термического разложения карбоната кальция ; 2) карбоната кальция с соляной кислотой ; 3) горения метана ; 4) горения этилового спирта 19. Этанол не получают 1) брожением сахарозы ; 2) гидратацией этилена 3) гидролизом древесины ; 4) разложением метана 20. Числю гомологов среди приведенных формул углеводородов а) СНз—СН2—СН2—СН3 б) СНз—СН2—СН2—СН2—СН3 в) СН2=СН—СН2—СН3 г) СНз—СН==СН—СНз 1) 1 2) 2 3)3 4) 4 21. Изомерами являются 1) формальдегид и муравьиная кислота ; 2) этанол и уксусная кислота 3) бензол и фенол ; 4) пентан и диметилпропан 22. Масса 3,2% -ного раствора брома в воде, который может вступить в реакцию с 112 мл (н. у.) ацетилена с образованием дибромэтена, равна 1) 0,8г 2) 25г 3) 1,6г 4) 60г 23. При сливании растворов, содержащих 84г карбоната натрия и 0,5 моль хлороводорода, объем (н. у.) выделившегося газа равен 1) 5,6л 2) 11,2л 3) 16,8л 4) 22,4л 24. Масса железа, которое можно получить из 1т красного железняка, содержащего 70% Fe2O3 (Мr = 160), равна 1) 245кг 2) 350кг 3) 490кг 4) 700кг Вариант 6 1. Электронная формула внешнего энергетического уровня атома элемента, имеющего формулы газообразного водородного соединения RH4 и высшего оксида RO2 (n — номер внешнего энергетического уровня), 1) ns2np5 ; 2) ns2np3 ; 3) ns2np4 ; 4) ns2np2 2. Виды химической связи в соединении HCOONa 1) ионная и ковалентная полярная ; 2) ионная и ковалентная неполярная 3) ковалентная неполярная и водородная ; 4) ковалентная полярная и водородная 3. Гидроксиды элементов Mg, A1 и Si относятся соответственно к классам 1) оснований, кислот и кислот ; 2) амфотерных гидроксидов, оснований и кислот 3) оснований, амфотерных гидроксидов и кислот ;4) амфотерных гидроксидов, кислот и оснований 4. Вещества с общей формулой R—C—O—R1 относятся к классу О 1)спиртов ; 2) альдегидов ; 3) простых эфиров ; 4) сложных эфиров. 5. Окислительно-восстановительная реакция осуществляется при взаимодействии веществ 1) фенола и гидроксида натрия ; 2) аммиака и кислорода 3) хлорида кальция и нитрата серебра ; 4) этанола и уксусной кислоты 6. В схеме реакции С + HNO3 NO2 + CO2 + Н2О коэффициент перед формулой восстановителя равен 1) 1 2) 2 3) 3 4) 4 7. В уравнении реакции оксида алюминия с серной кислотой сумма коэффициентов перед формулами сильных электролитов равна 1) 3 2) 4 3) 5 4) 6 8. Суммы всех коэффициентов в полном и сокращенном ионных уравнениях реакции между хлоридом бария и сульфатом меди (II) равны 1) 7 и 7 2) 9 и 3 3)12 и 6 4) 9 и 7 9. Сокращенное ионное уравнение реакции SiO  + 2H+ = H2SiO3 соответствует взаимодействию + 2H+ = H2SiO3 соответствует взаимодействию1) оксида кремния (IV) с водой ; 2) оксида кремния (IV) с серной кислотой 3) силиката натрия с серной кислотой ; 4) силиката кальция серной кислотой |
