тесты. Тесты по неорганической химии. Тест по теме Первоначальные химические понятия
 Скачать 1.09 Mb. Скачать 1.09 Mb.
|
10. С раствором серной кислоты взаимодействуют все вещества группы1) хлорид бария, оксид меди (II) и оксид углерода (IV) ; 2) карбонат натрия, магний и хлорид бария; 3) хлорид натрия, хлорид бария и фосфорная кислота; 4) медь, гидроксид калия и хлорид серебра. 11. При взаимодействии пропилена с бромом получается 1) 1-бромпропан ; 2) 2-бромпропан ;3) 1,2-дибромпропан ;4) 2,2-дибромпропан 12 . При гидролизе жиров образуются 1) спирты и минеральные кислоты ; 2) альдегиды и карбоновые кислоты; 3) одноатомные спирты и карбоновые кислоты ; 4) глицерин и карбоновые кислоты. 13. В схеме превращений +Н2О +H2 +Na С2H2 X Y C2H5 ONa формулы веществ Х и Y 1) X — C2H5OH; Y — СНзСООН; 2) X — СНзСНО; Y — C2H5OH 3) X — СНзСООН; Y — C2H5OH; 4) X — СНзСНО; Y — СНзСООН 14.Карбонат-ионы можно обнаружить водным раствором хлороводорода; 2) гидроксида натрия 3) хлорида натрия; 4) сульфата аммония 15.Глицерин, уксусную кислоту и формалин можно распознать с помощью 1) азотной кислоты (конц.); 2) гидроксида меди (II) 3) бромной воды; 4) нагретой медной проволоки 16. С наибольшей скоростью при комнатной температуре протекает взаимодействие между 1) цинком и разбавленной серной кислотой ; 2) магнием и соляной кислотой 3) железом и кислородом ; 4) раствором карбоната натрия и соляной кислотой 17. Химическое равновесие в системе H2 (г) + Вr2 (г) 2НВr (г) + Qсмещается в сторону продукта реакции при 1) повышении давления; 2) понижении температуры 3) понижении давления; 4) использовании катализатора 18. В лаборатории кислород не получают из 1) жидкого воздуха ; 2) бертолетовой соли КClO3 ; 3) воды ; 4) перманганата калия КMnO4 19.Метанол в промышленности получают 1) взаимодействием СО и Н2 ; 2) взаимодействием CO2 и H2 ; 3) пиролизом метана ; 4) гидролизом глюкозы . 20.Гомологом этана является 1) С2Н4 2) С2Н6 3) С6Н6 4) С3Н8 21.Число изомеров вещества состава С4Н6, соответствующих классу алкинов, равно 1) 2 2) 3 3) 4 4) 5 22. Масса соли, которую необходимо растворить в 50г воды для приготовления 20% -ного раствора, равна 1) 10,0г 2) 12,5г 3) 20,0г 4) 25,0г 23. При сплавлении 10,8г алюминия с 22,4г серы образуется количество вещества сульфида алюминия AI2S3 1) 0,1 моль 2) 0,2 моль 3) 0,3 моль 4) 0,4 моль 24. При обжиге 1т известняка, содержащего 10% примесей, можно получить углекислый газ, объем (н.у.) которого приблизительно равен 1) 200м3 2) 200л 3) 224м3 4) 224л Вариант 7 1. Электронная формула атома наиболее активного металла 1) 1s2 2s2 2) 1s2 2s2 2p6 3s2 3p6 3d10 4s1 3) 1s2 2s2 2p6 3s1 4) 1s2 2s2 2p6 3s2 3p6 4s1 2. Химическая связь в хлориде натрия, азоте и метане соответственно 1) ковалентная неполярная, ионная и ковалентная полярная 2) ионная, ковалентная неполярная и ковалентная полярная 3) ковалентная полярная, ионная и ковалентная неполярная 4) ионная, ковалентная полярная и ковалентная неполярная 3. Неметаллические свойства элементов в периоде с увеличением заряда ядра атомов 1) усиливаются ; 2) изменяются периодически ; 3) ослабевают ;4) не изменяются 4. Карбоксильная группа имеется в молекулах 1) одноатомных спиртов ; 2) альдегидов; 3) многоатомных спиртов 4) карбоновых кислот 5. Взаимодействие гидроксида бария с серной кислотой является реакцией 1) присоединения ; 2)обмена ; 3) замещения ;4) гидратации 6. Коэффициент перед формулой восстановителя в уравнении реакции, схема которой S + HNO3 H2SО4 + NO2 + H2O, равен 1) 1 2) 2 3) 3 4) 4 7.Лампочка прибора для испытания веществ на электрическую проводимость не загорится при погружении электродов в 1) водный раствор сахарозы ; 2) водный раствор хлорида натрия 3) муравьиную кислоту (водв. Р-р) ;4) расплав гидроксида натрия 8. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между азотной кислотой и гидроксидом бария равна 1) 10 и 3 2) 12 и 3 3) 10 и 4 4) 12 и 4 9. Сокращенное ионное уравнение реакции Zn2+ + 2ОН- = Zn(OH)2 соответствует взаимодействию веществ 1) ZnSO4 (р-р) и Fе(ОН)з ; 2) ZnSO4 (р-р) и Ва(ОН)2 (р-р) 3) ZnCl2 (р-р) и NaOH (р-р) ; 4) ZnO и H2O 10. Азотная кислота не реагирует с l)FeO 2)СаСОз 3) SiO2 4) Сu 11.При нагревании спиртов в присутствии концентрированной серной кислоты можно получить 1) алкоголяты ; 2) простые эфиры ; 3) альдегиды ; 4) карбоновые кислоты 12. Гидролизу не подвергаются 1) сульфат железа (III) ; 2)спирты ; 3) хлорид аммония ; 4) сложные эфиры 13. Формула органического вещества А в схеме превращений +Cl2 +NaOH С2H6 X A 1) C2H5OH ; 2) C2H5Ona ; 3) C2H5Cl ; 4) С2Н6 14. Качественной реакцией на соли аммония является 1) действие щелочи ; 2) действие другой соли 3) действие кислоты ; 4) разложение нитратов 15. Реакция «серебряного зеркала» характерна для обоих веществ 1) уксусная кислота и ацетальдегид ; 2) муравьиная кислота и формальдегид 3) глюкоза и глицерин ; 4) сахароза и глицерин 16. С наибольшей скоростью при комнатной температуре протекает реакция 1) цинка с разбавленной серной кислотой ; 2) магния с соляной кислотой 3) железа с кислородом ; 4) карбоната натрия (р-р) с соляной кислотой 17. Химическое равновесие в системе 2NO (г) + О2 (г) 2NO2 (г) + Qможно сместить в сторону продукта реакции при 1) понижении температуры ; 2) повышении температуры ; 3) понижении давления ; 4) использовании катализатора 18. Ацетилен в лаборатории получают из 1) карбида кальция ; 2) карбоната кальция ; 3) углерода ; 4) гидроксида кальция 19. В промышленности уксусную кислоту получают 1) каталитическим окислением бутана 2) взаимодействием ацетата натрия с серной кислотой 3) гидролизом сложных эфиров 4) гидролизом простых эфиров 20. Гомологом СНз—СН2—СН2—СН = СН2 является 1) пентен-2 2) метилбутен-1 3) бутен-1 4) метилбутан 21. Формула изомера пропанола-1 1) СНз—СН2—СН = О 2) СНз—СН2 —О—СНз 3) СНз—СН2 —СН2ОН 4)CHз—CH = О 22. Масса щелочи, которую необходимо растворить в 50г воды для приготовления 10%-ного раствора, равна 1) 5,6г 2) 6,25г 3) 10,0г 4) 12,5г 23. Количество вещества нитрата бария, образовавшегося при сливании растворов, содержащих 3 моль азотной кислоты и 4 моль гидроксида бария, равно 1) 3 2) 7 3) 2,5 4) 4 24. В присутствии водоотнимающего средства из 92г этанола получили 33,6л (н.у.) этилена. Выход продукта в процентах от теоретически возможного составил 1) 50 2) 75 3) 85 4) 90 Вариант 8 1. Электронная формула атома 1s22s22p63s23p4. Формулы водородного соединения и высшего оксида этого элемента 1) Н2 S и SO2 ; 2) NH3 и N2O5 ; 3) Н2S и SO3 ; 4) СН4 и СО2 2. Вещество, между молекулами которого существует водородная связь, — это 1) этан ; 2) оксид углерода (II); 3) фторид натрия ; 4) этанол 3. Неметаллические свойства элементов в ряду йод — бром — хлор — фтор 1) не изменяются ; 2) усиливаются ; 3) ослабевают ; 4) изменяются периодически 4. Бутанол и гидроксид алюминия относятся соответственно к классам 1) спиртов и оснований ; 2) карбоновых кислот и оснований 3) спиртов и амфотерных гидроксидов ; 4) карбоновых кислот и амфотерных гидроксидов 5. Взаимодействие пропилена и метана с хлором относятся соответственно к реакциям 1) обмена и замещения ; 2) присоединения и замещения 3) обмена и присоединения ; 4) замещения и присоединения 6. Коэффициент перед формулой окислителя в уравнении реакции, схема которой S + HNO3 H2 SО4 + NО, равен 1) 1 2) 2 3) 3 4) 4 7. Слабым электролитом является гидроксид бария ; 2) хлорид кальция ; 3) соляная кислота ; 4) угольная кислота 8. Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между муравьиной кислотой и гидроксидом калия равна 1) 10 и 3 2) 6 и 4 3) 7 и 3 4) 12 и 4 9. Сокращенное ионное уравнение реакции 2H+ + СO 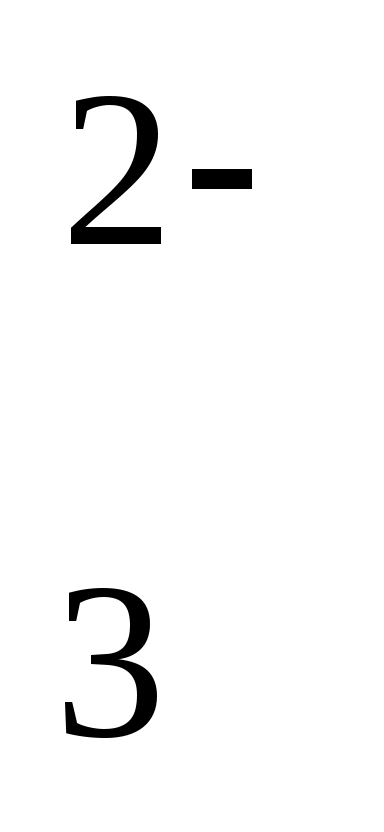 = CO2 + Н2О соответствует взаимодействию = CO2 + Н2О соответствует взаимодействию1) соляной кислоты с карбонатом магния 2) сероводородной кислоты с карбонатом калия 3) серной кислоты с карбонатом калия 4) азотной кислоты с оксидом углерода (IV) 10. Оксид серы (IV) реагирует с обоими веществами 1) железо и гидроксид ватрия 2) оксид кальция и оксид углерода (IV) 3) кислород и вода 4) хлорид натрия и оксид азота (V) 11. Сложный эфир можно получить при взаимодействии 1) C2H5OH с C2H5OH 2) CH3COOH с Na2CO3 3) СН2 = СН2 с НСl 4) СНзСООН с C2H5OH 12. Реакция гидролиза характерна для 1) жиров ; 2) кислот ; многоатомных спиртов ; 4) щелочей 13. В схеме превращений X Y этилацетат ацетат натрия уксусная кислота формулы веществ Х и Y 1) Х — H2O; Y — Н2 SO4 ; 2) Х — H2O; Y — С2Н5OH 3) Х — NaOH; Y — Н2 SO4 ; 4) X — NaOH; Y — CH3COOH 14. Присутствие в водном растворе гидроксида кальция можно доказать с помощью 1) лакмуса и соляной кислоты ; 2) лакмуса и углекислого газа 3) фенолфталеина и хлороводорода ; 4) фенолфталеина и аммиака 15. Цветную реакцию на фенол дает раствор 1) хлорида железа (III) ; 2) гидроксида кальция 3) сульфата меди (II) ; 4) хлорида бария 16. С наибольшей скоростью при комнатной температуре протекает реакция 1) С2Н5OH c Na ; 2) О2 с Н2 ; 3) Fе с H2SO4 (р-р) ; FeSO4 (р-р) с NaOH (р-р) 17. Химическое равновесие в системе С4Н8 (г) + Н2 (г) С4Н10 (г) + Q можно сместить в сторону исходных веществ при 1) понижении температуры ; 2) повышении температуры 3) повышении давления ; 4) использовании катализатора 18.Метилацетат можно получить при взаимодействии 1) метанола с муравьиной кислотой ; 2) этанола с муравьиной кислотой 3) метанола с уксусной кислотой ; 4) этанола с уксусной кислотой 19. Для одностадийного способа получения уксусной кислоты в промышленности используют 1) ацетальдегид; 2) ацетилен ; 3) этиламин ; 4) бромэтан 20. Гомолог гексана 1) С6Н14 ; 2) С7Н16 ; 3) С6Н6 ; 4) С7Н14 21.Изомерами являются 1) формальдегид и муравьиная кислота ; 2) этанол и уксусная кислота 3) бензол и фенол ; 4) пентан и диметилпропан 22. Для нейтрализации 200г 9% -ного раствора уксусной кислоты потребуется гидроксид натрия массой 1) 6,9г 2) 9,0г 3) 12,0г 4) 15,0г 23. При смешивании 5,9г аммиака с 5,6л (н.у.) хлороводорода образуется хлорид аммония массой 1) 5,0г 2) 5,6г 3) 13,4г 4) 15,7г 24. Для синтеза 30кг муравьиной кислоты окислением метана (при выходе продукта 90% ) потребуется метан объемом (н.у.) 1) 13,15м3 2) 14,6м3 3) 16,2м3 4)22,4м3 Ответы к тестам Ответы к тестам 1.Тест по теме: «Первоначальные химические понятия»
|
