|
|
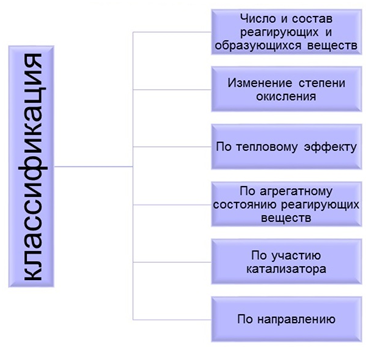
Ао. ТИПЫ КЛАССИФИКАЦИЙ ХИМИЧЕСКИХ РЕАКЦИЙ. Конспект. Типы классификаций химических реакций
ТИПЫ КЛАССИФИКАЦИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
Классификация химических реакций по числу и составу исходных и образующихся веществ
Химическая реакция
|
Определение
|
Примеры
|
Разложения
А → В + С + D
|
Реакция, в которой из одного исходного вещества образуется несколько новых веществ
|
2HgO →t→ 2Hg + O2
CaCO3 → CaO + CO2
4HNO3 → 2H2O + 4NO2 + O2
|
Замещения
А + ВС → АВ + С
|
Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества
|
Fe + CuSO4 → FeSO4 + Сu
CuSO4 + Fe → FeSO4 + Cu
2KBr + Cl2 → 2KCl + Br2
|
Обмена
АВ + CD → АС + BD
|
Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества
|
2AgNO3 + H2SO4 → Ag2SO4 + 2HNO3
NaOH + HCl → NaCl + H2O
CH3COONa + H2O → CH3COOH + NaOH
|
Соединения
А + В + С → D
|
Реакция, в результате которой из двух или нескольких веществ образуется одно новое
|
HCl + NH3 → NH4Cl↓
CaO + H2O → Ca(OH)2
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3
|
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
Реакция
|
Определение
|
Пример
|
Эндотермическая
|
Реакция, проходящая с поглощением теплоты
|
N2 + O2 → 2NO - 90,4 кДж
|
Экзотермическая
|
Реакция, проходящая с выделением теплоты
|
Н2 + Сl2 → 2НСl + 92,3 кДж
|
Классификация химических реакций по признаку обратимости
Реакция
|
Определение
|
Примеры
|
Обратимая
|
Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях
|
ЗН2 + N2 ↔ 2NH3
Вг2 + Н2O ↔ НВrО + НВr
|
Необратимая
|
Такая реакция, которая в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
|
2Н2(г) + O2(г) → 2Н2O(ж)
СН4 + 2O2 → СO2 + 2Н2O
|
Таблица признаки необратимости реакций
Признак
|
Примеры
|
Реакция идет с выделением большого количества теплоты
|
2Mg + O2 → 2MgO + Q
|
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа)
|
СаСl2 + Na2SO3 → CaSO3↓ + 2NaCl
CaCO3 →t→ CaO + CO2↑
|
В результате реакции образуются малодиссоциируе-мые вещества
|
(CH3COO)NH4 + H2O → CH3COOH + NH4OH
HCl + NaOH → NaCl + H2O
|
Классификация химических реакций по изменению степени окисления
Химическая реакция
|
Определение
|
Примеры
|
Проходящая с изменением степени окисления атомов (окислительно-восстановительная)
|
реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим
|
H2S-2 + 020 → S0 + Н2O-2
2KI-1 + Сl20 → 2КСl-1 + I20
|
Проходящая без изменения степени окисления
|
Реакция, в которой степень окисления каждого атома после реакции остается неизменной
|
2АlСl3 + 3Na2S + 6Н2O → 2Аl(ОН)3↓ + 3H2S↑ + 6NaCl
H2SO4 + NaOH → NaHSO4 + H2O
|
По агрегатному состоянию реагирующих веществ. (По фазе)
Гомогенными называют реакции, протекающие в однородной среде (однородные вещества, в одной фазе, например г-г, реакции в растворах).
Гетерогенными называют реакции, протекающие в неоднородной среде, на поверхности соприкосновения реагирующих веществ, находящихся в разных фазах, например, твердой и газообразной, жидкой и газообразной, в двух несмешивающихся жидкостях.
По использованию катализатора
Каталитические реакции протекают только в присутствии катализатора (в том числе и ферментативные).
Некаталитические реакции идут в отсутствие катализатора. |
|
|
 Скачать 138 Kb.
Скачать 138 Kb.
