Типовые нарушения периферического кровообращения и микроциркуляции
 Скачать 0.59 Mb. Скачать 0.59 Mb.
|
|
2. Почечные отеки (нефритические и нефротические). Нефритический отек развивается при аллергических и воспалительных заболеваниях почек с преимущественным диффузным поражением клубочкового аппарата. Нарушения кровообращения в корковом слое почек обуславливает усиление секреции ренина юкстагломерулярными клетками. В связи с этим включается осмотический фактор развития отека, связанный с активацией системы ренин-ангиотензин-альдостерон-антидиуретический гормон (АДГ), что сопровождается задержкой в организме избытка натрия и воды. Важно иметь в виду, что для диффузного гломерулонефрита характерно повреждение мембран микрососудов и, прежде всего, капилляров во многих органах и тканях организма. Повышение их проницаемости является важным механизмом развития нефритических отеков (Табл. 2). Нефротический отек. Он возникает вследствие преимущественного поражения тубулярного (канальцевого) аппарата почек. Для нефроза характерна длительная массивная потеря белка с мочой (протеинурия), которая ведет к гипопротеинемии и соответственно гипоонкии и, как следствие, увеличение фильтрации и снижение реабсорбции воды в капиллярах органов и тканей. В силу этого избыток воды в тканях сочетается с увеличением клубочковой фильтрацией в почках. При значительном выходе жидкости из сосудистого русла в ткани развивается гиповолемия, что служит сигналом для включения нейроэндокринных механизмов регуляции объема жидкости (волюм-рефлекс – осмо-рефлекс) и приводит к задержке в организме натрия и воды. Однако ограничение выведения воды с мочой приводит к дальнейшему потенцированию почечного отека, поскольку гипоонкия крови сохраняется (и даже может увеличиваться в связи с гемодилюцией). "Сэкономленная" почками жидкость не удерживается в крови и переходит в ткани (Табл. 3). Таблица 1 Патогенез сердечного отека.
Таблица 2. Патогенез нефритических отеков.
Отеки, обусловленные факторами общего характера Системные отеки обнаруживаются во многих частях организма и являются результатом общих соматических заболеваний. Развитию отеков общего характера способствуют следующие факторы: 1. Гиперфункция ренин-ангиотензин-альдостероновой системы и общий избыток натрия в организме (сердечная недостаточность, воспалительные или ишемические поражения почек). 2. Недостаточность образования предсердного натрийуретического фактора (ПНУФ). Как известно, ПНУФ представляет собой комплекс атриопептидов I, II, III, которые синтезируются клетками правого предсердия и его ушка. ПНУФ обладает эффектами, противоположными эффектам альдостерона и антидиуретического гормона, увеличивая выделение с мочой воды и натрия. Нарушение продукции ПНУФ отмечается при сердечной недостаточности в условиях дилатации полостей сердца. 3. Снижение онкотического давления плазмы крови вследствие утраты онкотически активных белков:
4. Повышение гидростатического давления в – обменных сосудах микроциркуляторного русла (застойные явления при сердечной недостаточности, гиперволемия при 'нарушении выделительной функции почек, расстройствах водно-электролитного баланса различной этиологии и т.д.). Таблица 3. Патогенез почечных отеков при нефрозе.
Таблица 4. Патогенез асцита при циррозе печени.
Таблица 5. Значение отека для организма.
5. Повышение проницаемости сосудистых стенок (системное действие биологически активных веществ, токсических и ферментных факторов патогенности микроорганизмов, токсинов неинфекционного происхождения и т.д.). 6. Повышение гидрофильности тканей (при нарушениях электролитного баланса, при отложении мукополисахаридов в коже и подкожной клетчатке при микседеме, при нарушениях перфузии тканей кровью в условиях венозного застоя и т.д.). Внешний вид органов и тканей при отеке имеет характерные особенности. Накопление отечной жидкости в рыхлой подкожной соединительной ткани происходит, прежде всего, под глазами, на тыльной поверхности кистей рук, стоп, на лодыжках, а затем постепенно распространяется на все туловище. Кожа становится бледной, натянутой, морщины и складки разглаживаются. Отечная жировая клетчатка становится бледно-желтой, блестящей, слизеподобной. Легкие при отеке увеличены в размерах, тяжелые, тестообразной консистенции. Слизистые оболочки становятся набухшими, полупрозрачными, желатиноподобными. Клинически начальному отеку с отрицательным тканевым давлением жидкости соответствует симптом образования ямки при нажатии на отечную ткань. Если ямка от нажатая не образуется – давление в ткани положительное, что соответствует далеко зашедшему, «напряженному» отеку. Отечное содержимое разжижает межуточное вещество в различных тканях, раздвигает клетки, коллагеновые, эластические и ретикулярные волокна, расщепляя их на тонкие фибриллы. Клетки сдавливаются отечной жидкостью или набухают; в их цитоплазме и ядре появляются вакуоли, некробиотические изменения. Значение отеков неоднозначно. Приспособительная роль отеков заключается в предохранении организма от развития гиперволемии. Местный отек разжижает тканевое содержимое, уменьшая концентрацию в нем токсинов, биологически активных веществ и т.д. Местный воспалительный отек обеспечивает, наряду с другими факторами, барьерную функцию процесса воспаления, способствуя ограничению крово- и лимфотока в очаге, обеспечивая повышение в тканях содержания гуморальных факторов неспецифической резистентности. Однако отек сдавливает сосуды, нарушая микроциркуляцию крови и лимфы, что обеспечивает постепенное развитие дистрофических, атрофических, некротических изменений в отечной ткани, а также развитию склероза. Особенно опасен отек органов и тканей, заключенных в замкнутые полости (мозг, легкие, сердце), так как при этом может произойти их сдавление и нарушение жизненно важных функций. Кроме того, сдавление отеком нервных окончаний может сопровождаться болевым синдромом. ТРОМБОЗ Тромбоз – прижизненное местное пристеночное образование в сосудах или сердце плотного конгломерата из форменных элементов крови и стабилизированного фибрина, то есть тромба. Тромбоз - физиологический защитный процесс, направленный на предотвращение кровотечения при травме тканей, на укрепление стенок аневризм, на ускорение стягивания и заживления ран. Однако, если тромбоз избыточен, недостаточен, либо утратил свой обязательно местный ограниченный характер, возможно развитие тяжелой патологии. Тромбоз также является компонентом патогенеза многих патологических процессов, таких, как воспаление, местные расстройства кровотока, шок и др. Тромбы подразделяются на белые, красные и смешанные. Тромбоз как естественный способ остановки кровотечения, отражает характер взаимодействия механизмов системы гемостаза и фибринолиза. Принято выделять три основных звена гемостаза: сосудистое звено – гемостатические механизмы сосудистой стенки, направленные на спазм поврежденного сосуда и запуск тромбообразования и свертывания крови; клеточное (тромбоцитарно-лейкоцитарное звено), которое обеспечивает формирование белого тромба; фибриновое звено – система свертывания, обеспечивающая образование фибрина, в результате чего формируются красные и смешанные тромбы. Все три звена гемостаза включаются одновременно и обеспечивают остановку кровотечения и восстановление целостности сосудистой стенки. 1. Спазм сосуда происходит за нескольких секунд. Белый тромб формируется в течение в течение 2-5 мин. Образование богатого фибрином красного тромба требует 4-9 мин. 2. Процесс тромбообразования начинается с постепенного формирования белого тромба, который обеспечивает остановку капиллярного кровотечения. Он состоит из склеенных тромбоцитов и лейкоцитов и фибрина. Такая агглютинационная разновидность тромбов лишена тромбоцитов и не имеет нитчато-волокнистой структуры. 3. Красный тромб формируется в условиях преобладания коагуляции над агглютинацией при быстром свертывании крови и медленном кровотоке. Такой тромб способен остановить кровотечение из артериальных и венозных стволов. Красный тромб состоит из головки, представляющей аналог белого тромба, слоистого слоя, в котором чередуются тромбоцитарные и фибриновые отложения, и фибринового хвоста, улавливающего эритроциты. Смешанными тромбами считаются слоистые тромбы с несколькими агглютинационными белыми головками. Кроме того, выделяют особые виды тромбов, образующихся при определенных условиях:
Тромб следует отличать от кровяного сгустка. Истинный тромб всегда формируется только прижизненно внутри сосуда и прочно связан с сосудистой стенкой. Сгустки же могут образовываться не только прижизненно, но и в условиях in vitro, посмертно, не только в просвете сосуда, но также в полостях и тканях на месте гематом. Сгустки крови в сосудах лежат свободно и связаны с сосудистой стенкой рыхло, не имеют структурированности, свойственной тромбам. В основе активации тромбообразования при различных патологических процессах лежит триада Вирхова – повреждение эндотелия сосуда, замедление кровотока, нарушение динамического равновесия между прокоагулянтами и антикоагулянтами с активацией коагуляционного гемостаза. Указанный каскад реакций может индуцироваться эндотоксинами грамотрицательных микроорганизмов, экзотоксинами, гипоксией, ацидозом, многочисленными медиаторами патологических процессов (кинины, лейкотриены, простагландины, перекиси и т.п.), цитокинами, продуцируемыми в избытке грануло- и агранулоцитами и другими источниками. Таким образом, основными регуляторами агрегатного состояния крови являются сосудистая стенка, тромбоциты (и другие форменные элементы крови) и плазменные компоненты прокоагулянтной, антикоагулянтной и фибринолитической систем. Важнейшими факторами тромборезистентности сосудистой стенки являются простациклин (PGI2), оксид азота, эндотелины, гепарин, активаторы плазминогена, тромбомодулин,13-гидрооксиоктадиеновая кислота (13-HODE). Установлены молекулярно-клеточные механизмы антиагрегатных свойств простациклина и оксида азота, обладающих способностью активировать, соответственно, аденилатциклазу и гуанилатлазу, увеличивая содержание в клетках, в частности в тромбоцитах, цАМФ и цГМФ, что сопровождается снижением внутриклеточного содержания ионизированного кальция и подавления агрегационной способности тромбоцитов. 13-HODE, будучи продуктом липидного обмена, снижает экспрессию адгезивных фибронектиновых рецепторов мембраны эндотелиальных клеток, подавляя тем самым их способность к взаимодействию с тромбоцитами и другими клетками крови. Активация эндотелия эндотоксинами, тромбином, интерлейкином-1 и другими цитокинами синтез 13-HODE угнетается, что индуцирует развитие адгезии и агрегации тромбоцитов. Одним из важнейших факторов тромборезистентности сосудистой стенки является гликопротеид тромбомодулин, синтезируемых эндотелием и экспрессируемый на люминальной поверхности интимы при увеличении содержания в эндотелиоцитах цАМФ. Тромбомодулин является акцептором для активированного тромбина. При их взаимодействии тромбин теряет способность тромбообразования и в то же время приобретает свойства модифицировать активность протеина С в процессе его расщепления, что приводит к антикоагулянтной активности указанного белка. Помимо антикоагулянтов, антиагрегантов и активаторов системы фибринолиза, сосудистая стенка является источником прокоагулянтов. Важнейшими синтезируемыми эндотелием прокоаулянтами являются тромбопластин, тромбоксан А2, фактор Виллебранда. К белкам-прокоагулянтам субэндотелия относят коллаген, фактор Виллебранда, фибронектин, тромбоспондин. В зоне альтерации возникает каскад реакций активации тромбоцитарного звена системы гемостаза, внешнего и внутреннего механизмов формирования протромбиназной активности, а также системы фибринолиза. При повреждении эндотелия обнажается субэндотелий, экспрессируются эндотелиальные адгезивные молекулы, подавляется синтез простациклина, оксида азота, падает антиагрегационная, антикоагулянтная активность тромбомодулина. Обнажающийся при повреждении эндотелия фибронектин обеспечивает адгезию тромбоцитов и макрофагов к коллагену, а фактор Виллебранда связывается с тромбоцитарными рецепторами Ib, IIb/IIIa (интегринами). Рецепторы IIb/IIIa обладают наибольшим аффинитетом (сродством) к фибриногену, однако они могут связывать и другие адгезивные белки, в частности тромбоспондин и фибронектин. Вместе с тем, эти рецепторы экспрессируются лишь после активации тромбоцитов. Взаимодействие тромбоцита с адгезивными белками приводит к распластыванию пластинок на субэндотелии сосудов с последующей активацией тромбином фактора активации тромбоцитов, АДФ, катехоламинов, серотонина, выделяющихся из сосудистой стенки, гемолизирующихся эритроцитов и первично адгезированных пластинок. Наряду с адгезией происходит агрегация, набухание и склеивание тромбоцитов с образованием многочисленных отростков, способствующим росту гемостатической пробки. Таким образом, важнейшими стимуляторами первой волны агрегации тромбоцитов являются АДФ, коллаген, катехоламины и серотонин. Все вышеуказанные активаторы тромбоцитов селективно взаимодействуют с их специализированными мембранными рецепторами, что ведет к увеличению содержания в цитоплазме пластинок ионизированного кальция за счет его поступления из внутритромбоцитарных депо или внеклеточных источников. Увеличение содержания свободного кальция в цитоплазме тромбоцитов запускает каскад ставших уже известных биохимических реакций пластнок – экспрессия рецепторов, IIb/IIIa на их цитоплазматической мембране, сокращение контрактильных белков, высвобождение из гранул тромбоцитов фибриногена, тромбоспондина, акцелератора V фактора, 4 тромбоцитарного фактора, фактора Виллебранда, митогенного фактора. В это же время из электронно-плотных гранул пластинок выходят АДФ катехоламины и серотонин, усиливающие процесс агрегации и формирующие ее вторую волную. Позднее секретируются гранулы, содержащие лизосомальные ферменты (реакция высвобождения II). Под влиянием кальция активируется фосфолипаза А2, высвобождаются продукты биотрансформации фосфолипидов – фактор активации тромбоцитов (ФАТ), простагландины F2, G2, H2, тромбоксан. Биологическое действие указанных веществ ограничено временем (несколько минут), но их значение в регуляции и патологии гемостаза чрезвычайно велико. Высвобождение в окружающую среду указанных соединений индуцирует цепную реакцию активации тромбоцитарного звена системы гемостаза за счет усиления эксрессии рецепторов типа IIb/IIIa окружающими тромбоцитами. Один тромбоцит активирует множество других. Тромбоспондин эндотелиоцитов, тромбоцитов и мононуклеаров связывает в зоне воспаления пластинки с фибрином, коллагеном, эндотелием, макрофагами, тромбоцитами, благодаря чему агрегация приобретает необратимый характер. Активация тромбоцитарного звена системы гемостаза в зоне альтерации неизменно связана с одновременной активацией протромбиназной активности и последующим каскадом реакций образования фибрина. Активация внутреннего механизма формирования протромбиназной активности также возникает при повреждении эндотелия и контакте крови с различными компонентами субэндотелия, в частности с коллагеном. Поверхность коллагена и активированных тромбоцитов является высоко аффинной для XII фактора Хагемана, вызывая его активацию и трансформацию в XIIа фактор. Помимо этого активация XII фактора может осуществляться путем его ферментативного расщепления калликреином, плазмином и другими протеазами. Таким образом, существуют два механизма активации XII фактора – контактный с образованием XIIа фактора и ферментативный с образованием XIIf фактора. XIIа фактор оказывает большее активирующее воздействие на коагуляционный гемостаз, а XIIf фактор – на калликреин-кининовую систему и фибринолиз. В целом XII фактор является универсальным активатором всех плазменных протеолитических систем – свертывающей, калликреин-кининовой, фибринолитической и системы комплемента. Следует отметить выраженную прямую взаимосвязь активации калликреин-кининовой системы в зоне альтерации и интенсивности тромбообразования, поскольку активированный в зоне воспаления калликреин (кининогеназа) усиливает активацию XII фактора, превращая его в XIIа фактор. Последний, в свою очередь, активирует XI плазменный фактор свертывания крови с развитием последующего стереотипного каскада реакций, внутреннего механизма формирования протромбиназы: активацией IX плазменного фактора свертывания крови (фактора Кристмаса): VIII фактора свертывания крови (антигемофильного глобулина А), а затем Х фактора Стюарта-Прауера, или протромбиназы. В этом каскаде реакций, как и во внешнем механизме формирования протромбиназы, важная роль отводится ионам кальция. Внешний механизм формирования протромбиназы стимулируется поступлением в плазму тканевого тромбопластина (фактора III или комплекса фосфолипид-апопротеин III). Источником тканевого тромбопластина могут быть эндотелиальные клетки, гладкомышечные элементы сосудов и другие клеточные элементы, подвергшиеся альтерации. Тканевой тромбопластин образует комплексе циркулирующим VII плазменным фактором, превращая его в VIIa фактор. Эта реакция стимулируется следовыми количествами тромбина, факторов IXa, Xa, VIIa. Комплекс факторов VШa – тканевой тромбопластин превращает неактивную протромбиназу в активную, т.е. Х фактор в Xa. Как при внешнем, так и при внутреннем механизме свертывания, взаимодействие и активация факторов осуществляются на фосфолипидных микромембранах, играющих роль матриц, на которых фиксируются с помощью ионов кальция белковые факторы, реагируя друг с другом, меняя свою четвертичную и третичную структуру. Роль таких матриц выполняют мембраны оболочек и гранул тромбоцитов, мембраны эритроцитов. Фактор Xa в присутствии ионов кальция на фосфолипидной поверхности в присутствии ионов кальция связывается с фактором V, образуя активную протромбиназу. При этом заканчивается первая фаза свертывания крови – фаза формирования активной протромбиназы. Далее следует вторая фаза коагуляционно-тромбоцитарного гемостаза: трансформация протромбина в тромбин при участии активной протромбиназы. В процессе протеолитического расщепления одноцепочечная молекула протромбина превращается в двухцепочечную молекулу (цепи А и В) альфа-тромбина. Третья фаза свертывания крови - трансформация фибриногена в фибрин под влиянием альфа-тромбина. Как известно, фибриноген - глобулярный гликопротеин с ММ около 340000 состоит из двух одинаковых субъединиц. Каждая из субъединиц состоит из 3 цепей: альфа, бета, гамма. Под влиянием тромбина вначале от молекулы фибриногена отщепляются пептиды А, при этом образуется дес-А-мономеры фибрина, затем отщепляются пептиды В, что приводит к образованию дес-АВ или полных мономеров фибрина. Появление свободных пептидов А или В в крови служит признаком внутрисосудистого свертывания крови. Фибрин-мономеры, имеющие трехнодулярную структуру, проходят этапы полимеризации с образованием димеров, из которых при продольном и поперечном связывании образуются протофибриллы фибрина, а затем волокна растворимого фибрина. Под влиянием фактора XIII, активируемого тромбином в присутствии ионов кальция, в фибрине образуются дополнительные дисульфидные связи, как между гамма-, так и альфа-цепями, что делает фибрин нерастворимым (фибрин I). При незначительном повреждении сосудистой стенки возможен альтернативный механизм активации тромбина и последующего тромбообразования, для которого характерна активация IX плазменного фактора под влиянием комплекса тканевого тромбопластина и Vila фактора. В свою очередь, IXa фактор комплексируется с Villa фактором в присутствии ионов кальция с последующей активацией протромбиназы. В случае развития альтернативного механизма активации протромбиназы образуются небольшие количества тромбина, недостаточные для активации коагуляционного гемостаза, но обеспечивающие активацию тромбоцитарного звена системы гемостаза. Локальная инициация процессов тромбообразования далеко не всегда ведет к системной активации гемостаза и тромбообразованию в участках сосудистого русла, отдаленных от зоны повреждения. Это обусловлено циркуляцией в системном кровотоке значительного количества антикоагулянтов. К числу важнейших первичных антикоагулянтов крови относится антитромбин III, на долю которого приходится более 75% аитикоагулянтной активности плазмы крови. Антитромбин III является белком альфа-2-глобулиновой фракции крови, синтезируется печенью, является ингибитором тромбина, VIIa, IXa, XIa, XIIa плазменных факторов свертывания крови. Антитромбин III – основной плазменный кофактор гепарина. Снижение уровня антитромбина III ниже 70% от его нормы при ДВС-синдроме, осложняющем течение многих патологических процессов и заболеваний, вызывает тяжелое тромбофилическое состояние. Дефицит антитромбина III формирует гепаринорезистентность. Однако последняя может быть обусловлена интенсивным синтезом белков острой фазы, в частности, альфа-1-кислого гликопротеина, способного связывать гепарин. Другим антикоагулянтом крови, препятствующим развитию локального системного тромбообразования, является протеин С (К-зависимая серин-амидаза синтезируется гепатоцитами), обеспечивающий инактивацию основных неферментных факторов VIII и V. Процесс инактивации катализируется при участии тромбомодулина эндотелия сосудов и протеином S гепатогенного происхождения. Ингибиторами процессов свертывания крови являются альфа-2-макроглобулин, подавляющий активность тромбина, калликреина; альфа-2-антитромбин, липопротеины, способные ингибировать VIIa и Xa факторы свертывания крови. Выраженной антикоагулянтной активностью обладают и вторичные продукты каскада протеолитических реакций, в частности, фибрин, продукты фибринолиза или деградации фибрина. В случае развития системного воспалительного процесса аутоиммунной природы не исключена возможность образования патологических антикоагулянтов - антител чаще к VIII и V плазменным факторам свертывания крови. Следует отметить, что формирование тромбоза сосудов в зоне воспаления является характерным признаком венозной гиперемии. Оно имеет двойственную значимость: с одной стороны, нарушаются процессы васкуляризации, оксигенации и трофики тканей, а с другой, – развитие тромбоза обеспечивает фиксацию патогенных факторов инфекционной природы в зоне их инокуляции, препятствуя распространению инфекции. Наряду с усилением процессов тромбообразования возникает и одновременная активация системы фибринолиза, обеспечивающая реваскуляризацию. Как известно, главным компонентом фибринолитической системы является плазмин, содержащийся в плазме крови в виде профермента – плазминогена. Внутренняя активация фибринолиза в зоне альтерации возникает под влиянием тех же факторов, что и активация протромбиназы, т.е. комплексом ХIIа или XIIf с калликреином и высокомолекулярным кининогеном. Внешняя активация фибринолиза обеспечивается белковым активатором тканевого типа, интенсивно синтезируемым эндотелием сосудов на фоне тромбоэмболии сосудов, избыточных концентраций вазоактивных соединений. Мощные активаторы плазминогена содержатся в эритроцитах, тромбоцитах, лейкоцитах. Различают два типа активаторов плазминогена, синтезируемых в клетках различных органов и тканей: тканевого и урокиназного типа. Урокиназа в значительном количестве образуется в почках в юкстагломерулярном аппарате. Обращает на себя внимание тот факт, что тканевой активатор плазминогена обладает более выраженным фибринолитическим действием в зоне тромба, чем в системном кровотоке, поскольку обладает большей аффинностью к фибрину, нежели к фибриногену. Тромболитическое действие активатора тканевого типа значительно возрастает в присутствии тромбоспондина. К числу ингибиторов фибринолиза относятся антиплазмины: альфа-2-антиплазмин, альфа-2-макроглобулин, CI эстеразный ингибитор, антитрипсин и другие. Последствия тромбоза могут быть разнообразны. С одной стороны, тромбоз является защитным механизмом, направленным на остановку кровотечения при повреждении или разрыве сосуда. С другой стороны, тромбоз, возникающий при различных патологических состояниях, ведет к развитию нарушений местного кровообращения, нередко с тяжелыми последствиями для организма. Характер циркуляторных расстройств, степень нарушения функции органов при тромбозах могут быть различными и зависят от локализации тромба, скорости его образования, возможностей коллатерального кровообращения в данном месте. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 . Уменьшение МОС
. Уменьшение МОС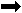 . Повреждение мембраны иммунными комплексами.
. Повреждение мембраны иммунными комплексами. ктивация систе-мы «ренин– ангио-тензин-АДГ»
ктивация систе-мы «ренин– ангио-тензин-АДГ»