ТИПОВЫЕ ЗАДАЧИ
к экзамену по первой части курса физической химии в январе 2005 г.
Кафедра оставляет за собой право включать в экзаменационный билет задачи, являющиеся частью или комбинацией частей приведенных типовых задач.
Расчет теплоты, работы, изменения внутренней энергии и изменения энтальпии в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
Расчет приращения энтальпии вещества при постоянном давлении в интервале температур, в котором происходят фазовые превращения (расчет количества теплоты, необходимого для изобарного нагревания).
Расчет стандартных тепловых эффектов химических реакций при 298К с использованием следствий из закона Гесса.
Вычисление значений 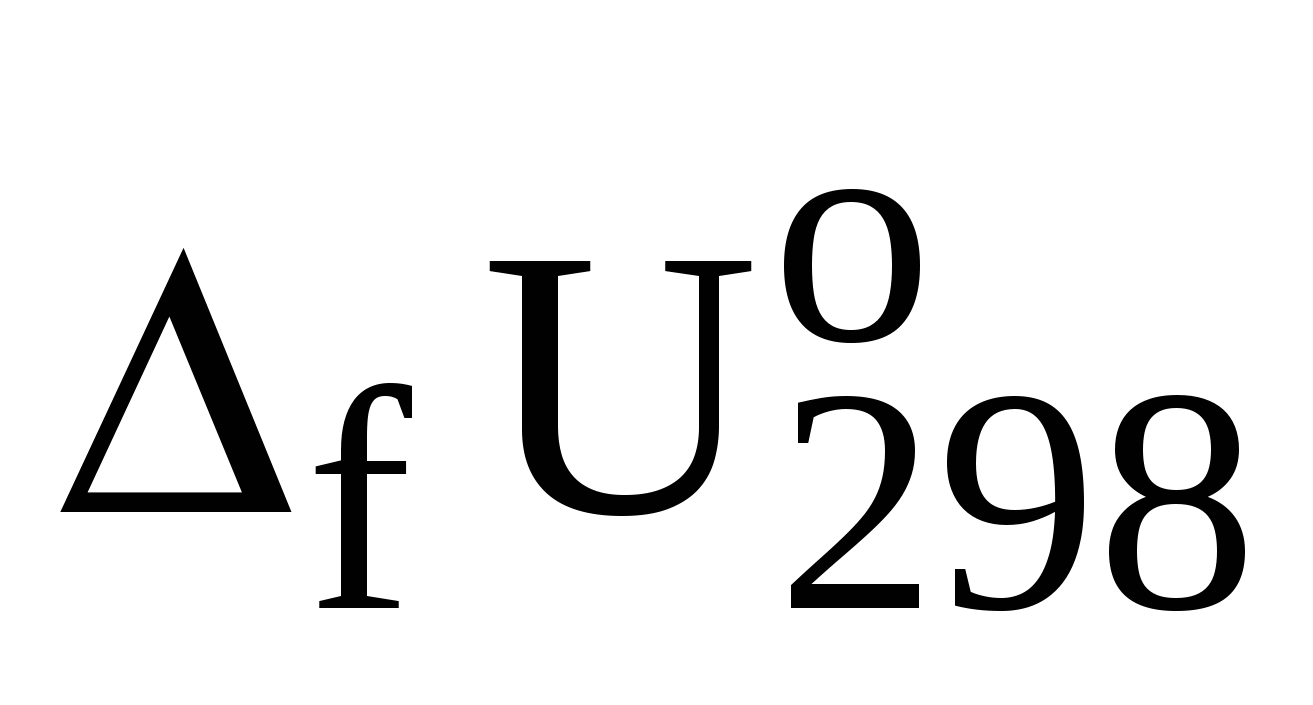 из данных о значениях из данных о значениях 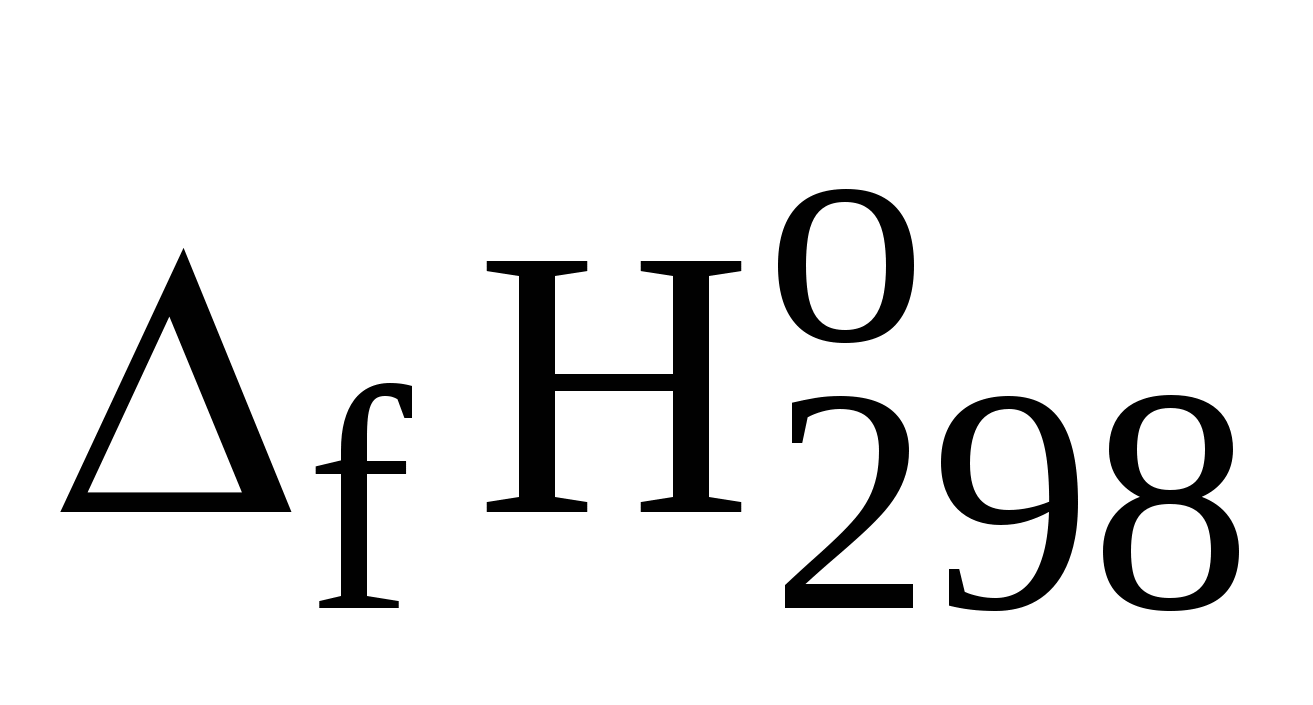 . .
Расчет стандартных тепловых эффектов химических реакций и фазовых превращений при заданной температуре с использованием уравнения Кирхгофа.
Составление (вывод) выражения температурной зависимости стандартного изменения энтальпии в химической реакции с использованием стандартных энтальпий образования и температурной зависимости теплоемкости реагентов и продуктов.
Вывод выражения для изменения теплоемкости в химической реакции по уравнению температурной зависимости стандартного изменения энтальпии.
Расчет изменения энтропии в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
Расчет изменения энтропии при смешивании двух идеальных газов.
Расчет абсолютного значения энтропии вещества в состоянии идеального газа при заданных температуре и давлении по известному значению стандартной энтропии при 298 К с учетом температурной зависимости теплоемкости.
Расчет стандартного изменения энтропии в химической реакции при заданной температуре. Оценка знака изменения энтропии в химической реакции по данным о фазовом состоянии участников реакции.
Определение направления самопроизвольного протекания химической реакции в изолированной системе, включающей большой тепловой резервуар.
Расчет изменения энергии Гиббса и изменения энергии Гельмгольца в обратимых изотермическом, изобарном или изохорном процессах с участием идеальных газов и в циклах, составленных из таких процессов.
Расчет изменения энергии Гиббса при смешивании двух идеальных газов.
Составление (вывод) выражений температурной зависимости стандартного изменения энергии Гиббса (вариант: термодинамической константы равновесия) в химической реакции с использованием стандартных термодинамических величин для веществ при 298К и температурной зависимости теплоемкости.
Расчет стандартного изменения энергии Гиббса (вариант: стандартного химического сродства) и стандартного изменения энергии Гельмгольца в химической реакции при заданной температуре.
Расчет значений констант равновесия KP и KC для реакций в идеальной газовой смеси по данным о равновесном составе смеси или о равновесной степени превращения при заданных условиях.
Расчет равновесной степени превращения и равновесных концентраций веществ для химической реакции в идеальной системе по заданному значению константы равновесия (для гомогенных реакций в идеальной газовой смеси и для гетерогенных реакций в системах, включающих идеальный газ и чистые вещества в конденсированной фазе).
Определение направления самопроизвольного протекания реакции при P=const, T=const с использованием уравнения изотермы Вант-Гоффа.
Расчет константы равновесия химической реакции при данной температуре по ее значению при другой температуре и среднему изменению энтальпии в данном интервале температур.
Расчет стандартных изменений энтальпии, энтропии, энергии Гиббса и теплоемкости для химической реакции по температурной зависимости термодинамической константы равновесия.
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным методом Темкина-Шварцмана.
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным о константах равновесия реакций образования веществ из простых веществ.
Расчет термодинамической константы равновесия и стандартного изменения энергии Гиббса (энергии Гельмгольца) химической реакции по справочным данным о стандартной приведенной энергии Гиббса веществ в состоянии идеального газа и о стандартной энтальпии образования.
Расчет равновесного давления газообразного продукта гетерогенной реакции, в которой участвуют практически чистые вещества в конденсированных фазах и образуется идеальный газ (расчет по справочным термодинамическим данным).
Расчет температуры кипения вещества при заданном внешнем давлении по температурной зависимости давления насыщенного пара. Вариант: Расчет температуры кипения вещества при заданном внешнем давлении по известным температуре кипения при другом давлении и средней энтальпии испарения в данном интервале температур.
Расчет среднего изменения энтальпии испарения или сублимации для индивидуального вещества по значениям давления насыщенного пара при двух температурах в приближении “пар=идеальный газ”. Вариант: Расчет давления насыщенного пара при заданной температуре по известным значению давления при другой температуре и средней энтальпии испарения в данном интервале температур.
Расчет координат тройной точки чистого вещества (равновесие «твердое-жидкость-пар» по данным о температурной зависимости давления насыщенного пара.
Оценка энтальпии плавления вещества в тройной точке по уравнениям температурной зависимости давления насыщенного пара для линий испарения и сублимации.
Приближенный расчет температуры плавления вещества при заданном давлении по уравнению Клапейрона-Клаузиуса.
Расчет числа степеней свободы системы в заданной фазовой области по уравнению правила фаз Гиббса.
Расчет парциальных мольных величин компонентов бинарного раствора по уравнению зависимости свойства раствора от количества (или от моляльности) одного из компонентов при фиксированных давлении, температуре и количестве второго компонента.
Расчет парциальных мольных величин компонентов бинарного раствора по уравнению зависимости мольного свойства раствора от мольной доли одного из компонентов при фиксированных давлении и температуре.
Расчет изменения объема при смешении заданных количеств компонентов при известных парциальных мольных объемах компонентов.
Расчет плотности раствора заданной концентрации при известных парциальных мольных объемах компонентов.
Расчет теплоты смешения заданных количеств двух компонентов или теплоты разбавления бинарного раствора по известным парциальным мольным энтальпиям растворения или по мольной энтальпии смешения.
Расчет активности компонентов раствора по равновесным парциальным давлениям пара и давлению насыщенного пара компонентов в приближении «пар = идеальный газ». Расчет рационального коэффициента активности компонентов раствора по активности и мольной доле.
Вывод выражений для активности компонента и относительного химического потенциала компонента раствора по известным уравнениям температурной зависимости равновесного парциального давления пара и давления насыщенного пара чистого компонента в приближении «пар = идеальный газ».
Расчет изменения объема, энтальпии, энтропии, энергии Гиббса при образовании бинарного идеального раствора.
Расчет изменения энергии Гиббса при смешении по известным активностям и концентрациям (вариант: количествам) компонентов при заданной температуре.
Вычисление относительного понижения давления пара растворителя (варианты: повышения температуры начала кипения, понижения температуры начала отвердевания осмотического давления) для разбавленного раствора нелетучего растворенного вещества в летучем растворителе при известных свойствах растворителя и концентрации раствора.
Вычисление значения одного коллигативного свойства для разбавленного раствора нелетучего растворенного вещества в летучем растворителе по значению другого коллигативного свойства.
Расчеты молярной массы нелетучего растворенного вещества по повышению температуры кипения (вариант: по понижению температуры отвердевания) его разбавленного раствора в летучем растворителе. Определение молекулярной массы и химической формулы растворенного вещества.
Расчеты изотонического коэффициента и кажущейся степени диссоциации или ассоциации растворенного вещества в разбавленном растворе по данным о коллигативных свойствах раствора.
Расчеты равновесных количеств вещества в двух равновесных фазах бинарной системы по правилу рычага (вариант: расчет масс двух фаз, сосуществующих в равновесии в бинарной системе).
Расчет количества компонента, которое требуется добавить к бинарной системе, находящейся в заданном состоянии, для перевода ее в новое состояние, указываемое по диаграмме.
Расчет наибольшего количества компонента, которое теоретически может быть выделено в чистом виде из заданного количества бинарной системы с известной концентрацией, путем ректификации при постоянном давлении.
Определение химической формулы твердого соединения по диаграмме плавкости неизоморфной бинарной системы.
Оценка энтальпии плавления вещества – компонента бинарной системы по уравнению Шредера.
Определение количества вещества (или массы вещества) в твердой фазе, закристаллизовавшейся при охлаждении расплава известной концентрации до заданной температуры.
|
 Скачать 40.5 Kb.
Скачать 40.5 Kb.