ответы. Ответы на билеты. Титриметрический (объемный) метод заключается в точном определении объема
 Скачать 201.47 Kb. Скачать 201.47 Kb.
|
|
Билет 1. 1) Титриметрический (объемный) метод заключается в точном определении объема раствора реагента, необходимого для полного протекания реакции с заданным объемом исследуемого раствора. ● Титриметрия – это метод количественного анализа, в основе которого лежит точное измерение объема раствора известной концентрации, израсходованного на реакцию с определенным объемом раствора. Титрант или стандартный раствор – это раствор с точно известной концентрацией. Титрование – это процесс постепенного добавления титранта к анализируемому раствору. Точка эквивалентности – это момент завершения реакции между титрантом и анализируемым веществом. Фиксация точки эквивалентности может происходить 3 способами: 1) Безинидикаторный способ: один из растворов является индикатором. 2) Индикаторный: используются интенсивно окрашиваемые индикаторы. 3) Физико-химический способ: точку эквивалентности определяют по изменению показания прибора в ходе титрования. 2) Термодинамика – это наука, изучающая энергетические превращения в системах, способные обмениваться массой и энергией. Термодинамическая система – это тело или группа тел, отделенных от окружающей среды воображаемой или реальной границей раздела, в которой возможен обмен массой и энергией. Состояние системы бывает: 1) Равновесное – все свойства остаются постоянными в течение большого времени, отсутствуют потоки m и E. 2) Стационарное – все свойства системы постоянны во времени, но есть потоки m и E. 3) Переходное – свойства системы меняются во времени. Происходит переход системы из одного равновесного или стационарного состояния в другое равновесное или стационарное. Параметры системы бывают: 1) Интенсивные – характеризуют каждую точку системы, не зависят от количества вещества системы. 2) Экстенсивные – характеризуют систему в целом, зависят от количества вещества в системе. 3) Автопротолиз воды – это процесс образования катиона Н 3 О + и ОН - из молекул Н 2 О за счет передачи протона Н + от одной молекулы к другой: 2Н 2 О = Н 3 О + + ОН - Константа автопротолиза воды: К Н2О = [Н3О +]*[ОН - ] = 1*10 -14 Билет 2. 1) Вода – универсальный растворитель обеспечивает всасывание и механическое передвижение питательных веществ, продуктов обмена в организме. Вода участвует в процессах набухания, осмоса, создает онкотическое давление, поддерживает температуру тела. Непосредственно вызывает диссоциацию электролитов. Все основные реакции, связанные с жизнедеятельностью, осуществляются при непосредственном участи воды. 2) Функция состояния – это физическая величина, определяющая свойства термодинамической системы. Основные термодинамические функции: Е – полная энергия U – внутренняя энергия Н – энтальпия S – энтропия G – свободная энергия Гиббса или изохорно-изобарный потенциал F – свободная энергия Гельмгольца или изохорно-изотермический потенциал Внутренняя энергия – функция состояния, приращение которой равно теплоте, полученной системой в изохорном процессе. ˄U=Q+A Классификация: 1) Изолированная – система, в которой m=const, E=const. 2) Закрытая – система, в которой m=const, E≠const. 3) Открытая – система, в которой m≠const, E≠const. Типы процессов: 1) Изотермические – процессы при постоянной t 2) Изобарные – процессы при постоянном p 3) Изохорные – при постоянном V 3) Метод кислотно-основного титрования – основан на реакциях нейтрализации. Данный метод служит для определения концентрации кислот и оснований в разных жидкостях. Основные титранты в данном методе – сильные кислоты (ацидиметрия) и щелочи (алкалиметрия). В процессе титрования образуется вода и какая-либо соль, определяющая pH всего раствора (определяется по гидролизу). Реакция нейтрализации не сопровождается какими-либо видимыми изменениями, поэтому для фиксации точки эквивалентности применяют разные индикаторы – ф/ф, лакмус, метилоранж. Билет 3. 1) Первое начало термодинамики: если закрытой системе сообщена какая-то теплота (Q), то она расходуется на приращение внутренней энергии (∆U) и на совершение системой работы (А) против внешних сил Q=∆U+A Энтальпия (∆H) – это термодинамическая функция, характеризующая энергетическое состояние системы при изобарно-изотермических условиях. Стандартные условия: 298К и 101,3 кПа. Энтальпия образования соединения – это изменение энтальпии (∆H), сопровождающееся образованием 1 моль сложного соединения из простых. Стандартная энтальпия образования простого вещества равна 0. Энтальпия растворения – это изменение энтальпии (∆H), сопровождающаяся растворением 1 моль вещества в таком объеме растворителя, когда его дальнейшее прибавление не вызывает выделения или поглощения тепла. Энтальпия сгорания – это изменение энтальпии (∆H), сопровождающаяся окислением кислородом 1 моль органического вещества. Энтальпия нейтрализации – это изменение энтальпии (∆H), сопровождающаяся нейтрализацией 1 моль-эквивалента кислоты или основания. 2) Кривые кислотно-основного титрования выражают зависимость изменения рН среды от объема добавленного в процессе титрования титранта. Для обоснованного выбора индикатора процесс титрования моделируют в виде кривой титрования. Ошибка титрования будет минимальной, если рТ индикатора попадает в область скачка на кривой титрования. Отрезок на кривой титрования, когда от прибавления минимального объема титранта резко изменяется значение рН, называется скачком титрования. Для фиксирования точки эквивалентности при кислотно-основном титровании пригоден любой индикатор, интервал перехода окраски которого лежит в пределах скачка рН на кривой титрования. 3) Закон Гесса: изменение энтальпии химической реакций зависит только от вида и состояния исходного вещества и конечных продуктов, но не зависит от пути перехода. Следствия из закона Гесса: 1) Изменение энтальпии равно алгебраической сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. ∆Нреакции = ∑n∆Hобр.продуктов - ∑n∆Hобр.исходных 2) Изменение энтальпии равно алгебраической сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов ∆Нреакции = ∑n∆Hсгор.исходных - ∑n∆Hсгор.продуктов 3) Изменение энтальпии прямой и обратной реакции равны между собой, но противоположны по знаку ∆Нобратной = -∆Нпрямой 4) Если в результате ряда последовательных реакций система приходит в первоначальное состояние, то суммарное изменение энтальпии равно нулю. 5) Энтальпия химической реакции равна ее тепловому эффекту, но с обратным знаком. Применение I начала термодинамики: все виды работ в организме совершаются за счет эквивалентного количества энергии, выделяющейся при окислении питательных веществ. Билет 4. 1) Биогенные элементы - химические элементы, постоянно входящие в состав организмов и имеющие определённое биологическое значение.  В. И. Вернадский считал, что все химические элементы, постоянно присутствующие в клетках и тканях организмов в естественных условиях, вероятно, играют определенную физиологическую роль. Согласно биогеохимической теории Вернадского существует «биогенная миграция атомов» по цепочке воздух-> почва -> вода -> пища -> человек, в результате которой практически все элементы, окружающие человека во внешней среде, в большей или меньшей степени проникают внутрь организма. Элементы, жизненно необходимые организму, называют биогенными элементами. Содержание тех или иных элементов в организмах зависит не только от их видовых особенностей, но и от состава среды, пищи, экологических особенностей организма и других факторов. При нарушении поступления в организм того или иного Б. э. возникают заболевания. 2) Второе начало термодинамики: невозможен переход тепла от тела менее нагретого к более нагретому телу (Клаузис). Это позволило сформулировать принцип Бертло: самопроизвольно протекают те процессы, в результате которых выделяется энергия. Обратимый процесс — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния. Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Энтропия (∆S) – это термодинамическая функция, приращение которой (∆S) равно теплоте (Q min ), подведенной к системе в обратимом изотермическом процессе, делимой на температуру (Т) ∆S= Q min/Т (дж/к) Уравнение Больцмана: энтропия прямо пропорциональна натуральному логарифму термодинамической вероятности нахождения системы в данном состоянии. S=k*lnW где k = R/N A; W – термодинамическая вероятность системы. Изменение энтропии равно алгебраической сумме энтропий образования продуктов реакции за вычетом суммы энтропий образования исходных веществ с учетом стехиометрических коэффициентов ∆S реакции = ∑n∆S обр.продуктов - ∑n∆S обр.исходных 3) Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ Закон Генри: растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью  Растворимость смеси идеальных газов подчиняется закону Дальтона: Растворимость отдельных компонентов газовой смеси пропорциональна их парциальному давлению и практически не зависит от присутствия других газовых компонентов. Билет 5. 1) Биосфера – оболочка Земли, заселенная живыми организмами, находящаяся под их воздействием и занятая продуктами их жизнедеятельности. Круговорот биогенных веществ - круговороты наиболее значимых для живых организмов веществ и элементов (H2O, C, O, N, P, Sи др.) Биогеохимия — раздел геохимии, изучает химический состав живого вещества и геохимические процессы, протекающие в биосфере. Биогеохимические провинции -области на поверхности Земли, различающиеся по содержанию (в их почвах, водах и т.п.) химических элементов (или соединений), с которыми связаны определённые биологические реакции со стороны местной флоры и фауны. 1) органогены, в организме их 97,4% (С, Н, О, N, Р, S), 2) элементы электролитного фона (Na, К, Ca, Mg,). Данные ионы металлов составляют 99% общего содержания металлов в организме; 3) Микроэлементы – это биологически активные атомы центров ферментов, гормонов (переходные металлы). 2) Энтропия (∆S) – это термодинамическая функция, приращение которой (∆S) равно теплоте (Q min), подведенной к системе в обратимом изотермическом процессе, делимой на температуру (Т) ∆S= Q min/Т (дж/к) Постулат Планка: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к абсолютному нулю. Для вычисления абсолютного значения энтропии надо знать теплоемкости, определенные до наиболее низких температур, и теплоты фазовых переходов. ФОРМУЛА.  Условия самопроизвольного протекания реакций: 1. стремление системы к достижению минимального значения внутренней энергии 2. стремление системы к более вероятному своему состоянию. 3) Закон Сеченова - растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов. Так, если в воде растворить соль, то, за счёт гидратации ионов, число свободных молекул воды уменьшится и растворённых газов в солёной воде станет меньше, чем в пресной. Билет 6. 1) Титриметрический (объемный) метод заключается в точном определении объема раствора реагента, необходимого для полного протекания реакции с заданным объемом исследуемого раствора. Титриметрия – это метод количественного анализа, в основе которого лежит точное измерение объема раствора известной концентрации, израсходованного на реакцию с определенным объемом раствора. Заместительное титрование – заключается в добавлении к анализируемому веществу избытка реагента, вступающего с ним в реакцию, с последующим определением количества одного из продуктов реакции путем титрования. Например, к раствору дихромата калия в сернокислой среде прибавляют избыток KI. Выделившийся I2 тиосульфатом натрия. В этом случае расчет проводится по формуле: Cэ(A)=Cэ(В)*V(В) / V(А) 2) Под стандартной энергией Гиббса образования ΔGообр понимают изменение энергии Гиббса при реакции образования 1 моль сложного вещества, находящегося в стандартном состоянии. Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии. Изменение энергии Гиббса равно алгебраической сумме энергии Гиббса образования продуктов реакции за вычетом суммы энергии Гиббса образования исходных веществ с учетом стехиометрических коэффициентов ∆G реакции = ∑n∆G обр.продуктов - ∑n∆G обр.исходных. 3) Коллигативные свойства – это свойства растворов, зависящие от концентрации растворенных частиц, но не от их природы. Закон Рауля: понижение давления пара прямо пропорционально мольной доле растворенного нелетучего неэлектролита. /\p=K*x Тзам растворов ниже, а Ткип их выше, чем у чистых растворителей. Повышение t кип. Повышение t кип растворов неэлектролитов прямо пропорциональны ее моляльной концентрации Билет 7. 1) Титриметрический (объемный) метод заключается в точном определении объема раствора реагента, необходимого для полного протекания реакции с заданным объемом исследуемого раствора. Титриметрия – это метод количественного анализа, в основе которого лежит точное измерение объема раствора известной концентрации, израсходованного на реакцию с определенным объемом раствора. Обратное титрование заключается в добавлении к анализируемому веществу точно известного избытка титранта – V(1) с последующим определением его остатка, не вступившего в реакцию, с помощью второго титранта - V(2). Например, к раствору кислоты (1) прибавляют избыток щелочи, который оттитровывают раствором кислоты (2). В данном случае принцип эквивалентности устанавливает соотношение между количествами эквивалентов трех веществ и записывается в форме: C(X)=Cэ(1)*V(1) - Cэ(2)*V(2) / V(X) 2) Биоэнергетика – это раздел термодинамики, изучающий превращение энергии в организме человека. Энергию человек получает из продуктов питания и выражается она в калориях. 1 калория = 4,18 Дж. 1 грамм жира = 9 ккал/г 1 грамм углеводов и белков = 4 ккал/г Норма для взрослого человека: 60-70 грамм жиров, 100 г белков, 500 г углеводов. Принцип Онзагера-Пригожина: в открытой термодинамической системе в стационарном состоянии прирост энтропии (∆S) в единицу времени принимает минимальное положительное значение для данных условий. Экзергонические реакции (самопроизвольные реакции) – реакции, протекающие без притока энергии извне (энергетический обмен - окисление глюкозы). Эндергонические реакции (не самопроизвольные реакции) – реакции, для протекания которых необходим приток энергии извне (пластический обмен - репликация ДНК). Сопряженные – одновременно идущие реакции, они из которых могут идти в отсутствие других, а эти последние не могут протекать в отсутствие первых. 3) Осмос – это переход растворителя через полупроницаемую мембрану из менее концентрированного раствора в более концентрированный. Закон Вант-Гоффа: Р осм. раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же t находилось в газообразном состоянии и занимало V, численно равный объему раствора P осм. = iС м RT. i = 1 для неэлектролитов. Билет 8. 1) Химический эквивалент вещества – это условная или реальная частица, способная отдавать, принимать, или каким-либо другим способом соответствовать одному иону водорода в обменных реакциях или одному электрону в ОВР. Фактор эквивалентности – это число, показывающее, какую долю от реальной частицы составляет эквивалент. Закон эквивалентов: массы реагирующих между собой веществ, а также массы продуктов реакции прямо пропорциональны молярным массам эквивалентов этих веществ. 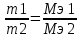 или или 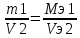 Мэ (кислоты) = 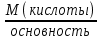 Мэ (основания) = 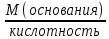 Мэ (оксид) = 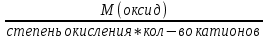 Мэ (соли) = 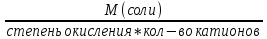 2) Химическое равновесие - состояние системы, в котором скорость прямой реакции равна скорости обратной реакции. Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ⇆ 2NH3 Необратимыми называют такие химические процессы, продукты которых не способны реагировать друг с другом с образованием исходных веществ. Примерами необратимых реакций может служить разложение бертолетовой соли при нагревании 2КСlО3 = 2КСl + ЗО2 Термодинамические условия равновесия: ΔG=0; ΔH=TΔS. 3) Неэлектролиты – это вещества, не способные проводить электрический ток. Электролиты – это вещества, способные проводить электрический ток. Электролитическая диссоциация или ионизация – это процесс распада электролитов на ионы в воде. Аррениус создал теорию электролитической диссоциации: 1) Электролиты при растворении в воде распадаются на ионы 2) Ионы находятся в постоянном хаотичном движении 3) Под действием электрического тока ионы приобретают направленное движение. Катионы идут к катоду, анионы – к аноду. 4) Диссоциация – это обратимый процесс. Все электролиты можно поделить на: 1) Сильные электролиты – вещ-ва, которые распадаются на ионы полностью (α > 30%). Сюда можно отнести соли, щелочи, большинство кислот. 2) Средние электролиты – 3% > α > 30%. Сильные органические кислоты. 3) Слабые электролиты – α < 3%. Сюда можно отнести нерастворимые основания и органические кислоты. Билет 9. 1) Титриметрический (объемный) метод заключается в точном определении объема раствора реагента, необходимого для полного протекания реакции с заданным объемом исследуемого раствора. Титриметрия – это метод количественного анализа, в основе которого лежит точное измерение объема раствора известной концентрации, израсходованного на реакцию с определенным объемом раствора. Прямое титрование: происходит постепенное прибавление титранта к анализируемому веществу до достижения точки эквивалентности. Разновидность прямого титрования – реверсионное: анализируемое вещество прибавляют к титранту до точки эквивалентности. Cэ(А)=Cэ(В)*V(В) / V(А) 3) Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: 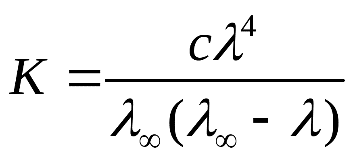 Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства: где α — степень диссоциации. Закон разбавления Оствальда выведен В.Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности закона разбавления Оствальда имело большое значение для обоснования теории электролитической диссоциации. Билет 10. 1) Относительная атомная масса (Аr) - масса атома, выраженная в атомных единицах массы. Она показывает, во сколько раз атом данного элемента больше 1/12 массы изомера углерода-12. Относительная молекулярная масса — это массы молекулы, выраженная в атомных единицах массы. Она показывает, во сколько раз масса данной молекулы больше 1/12 массы изомера углерода-12. Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12 Молярная масса – это масса 1 моля вещества, выраженная в граммах. Химический эквивалент вещества – это условная или реальная частица, способная отдавать, принимать, или каким-либо другим способом соответствовать одному иону водорода в обменных реакциях или одному электрону в ОВР. Молярная масса эквивалента (МЭ) – это масса одного моль эквивалента. Она равна произведению молярной массы вещества на фактор эквивалентности. Фактор эквивалентности – это число, показывающее, какую долю от реальной частицы составляет эквивалент. 2) Закон Гесса: изменение энтальпии химической реакций зависит только от вида и состояния исходного вещества и конечных продуктов, но не зависит от пути перехода. Следствия из закона Гесса: 1) Изменение энтальпии равно алгебраической сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов ∆Н реакции = ∑n∆H обр.продуктов - ∑n∆H обр.исходных 2) Изменение энтальпии равно алгебраической сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов ∆Н реакции = ∑n∆H сгор.исходных - ∑n∆H сгор.продуктов 3) Изменение энтальпии прямой и обратной реакции равны между собой, но противоположны по знаку ∆Н обратной = -∆Н прямой 4) Если в результате ряда последовательных реакций система приходит в первоначальное состояние, то суммарное изменение энтальпии равно нулю. 5) Энтальпия химической реакции равна ее тепловому эффекту, но с обратным знаком. 3) Теория сильных электролитов Дебая-Хюккеля: согласно данной теории, сильные электролиты практически полностью диссоциируют даже в концентрированных растворах. В таких растворах действуют силы притяжения между разноименными ионами и силы отталкивания между одноименными. Каждый ион оказывается в атмосфере ионов другого знака, поэтому раствор сильного электролита представляет собой равномерно распределенные по всему объему ионы, каждый из которых находится в электрическом поле, создаваемое окружающими ионами. В растворах сильных электролитов вместо обычной концентрации ионов лучше использовать активную концентрацию (а) – величину, в соответствии с которой ионы проявляют себя в растворах. а = f * C м где f – это коэффициент активности lg f = -0,5Z 2 * √I I (ионная сила) – это величина, численно равная полусумме произведения концентрации каждого иона в растворе и квадрата его заряда. I = (C 1 Z 1 2 + C 2 Z 2 2 +…) Билет 11. 1) Автопротолиз воды – это процесс образования катиона Н 3 О + и ОН - из молекул Н 2 О за счет передачи протона Н + от одной молекулы к другой: 2Н 2 О = Н 3 О + + ОН - Константа автопротолиза воды: К Н2О = [Н3О + ] * [ОН - ] = 1*10 -14 Водородным показателем рН называют десятичный логарифм концентрации водородных ионов, взятый с обратным знаком: рН = –lg[H+] или [Н+] = 10-рН, где [Н+] – концентрация ионов водорода, моль/л. Гидроксильным показателем рОН называют десятичный логарифм концентрации гидроксильных ионов, взятый с обратным знаком: рОН = –lg[OH-] или [ОН-]=10-рОН, где [ОН-] – концентрация гидроксид-ионов, моль/л. нейтральная рН=7, кислая рН<7, щелочная рН>7 нейтральная рОН=7, кислая рОН>7, щелочная рОН<7 2) скоростью гомогенной химической реакции - изменение количества реагентов или продуктов реакции в единицу времени  зависимость между скоростью реакции и концентрациями реагирующих веществ описывается основным постулатом химической кинетики — законом действующих масс:скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в степени их стехиометрических коэффициентов: v = k . [A]а . [B]в. При повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза: где g - tтемпературный коэффициент, принимающий значения от 2 до 4. Почти все биохимические реакции не подчиняются правилу Вант-Гоффа, т.к. для многих каталитических биохимических реакций ℽ<2 Гомогенный – это такой катализ, когда катализатор и все реагирующие вещества находятся в одной фазе. 2NO+O2=2NO2 Гетерогенный катализ - это каталитические процессы, происходящие па поверхности раздела фаз. В живых организмах роль катализаторов биохимических реакций выполняет спец.группа веществ – ферменты: высокая специфичность, избирательность, эффективность, чувствительность. 3) Осмотическое давление – это давление, которое необходимо приложить у раствору для предотвращения проникновения в него растворителя. Закон Вант-Гоффа: Р осм раствора равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же t находилось в газообразном состоянии и занимало V, численно равный объему раствора P осм = i См RT. i – это изотонический коэффициент Вант-Гоффа, который показывает во сколько раз реальное число растворенных частиц больше теоритического. Для электролитов i > 1, неэлектролитов i=1. Изотонические растворы – имеют одинаковое осмотичское давление. Если два раствора имеют разное осм.давление, то раствор с большым осмотическим давлением называется гипертоническим, а второй – гипотонический, по отношению к первому. Билет 12. Билет 13. Билет 14. Билет 15. |
