аналитическая химия _тест. Химические количества эквивалентов всех веществ, вступивших в реакцию и образовавшихся в результате реакции, численно равны между собой
 Скачать 294 Kb. Скачать 294 Kb.
|
|
Укажите формулировку, которая соответствует закону эквивалентов химические количества эквивалентов всех веществ, вступивших в реакцию и образовавшихся в результате реакции, численно равны между собой Укажите фактор эквивалентности гидроксида кальция в реакции Ca(OH)2 + HCl = CaOHCl + H2O 1 Укажите фактор эквивалентности серной кислоты в реакции H2SO4 + NaOH = NaHSO4 + H2O 1 Укажите фактор эквивалентности гидрофосфата натрия в реакции Na2HPO4 + NaOH = Na3PO4 + H2O 1 Укажите фактор эквивалентности серной кислоты в реакции H2SO4 + NaCl = NaHSO4 + HCl 1 Укажите фактор эквивалентности карбоната натрия в реакции Na2CO3 + 2HCl = H2CO3 + H2O 2 Укажите фактор эквивалентности серной кислоты в реакции H2SO4 + Ca(OH)2 = CaSO4 + H2O 2 Укажите фактор эквивалентности гидроксида натрия в реакции H4P2O7 + NaOH = NaH3P2O7 + H2O 1 Укажите фактор эквивалентности двуфосфорной кислоты в реакции H4P2O7 + 2NaOH = Na2H2P2O7 + 2H2O ½ Укажите фактор эквивалентности серной кислоты в реакции 2Al(OH)3 +3H2SO4 = Al2(SO4)3 + 6H2O ½ Укажите фактор эквивалентности щавелевой кислоты в реакции с едким натром H2C2O4 + NaOH → Na2C2O4 + H2O ½ Укажите фактор эквивалентности щавелевой кислоты в реакции с перманганатом калия 5H2C2O4 + 2KMnO4 + H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 6H2O ½ Укажите формулы для расчета молярной концентрации раствора H2SO4  …… …… 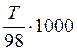 Укажите формулу для расчета нормальной концентрации раствора H2SO4 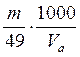 Укажите формулы для расчета титра раствора H2SO4 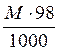 ………… …………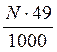 Укажите формулу для расчета титра раствора серной кислоты по едкому натру 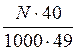 Укажите формулы для расчета массовой доли H2SO4 в водном растворе 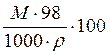 …………… ……………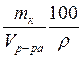 Установите соответствие между концентрациями растворов молярность, титр, нормальность и единицами их измерений молярность - моль/л; титр - г/мл ; нормальность - моль-эв./л Установите соответствие между концентрациями растворов нормальность, титр по определяемому веществу, титр и единицами их измерений нормальность моль-эв./л титр по определяемому веществу г/мл титр г/мл Установите соответствие между концентрациями растворов массовая доля вещества, моляльность, титр и единицами их измерений массовая доля вещества ω(%) моляльность моль /1000 г титр г/мл нормальность моль-эв./л- Сколько граммов дихромата калия необходимо взять для приготовления 500,00 мл раствора K2Cr2O7 с титром, равным 0,005882 г/мл? (fэкв.(K2Cr2O7) = 1/6. М(K2Cr2O7) = 294,10 г/моль) 2,94 г Определите молярную концентрацию K2Cr2O7 в приготовленном растворе, объёмом 500,000 мл с титром 0,005882 г/мл, если fэкв.(K2Cr2O7) = 1/6. М(K2Cr2O7) = 294,100 г/моль 0,020 моль/л Определите молярную концентрацию эквивалента K2Cr2O7 в приготовленном растворе, объёмом 500,000 мл с титром 0,005882 г/мл, если fэкв.(K2Cr2O7) = 1/6. М(K2Cr2O7) = 294,1 г/моль 0,120 моль/л Сколько нужно добавить воды к 100,00 мл 0,80 н. раствора HCl, чтобы получить 0,20 н. раствор? 300,00 мл Из 2,5000 г Na2CO3 приготовлено в мерной колбе 500,0000 мл раствора. Вычислить для этого раствора Т(Na2CO3). 0,0050г/мл Из 2,500 г Na2CO3 приготовлено в мерной колбе 500,000 мл раствора. Вычислить для этого раствора молярную концентрацию. М(Na2CO3) = 106,000 г/моль 0,047 моль/л До какого объема следует разбавить 900,0 мл 0,5 М раствора НСl, чтобы получить 0,1 М раствор? 4500,0 мл Вычислите молярную концентрацию раствора, полученного при смешивании 500,0000 мл 2,0000 М и 1500,0000 мл 0,5000 М растворов NaOH 0,8750 М Какой объем 27,3 %-ного раствора КОН (ρ = 1,260 г/мл) необходимо взять для приготовления 1,00 л 2,00 М раствора 326,00 мл Вычислите молярную концентрацию Н2SО4, если титр раствора равен 0,004852 г/мл. М(Н2SО4) = 98,0790 г/моль 0,0500 моль/л Вычислите С раствора, полученного смешиванием 50,0000 мл раствора НСl с титром 0,02370 г/мл и 550,0000 мл раствора НСl с молярной концентрацией 0,1925 моль/л. М(НСl)= 36,4600 г/моль 0,2300 моль/л Вычислите Т раствора, полученного смешиванием 50,0000 мл раствора НСl с титром 0,02370 г/мл и 550,0000 мл раствора НСl с молярной концентрацией 0,1925 моль/л. М(НСl)= 36,46 г/моль 0,0084 г/мл Вычислите навеску K2Cr2O7 для приготовления 500,00 мл 0,10 н. раствора. МK2Cr2O7 = 294,20 г/моль, F = 1/6 2,45 г Определите Т(K2Cr2O7/Fe) для приготовления 500,0000 мл 0,1000 н. раствора. МFe = 55,8500 г/моль 0,0056 г/мл Вычислите навеску Na2S2O3·5H2O, необходимую для приготовления 12,50 л 0,20 н. раствора для иодометрии. МNa2S2O3·5H2O = 248,18 г/моль. 620,45 г Вычислить титр раствора полученного при сливании 10,0000 мл 0,4000 М KОН со 100,0000 мл 0,1000 М КОН. МKOH = 56,110 г/моль 0,0071 г/мл Вычислить молярную концентрацию раствора полученного при сливании 10,000 мл 0,400 М KОН со 100,000 мл 0,100 М КОН 0,127 моль/л Вычислить молярную концентрацию раствора NaOH, если его титр равен 0,00420 г/мл. МNaOH = 39,990 г/моль 0,105 моль/л Вычислить титр раствора HCl, если СHCl = 0,1046 моль/л. МHCl = 36,4600 г/моль 0,0038 г/мл Вычислить молярную концентрацию раствора H2SO4, если ТH2SO4 = 0,004852 г/мл. МH2SO4= 98,0800 г/моль 0,0495 моль/л К 550,0000 мл 0,1925 М HCl прибавили 50,0000 мл раствора HCl с титром 0,02370 г/мл. Вычислить молярную концентрацию полученного раствора. МHCl =36,4600 г/моль 0,2300 М К 550,0000 мл 0,1500 М HCl прибавили 50,0000 мл раствора HCl с титром 0,02370 г/мл. Вычислить титр полученного раствора. МHCl =36,4600 г/моль 0,1917 г/мл Выберите этикетку для сосуда, в котором будет храниться раствор едкого натра после стандартизации г Выберите этикетку для сосуда, в котором будет храниться раствор нитрата серебра после стандартизации б Выберите этикетку для сосуда, в котором будет храниться раствор соляной кислоты после стандартизации г Выберите этикетку для сосуда, в котором будет храниться раствор едкого натра после стандартизации а Выберите этикетку для сосуда, в котором будет храниться раствор едкого натра после стандартизации б Выберите этикетку для сосуда, в котором будет храниться раствор нитрата серебра после стандартизации Рассчитайте титр раствора, содержащего в 1,00 л 11,80 г янтарной кислоты (Н2С4Н4О4) 1,18∙10-2 г/мл Вычислить титр раствора KOH, если СKOH = 0,100000 моль/л; К = 0,954690. МKOH = 56,110000 г/моль 0,005357 г/мл Вычислить титр раствора KOH, если СKOH = 0,05 моль/л; К = 0,954690. МKOH = 56,110000 г/моль 0,002678 г/мл Вычислить титр раствора KOH, если СKOH = 0,100000 моль/л; К = 0,854690. МKOH = 56,110000 г/моль 0,004796 г/мл Вычислить титр раствора KOH, если СKOH = 0,150000 моль/л; К = 0,854700. МKOH = 56,110000 г/моль 0,007194 г/мл Вычислить титр раствора НСl, если СHCl = 0,100000 моль/л; К = 0,950000. МHCl = 36,460000 г/моль 0,003464 г/мл Вычислить титр раствора НСl, если СHCl = 0,010000 моль/л; К = 0,950000. МHCl = 36,460000 г/моль 0,000346 г/мл Вычислить титр раствора НСl, если СHCl = 0,05000 моль/л; К = 0,950000. МHCl = 36,460000 г/моль 0,00173 г/мл Вычислить титр раствора AgNO3, если СAgNO3 = 0,010000 моль/л; К = 0,950000. МAgNO3 = 169,870000 г/моль 0,001614 г/мл Вычислить титр раствора AgNO3, если СAgNO3 = 0,050 моль/л; К = 0,950. МAgNO3 = 169,870 г/моль 8,069∙10-3 г/мл Вычислить титр раствора AgNO3, если СAgNO3 = 0,0500 моль/л; К = 0,8500. МAgNO3 = 169,8700 г/моль 7,2195∙10-3 г/мл Вычислить титр раствора AgNO3, если СAgNO3 = 0,10000 моль/л; К = 0,95000. МAgNO3 = 169,87000 г/моль 0,01614 г/мл Вычислить титр раствора AgNO3, если СAgNO3 = 0,10000 моль/л; К = 0,85800. МAgNO3 = 169,87000 г/моль 0,01457 г/мл Выберите из перечня химической посуды ту, которая Вам будет необходима для приготовления раствора титранта 1дм3 (H2SO4) из стандартного образца воронка Выберите из перечня химической посуды ту, которая Вам будет необходима для приготовления примерно 0,5 дм3 30%-ного раствора едкого натра из реактива NaOH пипетка Выберите из перечня химической посуды ту, которая Вам будет необходима для приготовления 500 см3 0,1 М HCl из концентрированного раствора цилиндр мерная колба емкостью 500 мл пипетка Выберите из перечня химической посуды ту, которая Вам будет необходима для приготовления 200 см3 0,01 М AgNO3 из реактива мерная колба емкостью 200 мл стаканчик для взвешивания пипетка Выберите из перечня химической посуды ту, которая Вам будет необходима для приготовления 100 см3 0,01 М NaCl из реактива мерная колба емкостью 100 мл стаканчик для взвешивания пипетка Выберете выражение для вычисления поправочного коэффициента титрования рабочего раствора 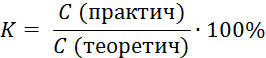 Наблюдение за расположением мениска при измерении объёма прозрачной жидкости ведут по нижнему краю мениска Наблюдение за расположением мениска при измерении объёма непрозрачной жидкости ведут по верхнему краю мениска Смешанный индикатор состоит из двух индикаторов, имеющих примерно одинаковый интервал перехода окраски. Окраска одного индикатора является дополнительной для другого Контрастный индикатор состоит из индикатора и вещества, окраска которого не зависит от рН Универсальный индикатор состоит из трёх и более индикаторов Что означает термин «рабочий раствор»? раствор с точно известной концентрацией и используется в качестве титранта Что означает термин «титрант»? раствор с известной концентрацией вещества Что означает термин «титрование»? прибавление к раствору, в котором содержится определяемое вещество, раствор титранта при постоянном перемешивании до изменения цвета индикатора Что означает термин «конечная точка титрования»? точка, в которой происходит изменение цвета индикатора Что означает термин «прямое титрование»? процесс, при котором титрант добавляют непосредственно к титруемому веществу Что означает термин «обратное титрование»? процесс, при котором к определяемому веществу добавляют заведомый избыток титранта и непрореагировавший титрант титруют вторым титрантом Что означает термин «заместительное титрование»? процесс, при котором используют стехиометрическую реакцию определяемого вещества со вспомогательным реагентом, а получившийся в эквивалентном количестве продукт определяют количественно рабочим раствором Что означает термин «индикатор кислотно-основного титрования»? амфолит, в котором кислая и основная формы находятся в равновесии Что означает термин «кривая титрования»? графическая зависимость величины рН раствора от объема прибавляемого титранта; графическая зависимость величины аналитического сигнала от степени оттитрованности определяемого компонента; Что означает термин «точка эквивалентности» в кислотно-основном титровании точка, соответствующая 100%-ной оттитрованности определяемого компонента титрантом и в реакционной смеси отсутствует титрант Что означает термин «бюретка» цилиндрическая стеклянная трубка с делениями, краном или зажимом, проградуированная в миллилитрах Что означает термин «пипетка» мерный или дозирующий сосуд, представляющий собой трубку, применяемый для точного измерения (дозирования) объёма жидкости Что означает термин «скачок титрования»? участок кривой, на котором отмечается быстрый рост величины аналитического сигнала по мере прибавления титранта и находится в средней части кривой Установите соответствие классификаций методов титриметрии по типу химических реакций комплексонометрическое по типу химических реакций окислительно-восстановительное по типу химических реакций осадительное по способу титрования обратное по способу титрования прямое по способу титрования титрование по заместителю Установите соответствие классификаций методов титриметрии по типу химических реакций кислотно-основное по типу химических реакций окислительно-восстановительное по типу химических реакций осадительное по способу титрования обратное по способу титрования прямое по способу титрования титрование по заместителю Растворы каких веществ могут использоваться в качестве титрантов в кислотно-основном титровании для определения содержания карбоната натрия в питьевой соде? 0,1М (К=0,985) раствор соляной кислоты Рабочий раствор в методе ацидиметрии кислота соляная Рабочий раствор в методе алкалиметрии раствор гидроксида натрия Для установления титра растворов щелочей используют приготовленные растворы щавелевой кислоты Укажите вещества, растворы которых могут применяться в качестве титрантов в кислотно – основном титровании HCl KOH Na2CO3 NaOH Укажите вещества, растворы которых могут применяться в качестве титрантов в кислотно - основном титровании H3РO4 НNО3 Na2CO3 Укажите функции, соответствующие интегральной кривой титрования: кислота – основание y =f(х) рН = f(VT) ….-lg аН+ = f( Назовите способы титрования прямое обратное по замещению осадительное Назовите способы титрования кислотно-основное обратное по замещению Назовите способы титрования окислительно-восстановительное обратное по замещению комплексонометрическое Назовите способы титрования по замещению обратное кислотно-основное прямое Назовите способы титрования прямое обратное по замещению комплексонометрическое Назовите способы титрования по замещению обратное прямое меркурометрия Назовите способы титрования прямое по замещению обратное аргентометрия Назовите способы титрования сульфатометрия по замещению обратное окислительно-восстановительное Какие из перечисленных примеров кислотно-основного титрования относят к прямому титрованию анализируемое уравнение |
