|
аналитическая химия _тест. Химические количества эквивалентов всех веществ, вступивших в реакцию и образовавшихся в результате реакции, численно равны между собой
окислителя NaBrO3
восстановителя KBr H2C2O4
амфотерного агента J2 (KBr + KJO3) (KJ + NaBrO3)
как правило, не участвует в Ox-Red –титровании AgNO3
Укажите соединения, участвующие в окислительно-восстановительном титровании только в качестве окислителя KBrO3, восстановителя Na2S2O3, амфотерного агента Br2 J2
Укажите соединения, участвующие в окислительно-восстановительном титровании только в качестве
как правило, не применяют в качестве агента в Ox-Red – титровании СaСl2
восстановителя KBr Na2S2O3 FeSO4 MnSO4
окислителя H3AsO4
амфотерного агента J2 K[J3]
Укажите соединения, участвующие в окислительно-восстановительном титровании только в качестве восстановителя KJ
амфотерного агента NaClO Br2 H2O2
как правило, не применяют в качестве агента в Ox-Red – титровании NaCl
Укажите, какие из перечисленных взаимодействий могут применяться в титриметрических методах анализа
кислотно основное титрование NaH2PO4 + NaOH =
окислительно-восстановительное титрование FeSO4 + KMnO4 + H2SO4 =
осадительное титрование KJ + AgNO3 =
Укажите, какой раствор является стандартным в перманганатометрии 0,05 н (K = 0,987) KMnO4
Укажите, какой раствор является стандартным в иодометрии 0,1н (K=0.995) KJO3
Укажите индикатор метода перманганатометрии без индикатора
Укажите окраску в точке эквивалентности в методе перманганатометрии бесцветная
Укажите рабочие вещества метода йодометрии Na2S2O3
В методе перманганатометрии титрование ведут при рН < 7
Установите соответствие между веществами рабочих растворов, используемых в йодометрии их растворителями
натрия тиосульфат вода свежепрокипячённая
кристаллический йод насыщенный раствор иодида калия
Из перманганата калия готовят раствор с титром установленным
Рабочие вещества метода перманганатометрии KMnO4
Согласно уравнению Нернста для окислительно-восстановительного потенциала пары 2JO3-/J2 оцените изменение величины потенциала с изменением значения рН среды другое
Укажите, какие из перечисленных взаимодействий относятся к окислительно-восстановительным SnCl2 + NaBiO2 + NaOH =
Укажите, какие из перечисленных взаимодействий относятся к окислительно-восстановительным FeSO4 + KMnO4 + H2SO4 = CuSO4 + Zn =
Укажите, какие из перечисленных взаимодействий относятся к окислительно-восстановительным такие взаимодействия отсутствуют
Укажите, какие из перечисленных взаимодействий относятся к окислительно-восстановительным Co(NO3)2 + H2O2 + NaOH =
Раствор бромата калия с концентрацией 0,01 моль/л использовали для титрования в различных средах. В каком случае молярная концентрация эквивалента КBrO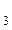 будет наибольшей? BrO будет наибольшей? BrO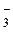 + 3H+ + 6e- = Br + 3H+ + 6e- = Br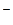 + 6OH + 6OH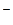
Раствор бромата калия с концентрацией 0,01 моль/л использовали для титрования в различных средах. В каких случаях молярная концентрация эквивалента КBrO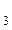 будет меньшей? 2BrO будет меньшей? 2BrO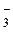 + 12H+ + 10e- = Br2 + 6H2O; BrO + 12H+ + 10e- = Br2 + 6H2O; BrO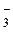 + Br + Br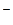 + 6H+ + = Br2 + 3H2O + 6H+ + = Br2 + 3H2O
Вычислите стандартную величину потенциала системы в ТЭ, в которой идет реакция титрования йода стандартным раствором тиосульфата натрия. (Е0(S4O6(/S2O3)= 0,06В;Е0(J2/2J-)= 0,535В) 0,270 В
К кислому раствору KJ прибавили 20,0000 мл 0,1133 н KMnO4 и выделившейся йод оттитровали 25,9000 мл раствора Na2S2O3. Рассчитайте молярную концентрацию раствора Na2S2O3 0,0875 моль/л
Вычислите значение реального окислительно-восстановительного потенциала (Е ) системы: 0,1000 М S4O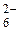 / 0,01M S2O / 0,01M S2O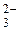 , если Е0= 0,06 0,0806 В , если Е0= 0,06 0,0806 В
Вычислите значение реального окислительно-восстановительного потенциала (Е) системы: Cr2O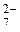 , Cr3+, [H+] = 0,10 M. (E , Cr3+, [H+] = 0,10 M. (E = 1,36 B; уравнение полуреакции: Cr2O = 1,36 B; уравнение полуреакции: Cr2O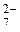 + 14 H+ = 2Cr3+ + 7Н2О) 1,35 В + 14 H+ = 2Cr3+ + 7Н2О) 1,35 В
В каком случае скачок титрования будет больше 0,1н FeSO4 титруется 0,1н раствором КМnО4 (f =1/5) при рН = 0
В каком случае скачок титрования будет меньше 0,1н FeSO4 титруется 0,1н раствором КМnО4 (f =1/5) при рН = 5
Укажите, какая будет степень оттитрованности (τ) КМnО4 при прибавлении к аликвоте 10,00 мл раствора 3,00 мл 0,10 н раствора Н2С2О4, если концентрация перманганата 0,10 М(f =1/5) = 30,00 % = 30,00 %
Установите соответствие между формулой, по которой определяют значение потенциала (В) для Ox-Red - титрования (например, КМnО4 титруют Н2С2О4) и участком кривой титрования
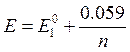 lg lg 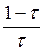 область до Тэкв область до Тэкв
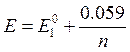 lg lg 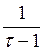 область после Тэкв область после Тэкв
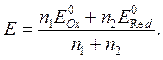 Тэкв Тэкв
Вычислите значение потенциала Ox-Red - системы, соответствующее точке эквивалентности титрования железа(II): Fe2+ + ClO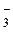 + H+ = … , если + H+ = … , если 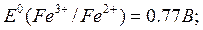 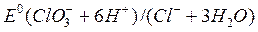 = 1,45В 1,35 В = 1,45В 1,35 В
Вычислите значение потенциала Ox-Red - системы, соответствующее точке эквивалентности титрования нитрита: HNO2 + KMnO4 + H+ = … , если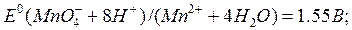 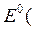 NO NO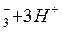 )/(NO )/(NO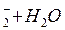 )=0,94B 0,84 В )=0,94B 0,84 В
При перманганатометрическом титровании пероксида водорода протекает реакция: 5Н2О2 + 2МnО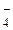 + 6Н+ = 5О2 +Мn2+ + 8Н2О. Вычислите, какая масса пероксида водорода содержалась в пробе (г), если на ее титрование израсходовано 10,000 мл 0,100 н стандартного раствора перманганата калия. (МН2О2= 34,000 г; МКМnО4 = 158,000 г) 0,017 г + 6Н+ = 5О2 +Мn2+ + 8Н2О. Вычислите, какая масса пероксида водорода содержалась в пробе (г), если на ее титрование израсходовано 10,000 мл 0,100 н стандартного раствора перманганата калия. (МН2О2= 34,000 г; МКМnО4 = 158,000 г) 0,017 г
На титрование 20,000 мл раствора FeSO4 в сернокислой среде израсходовали 22,500 мл 0,100 н K2Cr2O7. Какой объем воды нужно добавить к 200,000 мл раствора железа, чтобы сделать раствор FeSO4 точно 0,050 н? 225,000 мл
Иодометрическое определение содержания соединений меди (например, CuSO4) основано на качественной реакции Cu2+ с иодидом калия с образованием свободного йода, который титруют тиосульфатом натрия. Назовите этот способ титрования по замещению
Иодометрическое определение содержания соединений меди (например, CuSO4) основано на качественной реакции Cu2+ с иодидом калия с образованием свободного йода, который титруют тиосульфатом натрия. Какой из участников этого процесса должен соответствовать требованиям стандартного раствора: Cu2+; KJ; Na2S2O3? Na2S2O3
Укажите вещества, растворы которых могут быть применимы для стандартизации раствора Na2S2O3? K2Cr2O7
До какого объема следует разбавить 200,0000 мл 0,1000 раствора K2Cr2O7 (f = 1/6), чтобы получить раствор с ТK2Cr2O7 = 0,003922? МK2Cr2O7= 284,0000 г/моль 241,4000 мл
Навеску металлической меди массой 0,1530 г растворили, к раствору прибавили избыток KJ и на титрование выделившегося J2 израсходовали 24,1800 мл раствора Na2S2O3. Определите нормальность раствора титранта. МCu = 63,5400 г/моль 0,0996 н
Навеску металлической меди массой 0,15300 г растворили, к раствору прибавили избыток KJ и на титрование выделившегося J2 израсходовали 24,18000 мл раствора Na2S2O3. Определите ТNa2S2O3 (МNa2S2O3 = 158,00000 г/моль) 0,01573 г/мл
Навеску металлической меди массой 0,153000 г растворили, к раствору прибавили избыток KJ и на титрование выделившегося J2 израсходовали 24,180000 мл раствора Na2S2O3. Определите ТNa2S2O3/J2. (МNa2S2O3 = 158,000000 г/моль; МJ2= 254,000000 г/моль) 0,012644 г/мл
К раствору K2Cr2O7 добавили избыток KJ и, выделившийся йод оттитровали 48,8000 мл 0,1000 н Na2S2O3. Какая масса (г) K2Cr2O7 содержалась в растворе? (М K2Cr2O7 = 284,0000 г/моль; f=1/6) 0,2310 г
Навеску технического FeCl3 массой 0,3467 г растворили, к раствору добавили KJ и кислоты. Выделившийся йод оттитровали 21,0000 мл 0,1000 н Na2S2O3. Вычислите массовую долю (%) FeCl3 в образце. МFeCl3= 162,5000 г/моль, f = 1 98,4300 %
Укажите, какой раствор является стандартными вброматометрии 0,1000 н NaBrO3
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,000 мл было затрачено 17,700 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,100 моль/л 0,177 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,00 мл было затрачено 15,70 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,10 моль/л 0,16 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,00 мл было затрачено 13,70 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,10 моль/л 0,14 моль/л
Рассчитайте молярную концентрацию эквивалента раствора йода, если на титрование 10,000 мл было затрачено 20,200 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,050 моль/л 0,101 моль/л
Рассчитайте молярную концентрацию эквивалента раствора йода, если на титрование 10,000 мл было затрачено 15,200 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,050 моль/л 0,076 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,0000 мл было затрачено 13,3000 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,0500 моль/л 0,0665 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,00 мл было затрачено 11,30 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,05 моль/л 0,06 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,000 мл было затрачено 8,600 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,100 моль/л 0,086 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,000 мл было затрачено 11,600 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,100 моль/л 0,116 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,000 мл было затрачено 15,600 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,050 моль/л 0,078 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 10,00 мл было затрачено 15,60 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,05 моль/л 0,08 моль/л
Рассчитайте молярную концентрацию эквивалента раствора йода, если на титрование 10,000 мл было затрачено 9,900 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,100 моль/л 0,099 моль/л
Рассчитайте молярную концентрацию эквивалента раствора перманганата калия, если на титрование 20,000 мл было затрачено 19,700 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,100 моль/л 0,099 моль/л
Рассчитайте титр раствора перманганата калия, если на титрование 10,0 мл было затрачено 17,7 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,1 моль/л. МKMnO4 = 158,0 г/моль 5,6·10-3 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,00 мл было затрачено 15,70 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,10 моль/л. МKMnO4 = 158,00 г/моль 4,96·10-3 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,00 мл было затрачено 13,70 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,10 моль/л. МKMnO4 = 158,00 г/моль 4,33·10-3 г /мл /мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,000 мл было затрачено 10,700 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,100 моль/л. МKMnO4 = 158,000 г/моль 3,381·10-3 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,000 мл было затрачено 9,700 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,100 моль/л. МKMnO4 = 158,000 г/моль 3,065·10-3 г/мл
Рассчитайте титр раствора йода, если на титрование 10,0000 мл было затрачено 9,9000 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,1000 моль/л. МJ2 = 253,8000 г/моль 0,0126 г/мл
Рассчитайте титр раствора йода, если на титрование 10,00000 мл было затрачено 7,90000 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,10000 моль/л. МJ2 = 253,80000 г/моль 0,01003 г/мл
Рассчитайте титр раствора йода, если на титрование 10,00 мл было затрачено 5,90 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,10 моль/л. МJ2 = 253,80 г/моль 7,49·10-3 г/мл
Рассчитайте титр раствора йода, если на титрование 20,000 мл было затрачено 19,900 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,100 моль/л. МJ2 = 253,800 г/моль 0,013 г/мл
Рассчитайте титр раствора йода, если на титрование 20,00 мл было затрачено 7,800 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,100 моль/л. МJ2 = 253,800 г/моль 0,039 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,0000 мл было затрачено 15,6000 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,0500 моль/л. МKMnO4 = 158,0000 г/моль 0,0025 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,000 мл было затрачено 11,600 мл раствора щавелевой кислоты с молярной концентрацией эквивалента 0,050 моль/л. МKMnO4 = 158,000 г/моль 1,833·10-3 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,0000 мл было затрачено 11,6000 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,1000 моль/л. МKMnO4 = 158,0000 г/моль 0,0037 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,00 мл было затрачено 8,60 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,10 моль/л. МKMnO4 = 158,00 г/моль 2,72·10-3 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,0000 мл было затрачено 13,3000 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,0500 моль/л. МKMnO4 = 158,0000 г/моль 0,0021 г/мл
Рассчитайте титр раствора перманганата калия, если на титрование 10,000 мл было затрачено 19,300 мл раствора оксалата натрия с молярной концентрацией эквивалента 0,050 моль/л. МKMnO4 = 158,000 г/моль 3,049·10-3 г/мл
Рассчитайте титр раствора йода, если на титрование 10,0000 мл было затрачено 20,2000 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,0500 моль/л. МI2 = 254,0000 г/моль 0,0128 г/мл
Рассчитайте титр раствора йода, если на титрование 10,000 мл было затрачено 15,200 мл раствора тиосульфата натрия с молярной концентрацией эквивалента 0,050 моль/л. МI2 = 254,000 г/моль 9,652·10-3 г/мл
|
|
|
 Скачать 294 Kb.
Скачать 294 Kb.