конспект 11 кл 7 апреля. То есть в этой модели атом должен быть неустойчивым
 Скачать 56.89 Kb. Скачать 56.89 Kb.
|
|
На прошлом уроке мы с вами рассматривали опыты Эрнеста Резерфорда по рассеянию альфа-частиц, которые позволили учёному создать ядерную (или планетарную) модель атома. Однако при всей своей убедительности планетарная модель атома оказалась внутренне противоречивой. По законам электродинамики движущийся ускоренно заряд излучает электромагнитные волны. Следовательно, атом должен непрерывно излучать электромагнитные волны. Излучение же связано с уменьшением энергии электрона в поле ядра. Следствием этого должно явиться уменьшение скорости движения и частоты вращения электронов вокруг ядра. Если частота непрерывно изменяется, то спектр излучения атома должен быть сплошным. Уменьшение скорости электрона должно привести к тому, что электрон будет двигаться по спирали к ядру и в течение короткого времени упадёт на него, то есть в этой модели атом должен быть неустойчивым Это находится в полном противоречии с экспериментальными фактами, которые свидетельствуют о том, что: атом является достаточно устойчивой системой; атом излучает электромагнитные волны лишь при определенных условиях, а не непрерывно; а спектры излучения атомов являются линейчатыми. Эти противоречия возникли потому, что к электронам в атомах применяли законы классической физики, а, как мы уже с вами знаем, в микромире действуют свои законы. Первым признал невозможность применения законов классической физики к атомам датский учёный Нильс Бор. Он ввёл элементы квантовой теории в модель атома Резерфорда и в 1913 году создал неклассическую теорию атома. В её основе лежала идея связать в единое целое три результата, полученные в физике к тому времени. Для решения этой задачи Бор, сохраняя классический подход к описанию поведения электрона в атоме, выдвинул два предположения, которые мы называем постулатами Бора. Физ.смысл этих постулатов не только не мог быть объяснён в классической физике, но, более того, находился в глубоком противоречии с классическим описанием движения электрона в атоме. В современном виде постулаты Бора формулируются следующим образом. Первый постулат (стационарных состояний) Атом может находиться в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. В стационарном состоянии, атом не излучает и не поглощает энергию. Стационарные состояния можно пронумеровать, присвоив им порядковые номера, причём каждому состоянию соответствует определенное дискретное значение энергии. Согласно модели Бора стационарным состояниям атома соответствуют определенные (разрешённые) орбиты, по которым электроны движутся вокруг ядра. При движении по этим орбитам электроны не излучают электромагнитные волны. Первый постулат противоречит нашим представлениям о движении в классической механике, так как мы знаем, что скорость тел изменяется постепенно и может принимать любые значения. Бор вводит понятие квантования скоростей и орбит электрона: скорости и радиусы орбит могут изменяться не непрерывно, а имеют только определённый дискретный набор значений. Второй постулат (правило частот) Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еm в стационарное состояние с меньшей энергией Еn. Энергия излученного фотона равна разности энергий атома в стац.состояниях: 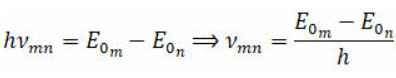 Из формулы следует, что если электрон переходит с более низкой орбиты на более высокую, то он поглощает квант энергии. Если же наоборот, переход осуществляется с более высокой на более низкую орбиту, то электрон излучает квант энергии. Состояние атома, которому соответствует наименьшая энергия, называется основным. А состояния, которым соответствуют большие значения энергии, — возбуждёнными. В основном энергетическом состоянии атом может находиться неограниченно долго, а в остальных стационарных состояниях порядка 10–6 с. Это так называемое время жизни атома в возбуждённом состоянии. Виды спектров Сплошной спектр – в нем представлены все частоты элм излучения и при наблюдении можно видеть сплошную разноцветную полосу Линейчатый (испускания) – чередование цветных линий различной яркости, разделенных тёмными широкими полосами. Его дают все вещества в газообразном атомарном состоянии (поглощения) – на цветной полосе сплошного спектра находятся темные линии. Получают, пропуская белый свет через холодный, неизлучающий газ. Его линии располагаются в тех же местах спектра что и линии в спектре испускания. У каждого химического элемента свой линейчатый спектр поглощения и испускания. Спектральные закономерности Для наглядного представления возможных энергетических состояний атомов используются энергетические диаграммы, на которых каждое стационарное состояние атома отмечается горизонтальной линией, называемой энергетическим уровнем. Ниже всех на диаграмме располагается энергетический уровень, соответствующий основному состоянию (состояния с минимальной энергией). Энергетические уровни возбуждённых состояний располагаются над основным уровнем на расстояниях, пропорциональных разности энергий возбуждённого и основного состояний. Переходы атома из одного состояния в другое изображаются вертикальными линиями между соответствующими уровнями на диаграмме. Направление перехода обозначается стрелкой. Из диаграммы видно, что чем электрон дальше от ядра, тем на меньшую величину отличаются соседние уровни энергии, т.е. густота энергетических уровней растёт. Квантовые скачки при этом уменьшаются, вследствие чего переходы между стационарными состояниями атома всё больше и больше становятся «похожими» на непрерывное изменение энергии, то есть энергия становится почти непрерывной величиной, как и в классической теории. Если попытаться выразить частоту излучения атома водорода при его переходе с одного энергетического уровня на другой, то окажется, что полученное выражение полностью совпадает с эмпирической формулой Бальмера — Ридберга: 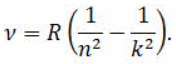 Постоя́нная Ри́дберга — фундаментальная физическая постоянная, используемая в формулах для расчёта уровней энергии и частот излучения атомов. 1885 году – учителю физики Бальмеру удалось получить эту формулу в результате исследования спектра атомарного водорода. По этой формуле могут быть вычислены частоты линий в видимой части спектра водорода. Сейчас их обнаруживают около 30 (для водорода). И учеными обнаружены серии спектральных линий водорода (серия Лаймана (1 – для УФ), серия Бальмера (2 – видимый), серия Пашена (3 – ИК)) Спектральный анализ СА – метод определения химического состава вещества по его спектру Суть: сравнивают спектр исследуемого вещества с известными спектрами др.хим.эл-ов. Использование СА позволило обнаружить новые хим элементы, которые были предсказаны Менделеевым: рубидий, цезий, талий и др. Он широко используется в промышленности – метод контроля: позволяет в металлургии определять состав сплавов и примесей, которые вводятся в Ме для получения материалов с заданными свойствами. Для химического состава руд. Лазеры Излучение бывает самопроизвольным (при этом атомы излучают фотоны разной частоты). процесс самопроизвольного испускания электромагнитного излучения квантовыми системами (атомами, молекулами) при их переходе из возбуждённого состояния в стабильное. (эмиссия это испускание) Так же можно сделать так, чтобы атом, находящийся в возбужденном состоянии излучал энергию под воздействием внешних факторов. Такое излучение называют вынужденным. А как создать вынужденное излучение? Если нет внеш.воздействия, то большая часть атомов находится в невозбужденном состоянии и обладает минимумом энергии. И если перевести атом в возбужденное состояние, то он будет самопроизвольно переходить в состоянии с Е мин, т.к время «жизни» в возб.сост очень мало 10(-8)с. И атом в невозбужденном состоянии – поглощает фотон! Значит нужно увеличить число атомов, которые имеют высокий энергетический уровень. Для этого используют вещества, атомы который могут долго находится в возбужденном состоянии очень долго и при этом не излучать самопроизвольно . И такие вещества способны не только усиливать свет (появляется лавина фотонов), но и генерировать его! И первый такой генератор изобрели наши соотечественники Николай Геннадьевич Басов и Александр Михайлович Прохоров в 1954 году (МАЗЕР). Этот генератор излучал элм волны с длиной волны 1,27 см. Ма́зер (англ. maser) — квантовый генератор, излучающий когерентные электромагнитные волны сантиметрового диапазона (микроволны). Его название — сокращение фразы «Усиление микроволн с помощью вынужденного излучения» (microwave amplification by stimulated emission of radiation) — было предложено в 1954 году американцем Ч. Таунсом, одним из его создателей. 1960 году – в США изобрели первый ЛАЗЕР – оптический квантовый генератор. Обобщенный план
|
