План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Тема лекций №№ 13,14: Строение вещества. I. Строение атома. Вопросы: 1. Доквантовые модели атома (Томсона, Резерфорда, Бора). 2. Современные теории строения атома: - протонно-нейтронная, - квантово-механическая. 3. Радиоактивность: понятие, виды, характеристики. 4. Закономерности заполнения электронных орбиталей атомов. Электронные схема, формулы. Самостятельная работа: 1. Первые (до Томсона) модели атома. 2. Спектры испусканния электронов в полупроводниках, светодиоды. 3. Радиоактивность: понятие, виды, характеристики. I. Строение атома 1. Доквантовые модели атома (Томсона, Резерфорда, Бора). 2. Протонно-нейтронная теория строения атома. N(+11p) = Nпорядковый(хим. элемента) m(+11p) + m(01n) = m (атома), N(+11p) + N(01n) = Ar(атома) Таблица 1. Характеристики основных элементарных частиц атома Элементарная ч-ца Абс.масса, кг Отн. масса, а.е.м. Электр.заряд, Кл Отн.заряд Протон (+11Р) 1,673. 10-27 1,0073 + 1,602.10-19 +1 Нейтрон ( 01n) 1,675.10-27 1,0087 0 0 Электрон (е-) 9,109.10-31 0,00055 - 1,602.10-19 -1 2. Квантово-механическаятеория строения атома. 2.1. Три основополагающие идеи (положения) квантовой механики: 1. Квантование энергии электронов в атоме – принцип дискретности физических величин в микромире (микроявлений и микрообъектов), т.е. физические величины могут изменяться не непрерывно, а скачкообразно, принимая только определенные – дискретные значения. О таких величинах говорят, что они квантуются. Макс Планк (нем. физик,1900 г.): тепловое излучение (абсолютно черного тела) состоит из дискретных порций – квантов энергии. Значение одного кванта энергии ∆E = hν = Eион + Eкин = Eион + mv2/ 2. h (постоянная Планка) – мера дискретности, которая как бы определяет границу между микро- и макромирами. Это одна из фундаментальнейших постоянных природы. Она входит во все квантово-механические соотношения (h = 6,626 .10 -34 Дж .с); ν = с/λ . 2. Двойственная природа (корпускулярно–волновой дуализм) электрона. Луи де Бройль, фр. физик – квантовый механик, 1924 г.: при своем движении электрон (е-), как и др. частицы микромира (микрочастицы), обладает корпускулярно–волновойдвойственностью, т.е. одновременно является и дискретной (отдельной) материальной частицей с массой покоя (m), зарядом (z), размерами, и волной, имея все ее свойства (дифракция, интерференция и др.). Этот постулат выражается уравнением волны де Бройля: λ = h/ mv, т.е.: частице, имеющей массу m и движущейся со скоростью v, соответствует волна длиной λ. Постоянная Планка h связывает воедино корпускулярный и волновой характер движения материи. В одних условиях на первый план выступают волновые свойства объектов, в других – корпускулярные, в третьих – те и другие одновременно. Свободный или связанный электрон нельзя назвать строго ни волной ни частицей. Электрон – это частица, если речь идет о дискретности, но это и волна, если обсуждается характер его движения. Из уравнения де Бройля следует: чем меньше масса материальной частицы и больше ее скорость, тем характернее для нее волновые свойства. Создать наглядную модель микрообъекта принципиально невозможно! 3. Принцип неопределенности Гейзенберга (1927 г.): (Вернер Гейзенберг, нем. физик - квантовый механик): Для электрона, как для любой микрочастицы-волны, в принципе невозможно одновременно с одинаковой точностью измерить координату (местонахождение) и скорость движения (или импульс) - в любой момент времени. Математическим выражением этого принципа является соотношение: ∆x = m .∆v > h / 2π, где ∆x– неопределенность (погрешность измере-ния) положения электрона (любой микрочасти-цы) по оси ОХ, ∆v– неопределенность в измерении его скорос-ти (или импульса ∆р = m.∆v). Чем меньше значение ∆x, т.е. чем точнее определяем положение микрообъекта (в частности, электрона), тем больше неопределенность (ошибка) в определении значения его скорости или импульса, и наоборот. 2.2. Основные особенности квантового состояния электрона и электронной структуры атомов. Движение (состояние) электрона в поле ядер атомов описывают с помощью волн де Бройля, которые в трехмерной, пространственной, системе координат математически отображаются волновой функцией Ψ(x, y, z). Волновые функции Ψ(x, y, z), «пси-функции», функции пространственных координат электрона – это разрешенные квантовые состояния электронов, определяющие энергетические уровни в атомеи области наиболее вероятного нахождения электронов в трехмерном пространстве вокруг атомного ядра. Иначе (образно) волновую функцию Ψ(x, y, z) можно представитькак амплитуду 3-х-мерной электронной волны, точнее – амплитуды колебания вероятного присутствия электрона в данной области пространства. Другими словами, колеблется не сам электрон, а вероятность его обнаружения в данной области атомного пространства. Движение электрона в атоме носит вероятностный характер – этоодин из постулатов квантовой механики, квантовой химии. Наиболее вероятное квантовое состояние электрона – область околоядерного пространства, в котором электрон может находиться в разные моменты времени с максимальной вероятностью (до 98%),– называют атомной электронной орбиталью(АО) или «электронным облаком» - совокупностью различных положений быстро движущегося электрона. Математически АО представляют как Ψ 2(x, y, z).∆V, т.е. как произведение квадрата волновой функции Ψ 2(x, y, z) – плотности вероятности - на элементарный объем атомного пространства ∆V. Волновое уравнение Шредингера (1926 г.): Эрвин Шредингер, австр. физик, предложил уравнение, связывающее энергию одноэлектронного атома водорода с его пространственными координатами (x, y, z) и волновой функцией Ψ(x, y, z),соответствующейамплитуде трехмерного волнового процесса: [δ2 Ψ(x)/ δx +δ2Ψ(Y)/δY2 +δ2Ψ(Z)/δZ2] = = -4 πm/ h [(Eполн – Eпотенц) Ψ(x, y, z)]. Уравнение Шредингера строго не выводится (скорее постулируется, исходя из уравнения двумерной волны де Бройля). Тем не менее оно описывает реальное поведение (состояние) электрона в атоме и позволяет с большой точностью рассчитывать вероятность нахождения электрона в данный момент времени в любой точке пространства, занимаемого атомом. Квантовые числа Решения (корни) уравнения Шредингера содержат постоянные n, l, ml , которые назвали квантовыми числами. Это квантовые дискретные характеристики волновой функции Ψ(x, y, z), описывающие силовое поле околоядерного пространства, в котором может находиться электрон, т. е. его энергетические уровни, подуровни и атомные орбитали. Любое устойчивое состояние электрона в атоме характеризуют определенными значениями 4-х квантовых чисел: n(главное), l(орбитальное), ml (магнитное),ms (спиновое). Каждой АО, т.е. наиболее вероятному квантовому состоянию электрона, соответствует свой набор указанных квантовых чисел. Главное квантовое число nопределяет: а) уровень электронной энергии атомной орбитали и атома, если этот уровень является внешним, наиболее удаленным от ядра; б) номер (расстояние от ядра) данного квантового (энергетического) уровня и атомной орбитали. Квантовое числоnпринимает значения целых чисел, начиная с единицы:n = 1,2,3,…,∞; в) максимально возможное число электронов N(е) на энергетическом уровне:N(е) = 2n2.В атоме на уровне n = 1, например. может быть не более двух электронов,на уровне n = 2 –восьми, наn = 3 – восемнадцати электронов и т.д. Орбитальное квантовое число lпринимает значения целых чисел от 0до (n – 1), характеризуя: а) энергию электронов на подуровне, при этом число n здесь соответствует номеру квантового уровня, на котором впервыепоявляется этот подуровень; б) форму электронной орбитали, АО: s–АО (l = 0) имеет форму сферы, р-АО(l = 1) – форму объемной восьмерки (гантели); d-АО (l = 2) имеет форму четырех объемных лепестков (двух гантелей); f-AO (l = 3) – еще более сложную форму (8 гантелей и других). Магнитное квантовое числоml характеризует магнитный момент электрона при движении по АО и пространственную ориентацию АО, принимая значения: ml= 0, ±1, ±2,…, ±l. Для каждого значения l, таким образом, разрешено (2l +1) значений ml. Все орбитали одного подуровня (n, l = const) имеют одинаковую энергию (энергетически вырождены), но по-разному ориентированы в пространстве магнитного поля ядра относительно друг друга. (рис. Электронные облака) Спиновое квантовое число ms электрона имеет два значения, ±1/2, характеризуя собственный магнитный момент количества движения электрона вокруг ядра атома при одновременном вращении вокруг своей оси в двух взаимно противоположных направлениях. Атомные орбитали, для которых значения l= 0, 1, 2, 3, называют соответственно s-, p-, d-, f-АО. Так же называют и энергетические подуровни: s-, p-, d-, f- подуровни, включающие 1, 3, 5 и 7 соответствующих АО, и химические элементы, образующие s-, p-, d-, f- электронные семейства, в атомах которых валентные электроны заполняют соответствующие подуровни. Например, квантовому состоянию электрона 3s2 (второй электрон на 3s –АО)отвечает набор квантовых чисел: n = 3, l = 0, ml= 0, ms = - ½. 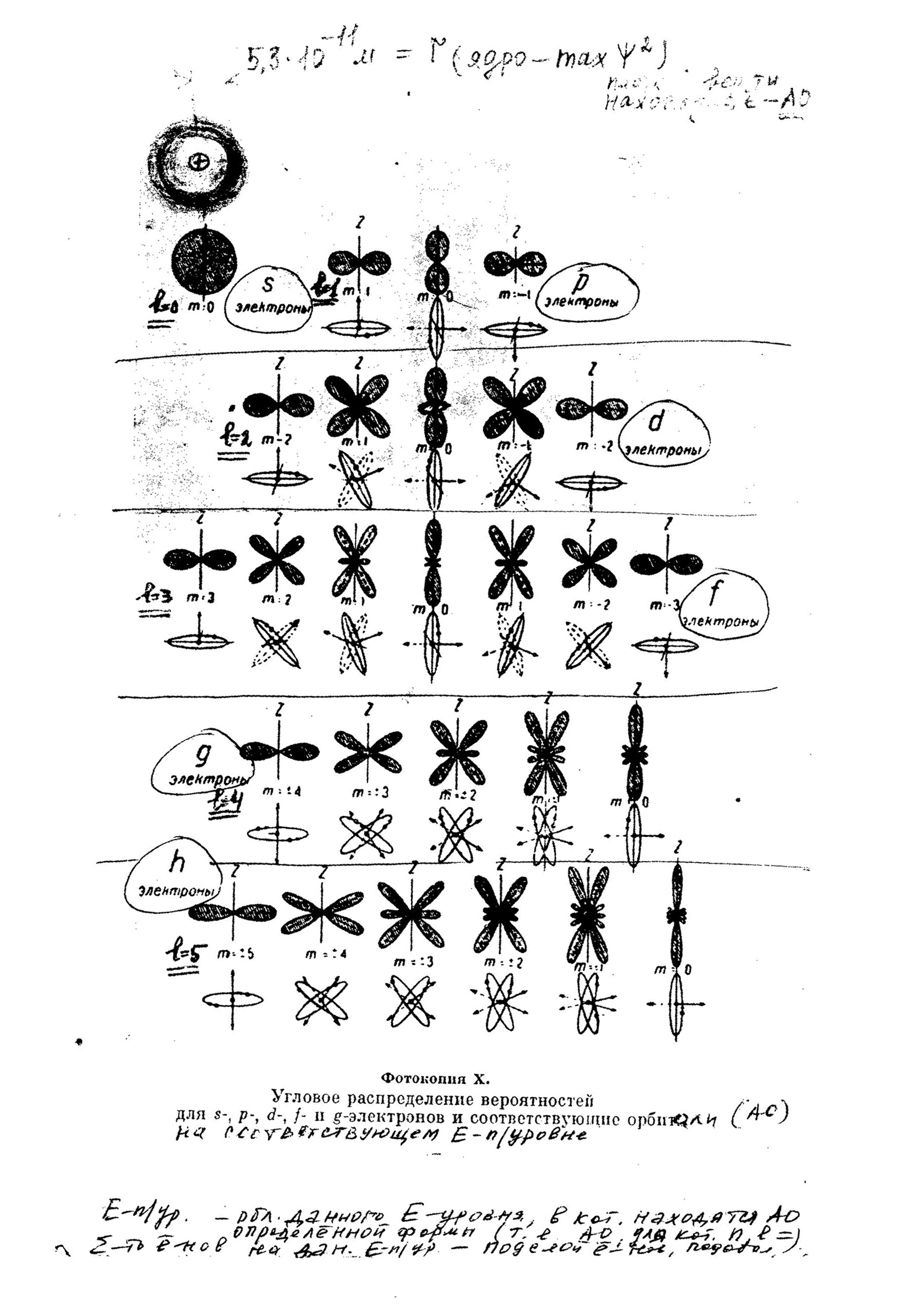 Заполнение энергетических уровней, подуровней и атомных орбиталей подчиняется четырем основным правилам и принципам: 1. Принцип Паули: в атоме не может быть даже двух электронов с одинаковым набором 4-х квантовых чисел. Из этого следует, что каждая АОможет быть занята не более чем двумя электронамис разными по знаку спиновыми квантовыми числами ms, равными+ ½. Такие два электрона называют спареннымиилиантипараллельными (с антипараллельными спинами). 2. Принцип минимальной энергии: устойчивому (невозбужденному) состоянию атома отвечает такое расположение электронов по АО, при котором энергия атома минимальна; АО заполняются в порядке последовательного возрастания их энергий, начиная с первого энергетического (квантового) уровня, n = 1. 3. Правило Клечковского (иначе - «минимального (n + l)») – определяет порядок заполнения электронами АО многоэлектронного атома: заполнение энергетических уровней и подуровней многоэлектронного атома, находящегося в основном (невозбужденном) состоянии, происходит в порядке увеличения суммы главного и орбитального квантовых чисел (n + l), а при равных значениях (n + l) – в порядке возрастания n. Не забываем при этом, что каждому типу подуровня всегда соответствует единственное значение орбитального квантового числа l: ls-АО = 0, lр-АО = 1, ld-АО = 2, lf-АО = 3. Исключения из правила Клечковского - так называемые «провалы электронов»с ns- на (n-1) d-АО - у атомов d-металлов: Cr, Cu, Ag, Au, Mo, Ru, Rh, Pd, Pt - связаны с повышенной устойчивостью атомов в таких состояниях их валентных электронов, когда они заполняют d-подуровень либо наполовину (5 неспаренных электроновс параллельными спинами), либо полностью (10 электронов, т.е. 5 пар электронов с антипараллельными спинами). В свободном атоме d-АО являются большими по размерам и размытыми в пространстве. Когда они заселены электронами наполовину или полностью, то размеры их меньше, орбитали сжаты в пространстве и, как показывают квантово-механические расчеты, их энергия меньше и, значит, выше устойчивость. 4. Правило Гунда («максимального спина», которому подчиняется размещение электронов на АО энергетического подуровня: |
