План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Энергия ионизации количественно характеризует способность атома (иона, молекулы) удерживать электроны, что является важнейшим показателем химической активности, восстановительной способности атома или другой структурной частицы вещества. По мере последовательного отрыва электронов от атома положительный заряд образующегося иона возрастает. Поэтому последовательно возрастает и затрата энергии (потенциал ионизации), необходимой для отрыва электронов. Для многоэлектронных атомов определены последовательные энергии ионизации для отрыва 1-го, 2-го, 3-го и т.д. электронов: I1 < I2 < I3 и т.д. Обычно энергию ионизации определяют, исследуя пределы спектров, т.е. частот волн спектров поглощения или испускания, при которых отдельные линии сливаются в сплошную полосу, что соответствует уходу электрона из поля ядра, его отрыву от атома. Cродство к электрону (Еср) – это энергия, выделяющаяся при захвате электрона свободным атомом, молекулой или радикалом в газовой фазе в основном (невозбужденном) состоянии, превращая их в анионы. Сродство к электрону количественно характеризует склонность атома, молекулы, иона к образованию анионов – окислительную способность определенной частицы, которая для атомов элементов в периодах в общем возрастает слева направо и убывает сверху вниз внутри группы. Величины сродства к электрону точно определены лишь для немногих атомов неметаллов (Н, С, О, S, I, Cl, F и др.), а для молекул и радикалов недостаточно надежны. Прямое вычисление сродства к электрону атомов выполняют по формуле: Еср = h . c/лямбда0, где лямбда0 – длина световой волны, соответствующей порогу фотоотрыва электрона от аниона. Электроотрицательностью (ЭО) называют величину энергии притяжения валентных электронов атомом элемента в сложных соединениях. Известны разные способы расчета электроотрицательности. Способность атома притягивать к себе электронную плотность другого атома при взаимодействии с ним зависит как от его энергии сродства к электрону, так и от способности другого атома отдавать электрон, т.е. от его энергии ионизации, поэтому почти все существующие способы приближенного расчета ЭО основаны на соотношении между этими двумя величинами. Например, по Малликену, ЭО (Х)– это полусумма энергий ионизации (I) и сродства к электрону (Еср): Х = Поскольку энергия сродства к электрону определена не для всех элементов, а для других получены неточные ее значения, чаще используют величины относительной электроотрицательно-сти (ОЭО) атомов – электроотрицательности, рассчитанной по отношению к ЭО какого-либо активного металла, принятой за единицу: лития (шкала Полинга), кальция (шкала Малликена) или актиния (шкала Оллреда-Рохова). В большинстве случаев энергия ионизации атома существенно выше его сродства к электрону, поэтому закономерность периодической зависимости ЭО от заряда ядра примерно такая же, как для энергии ионизации: электроотрицательность возрастает в Периодической Системе в направлении слева направо для элементов каждого периода и уменьшается сверху вниз для элементов одной и той же группы. Чем выше электроотрицательность элемента, тем сильнее проявляются его окислительные и неметаллические свойства, поэтому самыми сильными окислителями являются неметаллы с практически самой высокой электроотрицательностью (теоретически ЭО выше только у инертных газов гелия и неона, ОЭО которых соответственно равны 5,5 и 4,8 по шкале Оллреда-Рахова), фтор (ОЭО ≈ 4,0) и кислород (ОЭО ≈ 3,5), а самыми слабыми – наиболее активные металлы–восстановители с наименьшей электроотрицательностью: франций и цезий (их ОЭО ≈ 0,8). Значениями ОЭО пользуются обычно для приближенной теоретической оценки «металличности – неметалличности» или амфотерности элемента, а также полярности химической связи между атомами: значения ОЭО (наиболее активных металлов) = 0,7 - 1,3; ОЭО (неметаллов) = 1,8 – 5,5; ОЭО (амфотерных металлов) имеют значения, по разным данным (шкалам Оллреда-Рахова, Полинга или Малликена), в диапазоне от 1,3 - 1,5 до 1,8 - 2,4. Лекция № 14 Тема: Строение вещества II. Химическая связь Вопросы: 1. Определение, типы и количественные характеристики химической связи. 2. Основные доквантовые теории химической связи. 3. Ковалентная связь: определение, свойства. Квантово-механические методы ее образования: валентных связей (МВС) и молекулярных орбиталей (ММО). 4. МВС. Механизмы образования ковалентной связи: обменный, донорно-акцепторный и дативный. Простые (сигма-) и кратные (пи-, дельта-) связи. Делокализация связи. Полярность связи. Образование молекул по МВС. 5. ММО ЛКАО: основные положения, энергетические диаграммы МО образования гомо- и гетероядерных молекул элементов 1-го и 2-го периодов. Сравнение (достоинства и недостатки) методов ВС и МО ЛКАО. 7. Взаимодействие между молекулами в реальных газах и веществах в конденсированном состоянии. Типы межмолекулярного взаимодействия: силы Ван-дер-Ваальса (три составляющих), ион-дипольное, водородные связи. Основные характеристики данных типов связи, примеры. 8. Особенности химической связи в комплексных и супрамолекулярных соединениях, теории связи. Самостоятельная работа: 1. Явление гибридизации химических связей. Пространственная структура (конфигурация) молекул. 2. Ионная связь: определение, основные свойства. Явление поляризации связи. 2. Металлическая связь. Зонная теория структуры металлов, полупроводников и диэлектриков. 3. Взаимодействия между веществами в различных агрегатных состояниях: газообразном и конденсированных (жидком и твердом), особенности их свойств. Молекулярно-кинетические теории газов и жидкостей. Понятия давления насыщенного пара, температуры кипения, вязкости, сверхтекучести и поверхностного натяжения жидкости. Жидкие кристаллы. 4. Твердые вещества в аморфном и кристаллическом состояниях, особенности их свойств. Типы кристаллических структур веществ и их свойства. Понятия изо- и полиморфизма. Кристаллы с несколькими типами химической связи. Соединения класса клатратов: слоистые (интеркаляты), газовые гидраты и др. Реальные кристаллы. Типы дефектов в кристаллах. Ионная и суперионная проводимости. Соединения переменного состава (нестехиометрические) и явление сверхпроводимости. Из рабочей программы 1. Развитие представлений о химической связи. Количественные параметры химической связи на основе квантово-механической теории: энергия и длина связи, валентный угол, эффективный заряд и степень окисления атома в молекуле. Типы химических связей. 2. Ковалентная связь: понятие, свойства, описание механизмов образования метода ми квантовой механики, валентных связей (МВС) и молекулярных орбиталей (ММО). Кратность и порядок связи. Локализованные и делокализованные связи. Понятие гибридизации атомных орбиталей. Пространст венные конфигурации молекул. Явление поляризации атомов и ионов. Полярность связи и молекулы. 3. Ионная, металлическая, водородная связи, их образование и свойства. 4. Типы межмолекулярных взаимодействий. 5. Химическая связь в комплексных соединениях. Комплементарность: понятие и значение в процессах образования высококоординированных супер- и супрамолекулярных наноструктурных веществ и материалов. 6. Агрегатные (физические) состояния веществ: газообразное (идеальные и реальные газы, уравнения их состояния, состав земной атмосферы, воздуха), плазменное, конденсированные жидкое (в том числе - жидкокристаллическое) и твердое (аморфное и кристаллическое),– особенности их структуры и свойств. Типы кристаллов, химических связей и свойства твердых веществ. Лекция № 14 Тема: Строение вещества II. Химическая связь Вопросы: 1. Определение, основные типы и природа химической связи. Количественные характеристики связи на основе квантово-механической теории: энергия, длина связи, валентный угол. 2. Ковалентная связь. Свойства ковалентной связи: насыщаемость, направленность. Квантово-механические методы описания ковалентной связи: валентных связей (МВС), молекулярных орбиталей (ММО ЛКАО). Полярность: связи, молекул. 2.1. Механизмы образования связи по МВС: обменный, донорно-акцепторный. 2.2. Особенности химической связи в комплексных соединениях. 2.3. Теория валентности в МВС. Кратность связи (простые (сигма-) и кратные (пи-, дельта-) связи). 2.4. Гибридизация связи: понятие, типы. Пространственная структура молекул. 2.5. ММО ЛКАО: связывающие и разрыхляющие МО, энергетические диаграммы МО. Порядок связи. Магнитные свойства молекул. 2.6. Сравнение (достоинства и недостатки) методов ВС и МО ЛКАО. 3. Ионная связь и ее свойства: ненаправленость, ненасыщамость. 4. Металлическая связь:. 5. Водородная связь. 6. Межмолекулярные взаимодействия: ион-дипольные, водородные и невалентные - Ван-дер-Ваальса (3 типа). 7. Агрегатные состояния веществ (газообразное и конденсированные), особенности их строения и свойств. Диаграммы состояния. Самостоятельная работа: 1. Явление гибридизации химических связей. Пространственная структура (конфигурация) молекул. 2. Металлическая связь: применение метода МО в зонной теории структуры и свойств металлов, полупроводников и диэлектриков. 3. Молекулярно-кинетические теории газов и жидкостей. Жидкие кристаллы. Понятия: давление насыщенного пара, температура кипения, вязкость, сверхтекучесть и поверхностное натяжение жидкости. 4. Твердые вещества в аморфном и кристаллическом состояниях, особенности их свойств. Типы кристаллических структур веществ и их свойства. Понятия изо- и полиморфизма. Кристаллы с несколькими типами химической связи. Супер- и супрамолекулярные соединения класса клатратов: слоистые (интеркаляты), газовые гидраты и др. Реальные кристаллы. Типы дефектов в кристаллах. Ионная и суперионная проводимости. Соединения переменного состава (нестехиометрические) и явление сверхпроводимости. 5. Диаграммы состояния одно- и двухкомпонентных систем. Диаграммы плавкости. __________________________________________________________________________ Химическая связь 1. Определение, основные типы и природа химической связи. Количественные характеристики химической связи на основе квантово-механической теории. Без представлений о природе связей в химических соединениях невозможно объяснить причину образования того или иного соединения, механизм химического процесса и причину реакционной способности частиц вещества. Совокупность химически связанных атомов представляет собой сложную систему атомов, ядер и электронов. Между этими носителями зарядов действуют электростатические силы притяжения и отталкивания. Единственным критериемхимического взаи-модействия атомов, ионов и молекул является изменение строения (перестройка) их внешних электронных оболочек. Современная теория химической связи (квантово-механическая теория) основана на положении, что химическая связь осуществляется только в том случае, если при сближении частиц(двух или большего числа) возрастает электрон-ная плотность в межъядерном пространстве их атомов, и общая энергия системыуменьшается. - Не известно ни одного экспериментального факта, противоречащего этому утверждению! Таким образом, образование химической связи всегда сопровождаетсявыделением энергии. Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их атомных орбиталей (электронных облаков) с увеличением электронной плотности в пространстве между ядрами и уменьшениемполной энергии новой системы. Основные количественные характеристики химической связи по квантово-механической теории: энергия, длина связи, валентный угол Энергия химической связи Есв- это количество энергии, выделяющейсяпри образовании хими-ческой связи илитребующейсядля ее разрыва. Разрывхимической связивсегдатребуетзатраты энергии. Чем больше энергия химической связи, тем устойчивее химическое соединение. Длина связи l – это межъядерное расстояние взаимодействующих атомов. Длина связи зависит от размеров электронных оболочек атомов и степени их перекрывания. Увеличениеразмероватомов в соединениях приводит: к > -ниюмежъядерного расстояния - длины связии к< -ниюэнергии связи и, значит, устойчивости химических соединений. Валентный угол – это угол между двумя ковалентными связями, образованными одним атомом с двумя другими атомами. Природа химической связи (по современным представлениям) – единая – электрическая, но осуще-ствляется связь по-разному. Химическая связь всегда возникает как результирующая сила между куло-лоновским (электростатическим) притяжением противоположных заря-доватомных ядер и электронов, -с одной стороны, и отталкиванием одноименно заряженных ядер и электронов друг от друга – с другой. Правило октета: В результате образования валентной химической связи атомы стремятся приобрести 8-электронную конфигурацию валентных электронов, как у благородных газов (2-электронную у Не). 2. Типы химической связи Силы, связывающие атомы друг с другом, имеют единую электрическую природу. Но вследствие различия в механизме образования и проявления этих сил химические связи могут быть разного типа. Различают три основных типа валентной химической связи: ковалентную, ионную и металлическую. Кроме них, большое значение и распространение имеют: водородная связь, которая может быть валентной и невалентной, и невалентная химическая связь - межмолекулярная (или Ван-дер-Ваальсова), образующая относительно небольшие ассоциаты молекул и огромные молекулярные ансамбли – супер- и супрамолекулярные наноструктуры. Ковалентная химическая связь (атомная, гомеополярная) – это химическая связь, осуществляемая общими для взаимодействующих атомов одной-тремя парами электронов. Эта связь – двухэлектронная и двухцентровая (связывает 2 атомных ядра). При этом ковалентная связь является наиболее распространенным и наиболее общим типом валентной химической связи в бинарных соединениях – между а) атомами неметаллов и б) атомами амфотерных металлов и неметаллов. Примеры: Н-Н (в молекуле водорода Н2); четыре связи S-О (в ионе SО42-); три связи Аl-H (в молекуле АlH3); Fe-S (в молекуле FeS) и др. Особенности ковалентной связи – ее направленность и насыщаемость. Направленность- важнейшее свойство ковалентной связи, от которого зависит структура (конфигурация, геометрия) молекул и химических соединений. Пространственная направленность ковалентной связи определяет химическое и кристаллохимическое строение вещества. Ковалентная связьвсегда направлена в сторону максимального перекрывания атомных орбиталей валентных электронов взаимодействующх атомов, с образованием общего электронного облака и наиболее прочной химической связи. Направленность выражают в виде углов между направлениями связи атомов в молекулах разных веществ и кристаллах твердых тел. Насыщаемость – это свойство, отличающее ковалентную связь от всех других видов взаимодействия частиц, проявляющееся в возможности атомов образовывать ограниченное число ковалентных связей, поскольку каждая пара связующих электронов образуется лишь валентными электронами с противоположно ориентированными спинами, число которых в атоме ограничено валентностью, 1 – 8. При этом запрещается использование одной и той же атомной орбитали дважды для образования ковалентной связи (принцип Паули). Валентность – это способность атома присоединять или замещать определенное число других атомов с образованием валентных химических связей. По спиновой теории ковалентной связи валентность определяется числом неспаренных электронов у атома в основном или возбужденном состоянии. Таким образом, у разных элементов способность к образованию определенного числа ковалентных связей ограничена получением максимального числа неспаренных электронов в возбужденном состоянии их атомов. Возбужденное состояние атома – это состояние атома с полученной им извне дополнительной энергией, вызывающей распаривание антипараллельных электронов, занимавших одну атомную орбиталь, т.е. переход одного из этих электронов из спаренного состояния на свободную (вакантную) орбиталь того же или близкого энергетического уровня. Например, схемызаполнения s-, р-АО и валентность (В) у атома кальция Са в основномивозбужденном состоянии следующие: С 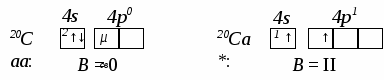 ледует отметить, что атомы с насыщенными валентными связями могут образовывать дополнительные ковалентные связи по донорно-акцепторному или иному механизму (как, например, в комплексных соединениях). Ковалентная связьможет быть полярной и неполярной. Ковалентная связь неполярна, если обобществленные валентные электроны равномерно распределены между ядрами взаимодействующих атомов, область перекрывания атомных орбиталей (электронных облаков) притягивается обоими ядрами с одинаковой силой и поэтому максимум общей электронной плотности не смещен ни к одному из них. Этот вид ковалентной связи осуществляется в случае соединения двух одинаковых атомов элемента. Ковалентную связь между одинаовыми атомами называют также атомной или гомеополярной. Полярная связь возникает при взаимодействии двух атомов разных химических элементов, если один из атомов за счет большего значения электроотрицательности сильнее притягивает валентные электроны, и тогда общая электронная плотность более или менее смещается в сторону этого атома. При полярной связи вероятность нахождения электрона у ядра одного из атомов выше, чем у другого. |
