План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Тема: Химическая кинетика. Химическое равновесие . Вопросы: 1. Понятия скорости гомогенной и гетерогенной химических реакций. Факторы, влияющие на скорость реакции: 1) концент-рации веществ; 2) давление; 3) температура; 4) катализатор, ингибитор; 5) природа веществ и их агрегатное состояние. 2. Влияние концентрации (давления) реагирующих веществ на скорость реакции. Закон действующих масс (ЗДМ) – основной закон химической кинетики (Гульдберг и Вааге, 1864-67 г.г.) – а) для элементарных химических реакций и б) для состояния химического равновесия (в закрытых или обратимых системах). Константа скорости реакции. Понятия молекулярности и порядка химической реакции. 3. Методы расчета и регулирования скорости химической реакции. 4. Влияние температуры на скорость реакции. Правило Вант-Гоффа и уравнение Аррениуса. 5. Механизмы химических реакций. Стадийность процессов. Лимитирующая стадия. Простые (элементарные) и сложные процессы: последовательные, параллельные, сопряженные и др. 6. Химическое равновесие (истинное и кажущееся). Связь между изменением энергии Гиббса и константой равновесия. Уравнения изотермы и изобары химической реакции. Уравнения Клаузиуса-Клапейрона, Вант-Гоффа. Влияние изменения внешних условий на состояние химического равновесия. Принцип Ле Шателье – Брауна. Самостоятельная работа: 1. Определение константы скорости, скорости и времени протекания химических реакций 1-го и 2-го порядков. 2.Теория активации (активного комплекса) С.Аррениуса. 3. Явление катализа. Катализаторы, ингибиторы и механизм их воздействия. 4. Скорость гомогенной и гетерогенной химических реакций. 1. Средняя скорость гомогенной химической реакции v- измеряется изменением концентрации СМ (моль/л) реагирующего вещества в единицу времени:v- = + ∆С /∆t = +C2 – C1 / t2 – t1 Мгновенная скорость реакции, т.е. скорость в конкретный момент времени, определяется наклоном касательной (tg α) к кривой зависимости «С – t» в интересующий нас момент времени. Для простоты истинную мгновенную скорость на-зывают скоростью реакции. Cкорость любой химической реакции зависит, прежде всего, от природы реагирующих веществ, а также от условий протекания реакции: концентрации реагентов или давления (газов), температуры реакционной системы, Химическая реакция может быть простой – одностадийной (элементарной)или сложной – многостадийной, протекающейчерез ряд элементарных реакций. Элементарная реакция – единичный акт изме-нения состояния реакционной системы, т.е. взаимодействия реагирующих частиц (причем их количество выражают только целым числом, 1-3). Если элементарная реакция обратима, то она характеризует протекание 2-х элементарных реакций: в прямом и обратном направлениях. Основным законом химической кинетики является закон действующих масс Гульдберга и Вааге (1867 г.) – ЗДМ. Для односторонней (прямой или обратной) реакции ЗДМ формулируется так: «Скорость элементарной химической реакции при заданной температуре прямо пропорцио-нальна концентрациям реагирующих веществ в степенях, равных числу взаимодействующих частиц (или их количеству, в молях)». Математическое выражение этого ЗДМ для реакции типа aА + вВ = сС + dD: v = ks CaM (A) CвМ (В) Это уравнение называют ещекинетическим уравнением иликинетическим законом дей-ствующих масс. Химическое равновесие В состоянии равновесия состав реакционной смеси определяется концентрациями растворен-ных или газообразных веществ (например, в систе-ме А Отношение концентраций СВ/СА выражают константой равновесия (КС) : КС = СВ/СА. Если реагенты А и В - газообразные, то константу равновесия (Кр) можно выразить через соотношение равновесных парциальных давлений газов: Кр = рВ / рА, где рА и рВ – парциальные давления газообразных веществ А и В. УЧЕБНО-МЕТОДИЧЕСКОЕ И ИНФОРМАЦИОННОЕ ОБЕСПЕЧЕНИЕ дисциплины «ХИМИЯ» Основная литература: 1. Коровин Н.В. Общая химия: Учебник для технических направлений и специальностей вузов.– М.: Высшая школа, 2006. – 556[4] с.: ил, табл.– (Победитель конкурса учебников). 2. Гельфман М.И. Физическая химия: Уч. пособие. – Томск: Томский межвузовский центр дистанционного образования, 2003. – с. ( 42 экз.). 3. Ковалевич О.В. Коллоидная химия: Учебное пособие. – Томск: Томский межвузовский центр дистанционного образования, 2003. – 96 с. (55 экз.). Дополнительная литература: 1. Чикин Е. В. Химия: Учебное пособие/ Федеральное агентство по образованию, Томский государственный университет систем управления и радиоэлектроники, Кафедра радиоэлектронных технологий и экологического мониторинга. – Томск: ТУСУР, 2005, 2012. – 190 с. (115 экз.). 2. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов; ред.: В. А. Рабинович, Х. М. Рубина. – Изд. стереотип. – М.: Интеграл-Пресс, 2002. – 240 с.: ил, табл.. – ISBN (43 экз.) 3. Угай Я.А. Общая и неорганическая химия.- М.: Высшая школа, 2004. – 526 с. 1989. – 463 с. (6 экз.) 4. Денисов В.В., Дрововозова Т.И., Лозановская И.Н. и др. Химия. – М.- Ростов-на-Дону: Издат.центр «МарТ», 2003. – 460 с. (для экологов) 5. Адамсон Б.И. и др. Задачи и упражнения по общей химии./ Под ред. Н.В.Коровина. –М. – Высшая школа, 2003, 2004. – 253 с. (12 экз.) 6. Глинка Н.Л. Общая химия. - М.: Химия, 1988.- 702 с. (216 экз.) 7. Цитович И.К. Курс аналитической химии.- М.: Высшая школа, 1977.- 496 с. 8. Мануйлов А.В., Родионов В.И. Основы химии. - Интернет – учебник. www. hemi. ru / index.htm. 9. Б.Б. Дамаскин, О.А. Петрий, Г.А. Цирлина.- Электрохимия. – Издательство «Химия», М., 2001 г. 10. Б.Б. Дамаскин, О.А. Петрий. Электрохимия.- Издательство «Высшая школа», М., 1987 г. Программное обеспечение: Microsoft Exel, CambridgeSoft ChemOffice, http://www.chemicsoft.ru Базы данных, информационно-справочные и поисковые системы: http//www.chemicsoft.ru – база данных по химии; http//www.chemistry.narod.ru, http//www.xumuk.ru – информационно-справочные ресурсы; http//www.elibrary.ru – научная электронная библиотека; http//www.twirpx.com – электронные книги по химии. Содержание дисциплины «Химия» Виды аудиторных занятий: лекции, практические (семинары), лабораторные занятия (50%), Самостоятельная работа студентов - СРС (50%) Темы дисциплины:
Содержание лекций Лекция № 1 (2 часа)
Вводные замечания 1. Порядок работы: - контрольные – разбор контрольных – переписывание - итоговая оценка -практикум – 1) устный опрос, 2) активное участие в решении задач на занятиях, 3) работа у доски ; 4) домашняя подготовка к лабораторным работам, 5) выполнение всех лабораторных работ и своевременная защита отчетов по лаб. работам (до следующей лаб. работы) -индивидуальные задания (4 ИЗ) – своевременная сдача (через 2 недели после получения) 2. Учебные материалы: - подготовка к контрольным – лекционные конспекты, практические занятия - учебники и методические разработки - справочные данные - и библиотека!!!! Структура важнейших отраслей экономики и примерная доля химического производства в них 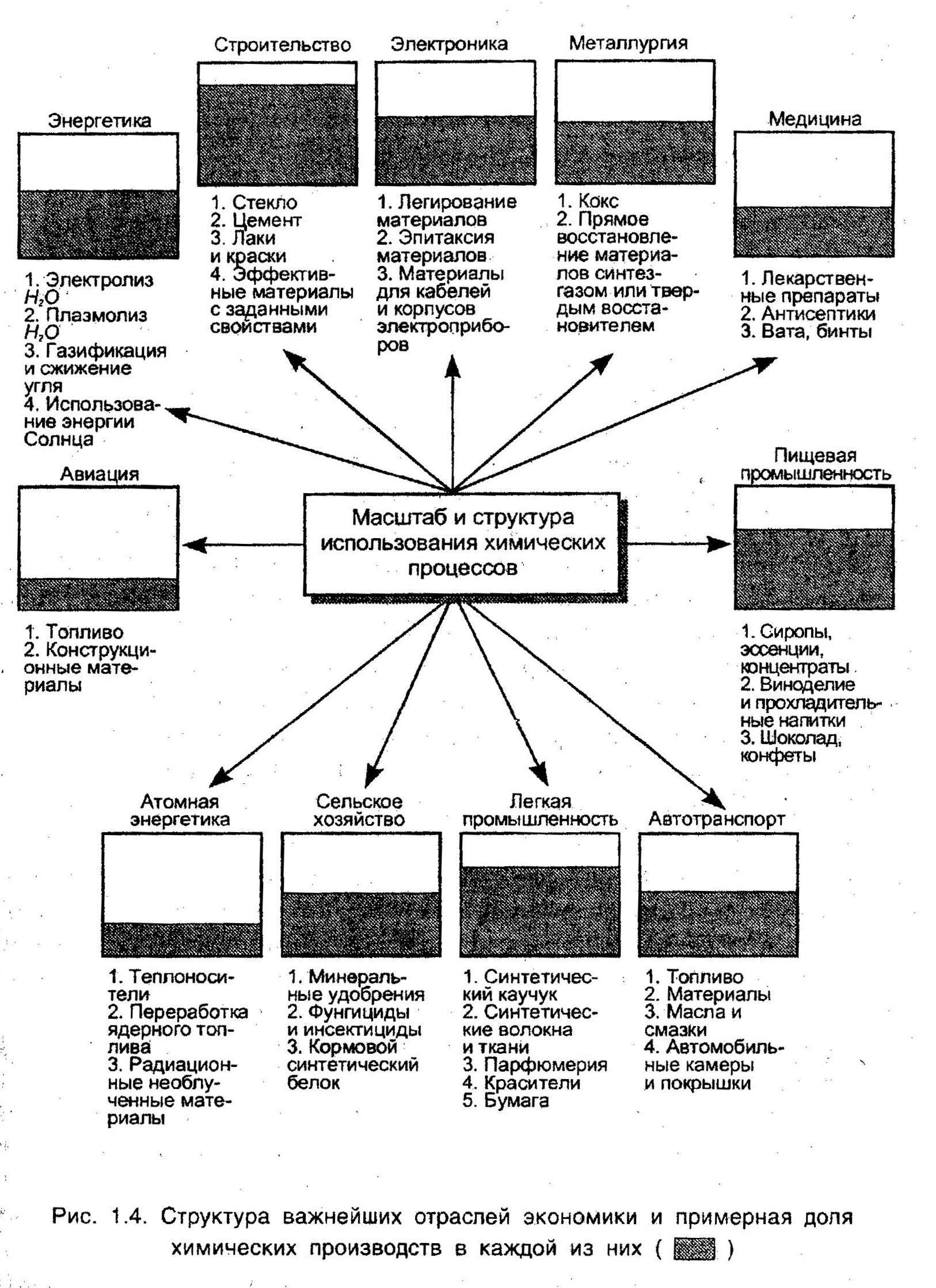 Структура организации материи 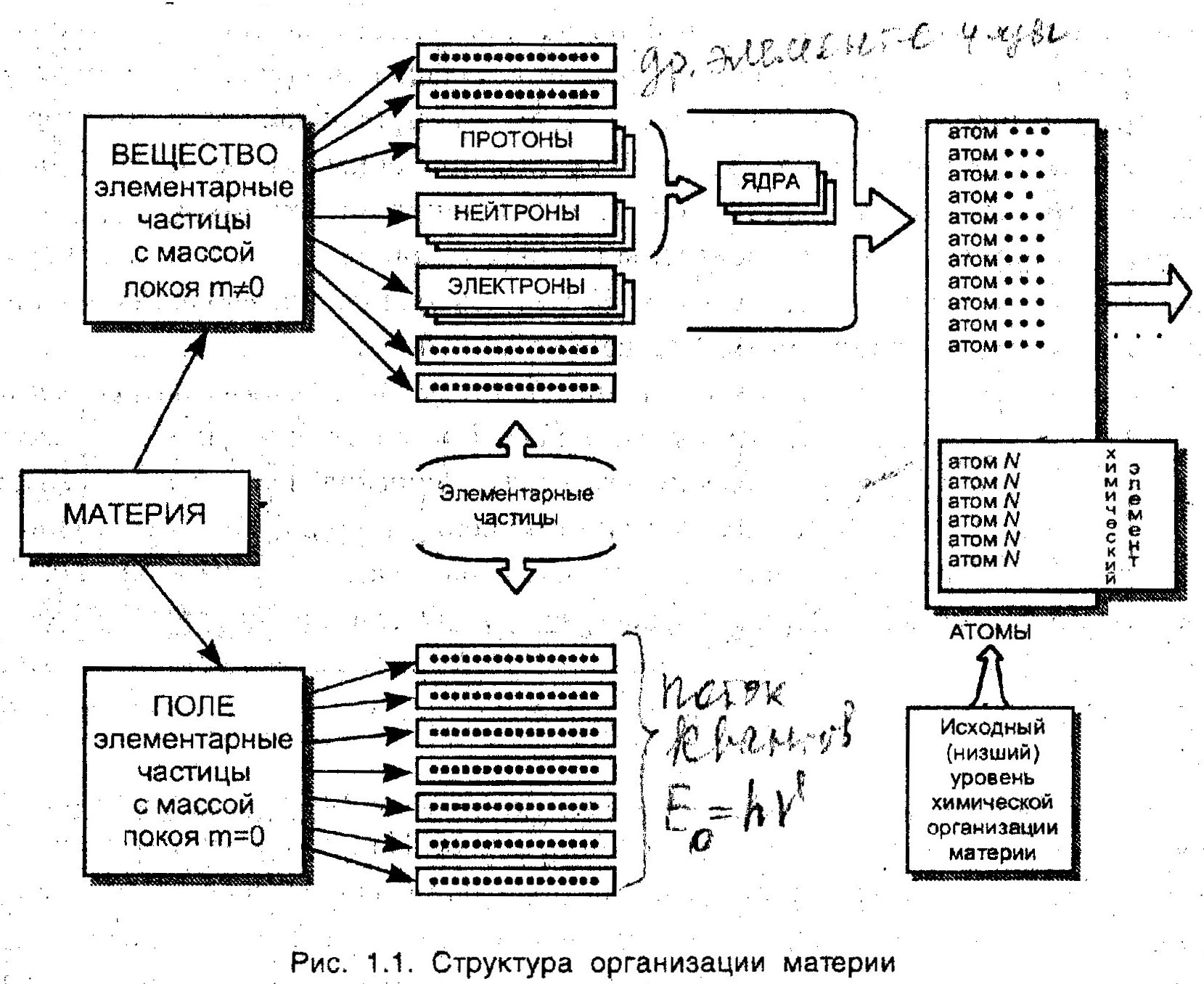 Атомно-молекулярное учение (АМУ) (др-греч. философ Демокрит (≈ 460-430 гг. до Р.Х.), М.В.Ломоносов (1748 г.), Антуан Лоран Лавуазье (≈1774 г.), Джон Дальтон (1802-1808 гг.), Роберт Бойль (≈1673 г.), Жозеф-Луи Пруст (≈1808 г.) В основе АМУ – принцип дискретности (прерывности) материи (строения вещества и распространения энергии): Всякое вещество не является чем-то сплошным, но состоит из отдельных, очень малых частиц, а энергия распространяется не непрерывным потоком, а отдельными порциями – квантами, фотонами (свет), энергия которых кратна hν (Е 1 кванта, = hν). 1фотона Тема: Основные теории и законы химии. Стехиометрия и основныестехиометрические законы химии. Вопросы: 1. Основные теории и законы химии: АМУ, ПЗ, теория строения Бутлерова А.М. 2. Понятие стехиометрии. Основные стехиометрические законы химии: 1) сохранения массы веществ и энергии; 2) постоянства состава и 2 следствия из него; 3) эквивалентов; 4) кратных отношений.- cамостоятельно 3. Газовые законы (стехиометрические): 5) Авогадро и основные следствия из него; 6) объемных отношений – «химический» закон Гей-Люссака); 7) Бойля-Мариотта и 2 следствия из него; 8) Гей-Люссака; 9) Шарля; 10) Клапейрона – Менделеева – основной (объединенный) закон идеального газового состояния; 11) Дальтона – парциальных давлений. Самостоятельная работа: 1. Дальтониды и бертоллиды. 2. Молекулярно-кинетическая теория газов (МКТ) и выводы из нее. 2. Варианты форм Периодической Системы. К основным стехиометрическим законам химии 1. Закон постоянства состава химических соединений (Ж.-Л.Пруст, 1808): Каждое химически чистое соединение молекулярного строения всегда имеет один и тот же постоянный состав, независимо от способа его получения и места нахождения. Например, вода, полученная в различных химических реакциях и взятая из разных мест и источников, имеет один и тот же качественный (элементный) и количественный состав, выражаемый единой молекулярной формулой, Н2О: Согласно закону постоянства состава индексы в молекулярной формуле вещества, определяющие количества атомов химических элементов, входящих в состав молекулы, всегда постоянны и целочисленны. Подчеркиваем, что этот закон относится только к молекулярнымсоединениям (дальтонидам). Исследования в области физики твердого тела и теории реальных кристаллов показывают, что существует много веществ кристаллической структуры с переменным составом. Например, оксид титана в зависимости от давления кислорода может иметь состав от TiO0,5до TiO1,35. Такие соединения были названы бертоллидами в отличие от дальтонидов, в которых закон постоянства состава соблюдается. Соединения с нарушенным стехиометрическим составом, как правило, обладают полупроводниковыми свойствами. Например, Cu2O0,9– является полупроводником с n–типом проводимости. Количественный состав и свойства бертоллидов, соединений с нарушенным стехиометрическим составом, зависят от способа и условий их получения (давление, температура, состав реакционной системы). 2. Закон эквивалентов (И. Рихтер, 1793): Вещества взаимодействуют между собой и образуются в эквивалентных количествах, т.е. пропорциональных их эквивалентам; при этом массы вступающих в реакцию веществ относятся друг к другу как их эквивалентные массы, т.е.:m(1)/m(2) = МЭ(1)/МЭ(2) Таким образом, зная массу одного из вступивших в реакцию веществ, можно определить массу другого прореагировавшего вещества, предварительно рассчитав эквивалентные массы обоих веществ. Для химических реакций с участием газообразных веществ (в условиях, близких к нормальным) закон эквивалентов формулируют несколько иначе: Отношения масс и молярных эквивалентных масс газообразных веществ пропорциональны отношениям их объемов (V) и молярных эквивалентных объемов (VЭ), т.е.: m(1)/m(2) = МЭ(1)/МЭ(2) = V(1)/V(2) = VЭ(1)/VЭ(2). ___________________________________________________________________ Для понимания закона эквивалентов необходимо ввести основополагающие термины и понятия, позволяющие использовать его. 1. Эквивалент вещества (или элемента в химическом соединении)- это: а) такое его количество (моль), которое способно взаимодействовать с одним эквивалентом (1 моль атомов) водорода в кислотно-основных, ионообменных реакциях или с одним эквивалентом (1моль) электронов в окислительно-восстановительных реакциях. (Это определение эквивалента имеет больший физический смысл, чем следующее, известное (предложенное ИЮПАК), не противореча ему) б) эквивалент – это условная или реальная частица, способная присоединять, замещать или каким-либо иным образом взаимодействовать с одним атомом водорода в кислотно-основных (ионообменных) реакциях или с одним электроном в окислительно-восстановительных реакциях. 2. В общем случае эквивалент (Э) любого вещества Х (элемента Х) определяют как Э(Х) = 1моль(Х)/пЭ (Х), где пЭ— число эквивалентов, иначе, число молей эквивалентов, содержащихся в одном моле вещества (или атомов элемента). Величина, обратная числу эквивалентов) — фактор эквивалентности fЭэтого вещества (элемента): fЭ = 1/пЭ. Фактор эквивалентности показывает, какую |
