План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Задача 6. Энергия ионизации () атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, а энергия сродства к электрону (Е) 3,45 и 3,61 эВ. Для какого из этих элементов более характерно образование ионных соединений? Указать знак заряда ионов галогенов в этих соединениях. Решение. Степень ионности возрастает с увеличением электроотрицательности, которая может определяться как полусумма энергий ионизации и сродства: ЭО = 1/2 (I + Е). Определим электроотрицательность для F и Cl: ЭО (F) = ½ (17,4 + 3,45) = 10,425, эВ; ЭО (Cl) = ½ (13 + 3,61) = 9,805, эВ. Поскольку электроотрицательность F выше, чем Cl, то для F более характерно образование ионных соединений. Знак заряда ионов у обоих элементов (–), т.к. внешней р–орбитали их атомов, расположенных в VIIA-группе Периодической системы, до полного заполнения не хватает одного электрона, и с его добавлением каждый из этих атомов превращается в отрицательный ион. Задача 7. Показать энергетическую диаграмму F2 методом молекулярных орбиталей (МО), то есть расположить электроны на МО в молекуле F2. Решение. Молекула F2 состоит из двух атомов, в ней 18 электронов. Реакцию образования молекулы F2 из атомов Fи распределение электронов, соединяющихся атомов на МО можно записать следующим образом (см. раздел 3.1.1, ММО): Энергетическая диаграмма МО для молекулы F2 представляется в виде: Электронно-графические формулы (для валентных подуровней – снизу вверх, от s-кр-). АО (атома F) МО (молекулы F2) АО (атома F) 2s22р5 (2sсв)2(2s*)2(2русв)2(2рzсв)2(2рхсв)2(2ру*)12s22р5 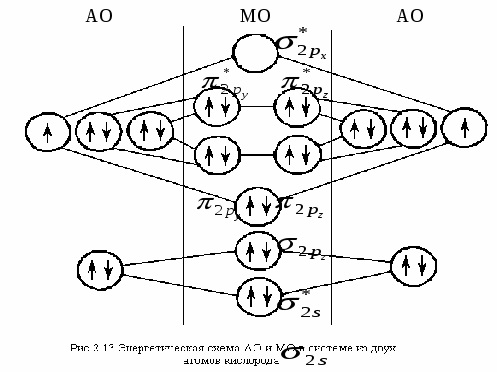 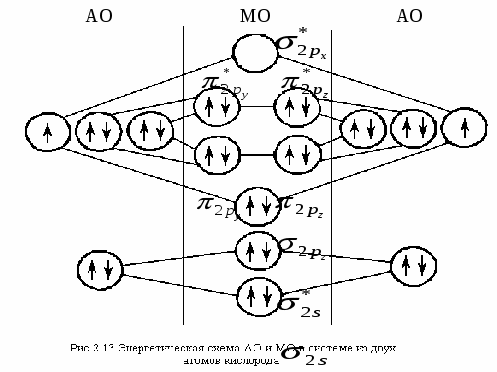 Задача 8. Объяснить механизм образования молекулы SiF4 и иона Решение. а) Электронная формула атома Si14: 1s2 |2s22р6|3s23р23d0. Заполнение АО в невозбужденном состоянии может быть представлена следующей электронно-графической формулой, схемой: П 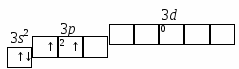 ри возбуждении атом Si переходит в состояние: 1s2 |2s22р6|3s13р33d0, а электронно-графическое строение его валентных орбиталей имеет вид: Н 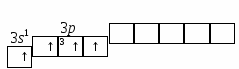 еспаренные электроны возбужденного атома Si могут участвовать в образовании черырех ковалентных связей по обычному обменному механизму с sр3 – гибридизацией атомов Si с атомами F (1s2 |2s22р5), имеющими по одному неспаренному электрону. В результате образуется молекула SiF4. Для образования иона б) Углерод (1s2 |2s22р2) может образовать соединение СF4 подобно кремнию, но при этом валентные возможности углерода будут исчерпаны (нет неспаренных электронов, неподеленных пар электронов и вакантных орбиталей на валентном уровне). Поэтому ион Лекция № 9. Тема: Окислительно-восстановительные реакции (ОВР). Вопросы: 1. Классификации химических реакций. Типы уравнений реакций. Окислительно-восстановительные реакции (ОВР), их типы и распространенность в природе. ОВ-свойства химических элементов и соединений. Понятия окислителя и восстанови-теля. Алгоритмы составления уравнения ОВР двумя методами: электронного баланса и полуреакций (ионно-электронного баланса). ОВ-эквивалент вещества. 2. Определение направления ОВР. Физико-химические параметры (температура, концентрация реагентов, их природа, кислотность среды и др.) на направление и глубину протекания ОВР. ПРОБЛЕМНЫЕ ЛЕКЦИИ ПО ДИСЦИПЛИНЕ «ХИМИЯ» |
