План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
3. Ионная химическая связь (электровалентная, гетерополярная) - электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности электроотрицательности взаимодействующих атомов, например, между металлами IA, IIA-групп (s – элементами) и неметаллами VIA, VIIA-групп Периодической системы (р – элементами) - LiF, CsCl, К2О и др. Как показывают экспериментальные исследования и квантово-механические расчеты, полностью ионной связи не существует. Ионная связь – предельно полярная ковалентная связь. Чем больше разность электроотрицательностей атомов в молекуле, тем больше степень ионности химической связи. Между ионной и ковалентной связями нет четкой границы. Даже при взаимодействии щелочных металлов IA-группы с галогенами VIIA-группы не происзодит полного удаления электрона у щелочного металла и присоединении его к более электроотрицательному атому галогена. Электрон только смещается к галогену, образуя около него область повышенной электронной плотности. Ионная связь не имеет свойств насыщаемости и направленности. Это приводит к образованию ионных кристаллов – своего рода гигантских полимерных молекул. Главное отличие ионных кристаллов от ковалентных в том, что в узлах кристалличекой решетки у ионных соединений находятся положительные и отрицательные ионы, а у ковалентных – атомы или молекулы. Понятие валентности к ионной связи неприменимо. Каждый ион имеет неограниченное число связей с другими ионами, нахoдящимися относительно этого иона в ближнем и дальнем порядке. Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион независимо от места расположения. Сила взаимодействия между ионами определяется только величиной их заряда и расстоянием между ними в соответствии с законом Кулона. 4. Металлическая связь - – многоцентровая делокализованная химическая связь, характерная для металлов и металлоподобных веществ в конденсированном (жидком, т.е. расплавленном, или твердом) состоянии, основанная на обобществлении валентных электронов атомов всей структурой вещества и удерживающая атомы в единой кристаллической решетке. В паро- и газообразном состоянии атомы всех веществ, в том числе металлов, связаны между собой только ковалентной связью. В соответствии с положением в Периодической системе атомы металлов имеют небольшое число валентных электронов и, напротив, большое количество незаполненных орбиталей на внешнем квантовом уровне. За счет этого атомы металла упаковываются в кристаллической решетке с максимально возможной плотностью так, чтобы их незаполненные орбитали оказались как можно более полно заселены небольшим числом валентных электронов соседних атомов. В этих условиях валентные электроны (их часто называют электронным газом) достаточно слабо связаны со своими ядрами и поэтому обладают большой свободой перемещения по доступным орбиталям всех атомов, обеспечивая связь между ними в кристалле металла. Иными словами, металлическая связь - это химическая связь, обусловленная взаимодействием электронного газа с остовом решетки кристалла , в узлах которой - атомы и ионы (катионы) металлов или, в более сложных металлоподобных структурах - атомы и ионы металлов и неметаллов . Непрерывное движение электронов в кристалле обусловливает динамическое равновесие процессов перехода атомов металла в ионы и наоборот. Металлическая связь в наиболее чистом виде осуществляется между атомами типичных металлов, к которым относят щелочные и щелочноземельные металлы IA- и IIA-групп. Это наиболее реакционноспособные металлы, в силу слабой связи своих одного – двух валентных электронов с ядрами атомов и низких значений энергии ионизации. Чрезвычайной химической активностью объясняют многие физические свойства их кристаллов: мягкость, непрочность в обычных условиях, небольшие плотности и температуры плавления, кипения. Наличием свободных электронов объясняют общие свойства большинства других металлов: металлический блеск, высокие пластичность, теплопроводность и электропроводность, механическая прочность. Самыми пластичными металлами считают медь, серебро, золото. Наибольшие тепло- и электропроводность имеют серебро, медь, золото, алюминий, железо; наименьшие – марганец, свинец и ртуть. Теплопроводность вызвана обменом энергии при столкновении свободных электронов с колеблющимися ионами и атомами и обеспечивает выравнивание температуры во всем объеме металла. С увеличением числа валентных электронов и уменьшением межатомного расстояния в металлических кристаллах возрастают механическая прочность, твердость, плотность, температуры плавления и кипения. У переходных металлов (элементов побочных Б- подгрупп) V, VI, VII, VIII групп наблюдаются самые прочные кристаллические решетки, самые высокие плотности, температуры плавления и кипения, значения энергии атомизации, межатомные расстояния. Такие физические свойства металлов свидетельствует об определенной доле ковалентности в связях между атомами. Например, установлено, что такой типично переходный металл, как ниобий (VB-группа), имеет концентрацию свободных электронов всего 1,2 моль электронов на моль атомов ниобия. Остальные электроны (3,8 моль их на 1моль атомов, т.е 76%, большая часть свободных электронов) осуществляют направленные ковалентные связи между соседними атомами. Во многих металлах металлическая связь включает и вклад ионной составляющей, когда, например, одноименно заряженные ионы электростатически отталкиваются. Индивидуальные свойства металлов зависят от кристаллических решеток, тип которых определяется размерами атомов и числом валентных электронов. Типы образуемых металлами кристаллических решеток (кубическая гранецентрированная, кубическая объемноцентрированная и гексагональная) зависят от положения соответствующих элементов в Периодической системе элементовД.И.Менделеева. Например, металлы IА-группы образуют кубические гранецентрированные и объемноцентрированные решетки, а металлы IIА-группы– в основном гексагональные. Гранецентрированные кристаллические решетки характерны для металлов побочных подгрупп, таких как медь, серебро, золото, никель, палладий и платина. В настоящее время для объяснения особенностей металлической связи в разных структурах используются современные квантово-механические модели, например, зонная теория металлов, в основе которой – метод МО. 5. Водородная связь. 6. Межмолекулярные взаимодействия: ион-дипольные, водородные и невалентные - Ван-дер-Ваальса (3 типа). Супер- и супрамолекулярные соединения образуются за счет невалентных водородных и межмолекулярных сил взаимодействия. 7. Агрегатные состояния веществ (газообразное и конденсированные), особенности их строения и свойств. Диаграммы состояния. 3.2. Примеры решения типовых задач Задача 1. Какую валентность и степень окисления имеют элементы в соединениях Na3N, F2, BCl? Показать направление перекрывания электронных облаков, конфигурацию молекул и типы связей по направлениям. Решение. а) Na3N: поскольку Na в соединениях всегда имеет степень окислениия (с.о.), равную +1, то с.о.(N) = – 3. П 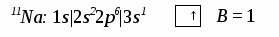 остроим электронные формулы Na и Nи краткие электронно-графические формулы, иначе – схемы заполнения электронами их АО внешнего энергетического уровня: В 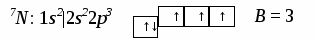 алентность элемента определяется количеством неспаренных электронов на внешнем энергетическом уровне, поэтому валентность Na равна 1. Поскольку валентный электрон находится в s–состоянии, формой его электронного облака является сфера. Атом азота имеет три неспаренных р–электрона на внешнем энергетическом уровне, поэтому его валентность В = 3. Поскольку у азота в соединении Na3Nстепень окисления (по модулю) и валентность численно совпадают, то гибридизации атома не будет. Три валентных р–электрона имеют форму электронного облака в виде гантели и располагаются в околоядерном пространстве п 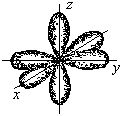 о взаимно перпендикулярным осям: В 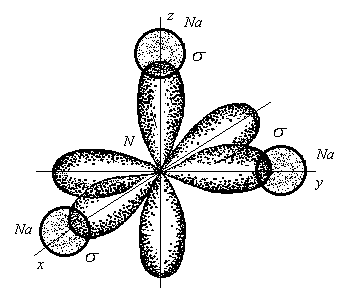 молекуле Na3N каждый валентный р–электрон азота перекрывается с валентным s–электроном каждого из трех атомов натрия. Таким образом, конфигурация молекулы будет следующей: Поскольку перекрывание s– и р– электронов находится на оси, соединяющей центры атомов, то по всем направлениям имеет место σ– связь. б) F2 – простое вещество, поэтому степень окисления его (с.о.) равна 0. Электронная формула атома фтора и схема заполнения его валентных АО: Н 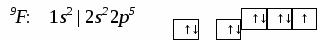 а внешнем энергетическом уровне атома F находится один неспаренный рX–электрон. Поэтому валентность фтора, В(F) = 1; рX–электрон имеет конфигурацию электронного облака в 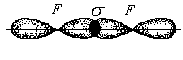 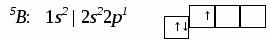 ) В молекуле BCl3степени окисления хлора и бора: с.о.(Cl) = –1, с.о.(В) = +3. Построим электронные формулы и схемы заполнения валентными электронами АО (BиCl): Поскольку атом бора имеет один неспаренный рX–электрон на внешнем энергетическом уровне, то в невозбужденном состоянии его валентность В = 1. Степень окисления бора в соединении BCl3 не совпадает с этой валентностью, значит, при взаимодействии атома бора с хлором происходит его возбуждение, распариваниеs–электронов, переход одного из них во вторую ячейку р–подуровня и гибридизация. Электронная формула атома бора в возбужденном состоянии и схема распределения валентных электронов по АО имеют следующий вид: 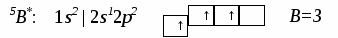 П 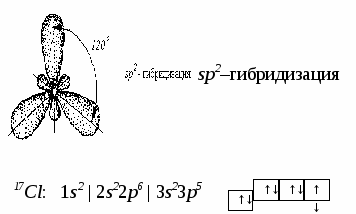 роисходит sp2–гибридизация, для которой характерно следующее расположение электронных облаков: Н Cl а внешнем энергетическом уровне атома хлора имеется один неспаренный рX–электрон, поэтому валентность атома хлора В(Cl)= 1. Форма электронного облака рX–электрона - К 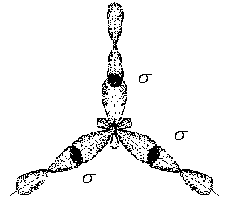 Cl Cl B аждый из трех гибридизованных электронов бора соединяется с каждым атомом хлора через валентный рX– электрон посредством σ– связи. Задача 2. Определить тип химической связи и структуру молекул СН4 и Н2S. Решение. а 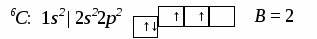 ) В молекуле СН4 степень окисления углерода –4, водорода +1. Электронная формула атома углерода: Поскольку у атома С два неспаренных электрона, то его валентность в невозбужденном состоянии В = 2. Так как степень окисления С не совпадает с его валентностью, то при возбуждении атома происходит распариваниеs–электронов, переход одного из них в третью ячейку р–подуровня и гибридизация. Электронная формула и схема распределения валентных электронов по АО атома углерода в возбужденном состоянии имеют следующий вид: П 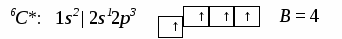 роисходит sp3–гибридизация с характерной для нее конфигурацией электронных облаков, при которой гибридные орбитали ориентированы от центра тетраэдра к его углам: К 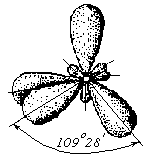 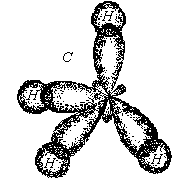 аждый из четырех гибридных электронов перекрывается с каждым s–электроном атома водорода. Таким образом, форма структуры молекулы СН4 – объемный тетраэдр: б) В молекуле Н2S степень окисления серы –2, водорода +1. Электронная формула и схема распределения валентных электронов атома серы по АО: П  оскольку у атома S два неспаренных электрона, то валентность невозбужденного атома серы В (S) = 2. Так как валентность совпадает со степенью окисления серы (по модулю), то гибридизации нет. Два валентных р–электрона располагаются в околоядерном пространстве по взаимно перпендикулярным осям и перекрываются с s–электронами двух атомов Н посредством σ– связей: 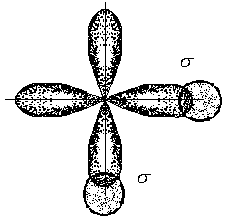 Сравним структуры молекул СН4 и H2S. Молекула СН4 – тетраэдрическая и дипольный момент этой молекулы как векторная величина, равная геометрической сумме моментов диполей входящих в нее связей С–Н, равен нулю. Поэтому молекула СН4 – неполярная. Молекула Н2S – угловая, в одной ее части преобладает положительный, в другой – отрицательный заряд. Поэтому эта молекула - полярная. Задача 3. Определить структуру и характер связей молекулы N2. Решение. Электронная формула атома азота: А 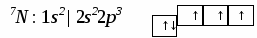 том азота имеет три валентных неспаренных р–электрона, расположенных в пространстве по трем взаимноперпендикулярным осям. Поэтому связей в молекуле N2 три: одна σ– и две –связи. З 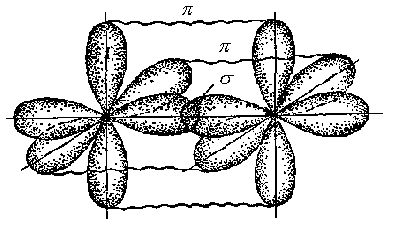 адача 4. Какая из молекул: Н2О, Н2S, H2Se - имеет наибольший электрический момент диполя? Решение. ?? Элементы О, S и Se являются электронными аналогами, их электронные формулы имеют следующий вид: 8O : 1s2 | 2s2 2p4 16S : 1s2 | 2s2 2p6 | 3s2 3p4 34Se : 1s2 | 2s2 2p6 | 3s2 3p6 3d10 | 4s2 4p4 Структура их внешних электронных оболочек одинакова. Поскольку с ростом порядкового номера элементов размеры атомов, находящихся в одной группе, возрастают, то будут возрастать и размеры соответствующих им однотипных молекул. Поэтому будут возрастать длины диполей и связанные с ними электрические моменты диполей µ. Следовательно,µ(H2Se)> µ(H2S)> µ(H2O). Задача 5. Определить, какая из связей: H–N, H–S, H–Te, H–Li - наиболее полярна. К какому из атомов смещено электронное облако в каждой паре элементов? Решение. Для определения характера связи необходимо знать электроотрицательность каждого элемента:
Определим разность электроотрицательностей ОЭО для данных соединений: ОЭО(H–N)= 3,0 –2,1 = 0,9; ОЭО(H–S) = 2,5 – 2,1 = 0,4; ОЭО(H–Te) = 2,1 – 2,1 = 0; ОЭО(H–Li) = 2,1 –1,0 = 1,1; Чем больше разность электроотрицательностей соединяющихся атомов, тем более полярна связь. Таким образом, наиболее полярной является связь H–Li. Молекулярное электронное облако смещается в сторону атома, обладающего большей электроотрицательностью, т.е. в сторону азота в соединении H–N, серы - в связи H–S, водорода – между H–Li. В паре H–Te электронное облако находится на равном расстоянии от HиTe, т.е. связь между ними неполярна. |
