План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
_________________________________________________________________________ Лекция № 8. Химическая связь Из рабочей программы
1. Развитие представлений о химической связи. Основные типы и природа химической связи. Количественные характеристики химической связи на основе квантово-механической теории: энергия и длина связи, валентный угол, эффективный заряд и степень окисления атома в молекуле. 2. Ковалентная связь: понятие, свойства, описание механизмов образования методами квантовой механики: валентных связей (МВС) и молекулярных орбиталей (ММО). Кратность и порядок связи. Локализованные и делокализованные связи. Понятие гибридизации атомных орбиталей. Пространственные конфигурации молекул. Явление поляризации атомов и ионов. Полярность связи и молекулы. 3. Ионная, металлическая, водородная связи, их образование и свойства. 4. Типы межмолекулярных взаимодействий. 5. Химическая связь в комплексных соединениях. Лекции Тема: Строение вещества (продолжение) II. Химическая связь Вопросы: 1. Определение, основные типы и природа химической связи. Количественные характеристики связи на основе квантово-механической теории: энергия, длина связи, валентный угол. 2. Ковалентная связь. Свойства ковалентной связи: насыщаемость, направленность. Квантово-механические методы описания ковалентной связи: валентных связей (МВС), молекулярных орбиталей (ММО ЛКАО). Полярность: связи, молекул. 2.1. Механизмы образования связи по МВС: обменный, донорно-акцепторный. 2.2. Особенности химической связи в комплексных соединениях. 2.3. Теория валентности в МВС. Кратность связи (простые (сигма-) и кратные (пи-, дельта-) связи). 2.4. Гибридизация связи: понятие, типы. Пространственная структура молекул. 2.5. ММО ЛКАО: связывающие и разрыхляющие МО, энергетические диаграммы МО. Порядок связи. Магнитные свойства молекул. 2.6. Сравнение (достоинства и недостатки) методов ВС и МО ЛКАО. 3. Ионная связь и ее свойства: ненаправленость, ненасыщамость. 4. Металлическая связь:. 5. Водородная связь. 6. Межмолекулярные взаимодействия: ион-дипольные, водородные и невалентные - Ван-дер-Ваальса (3 типа). Самостоятельная работа: 1. Явление гибридизации химических связей. Пространственная структура (конфигурация) молекул. 2. Металлическая связь: применение метода МО в зонной теории структуры и свойств металлов, полупроводников и диэлектриков. _______________________________________________________________________ Химическая связь. 1. Определение, основные типы и природа химической связи. Количественные характеристики химической связи на основе квантово-механической теории. Без представлений о природе связей в химических соединениях невозможно объяснить причину образования того или иного соединения, механизм химического процесса и причину реакционной способности частиц вещества. Совокупность химически связанных атомов представляет собой сложную систему атомов, ядер и электронов. Между этими носителями зарядов действуют электростатические силы притяжения и отталкивания. Единственным критерием химического взаимодействия атомов, ионов и молекул является изменение строения их электронных оболочек. Современная квантово-механическая теория химической связи основана на положении, что при возникновении связи между частицами возрастает электронная плотность в межъядерном пространстве их атомов, и общая энергия системы уменьшается. Не известно ни одного экспериментального факта, противоречащего этому утверждению. Химическая связь осуществляется только в том случае, если при сближении атомов (двух или большего числа) полная энергия системы понижается. Таким образом, образование химической связи всегда сопровождается выделением энергии. Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их атомных орбиталей (электронных облаков) с увеличением электронной плотности в пространстве между ядрами и уменьшением полной энергии новой системы. Количественные характеристики химической связи на основе квантово-механической теории: энергия, длина связи, валентный угол. Энергия химической связи - это количество энергии, выделяющейся при образовании химической связи или требующееся для ее разрыва. Разрыв химической связи всегда требует затраты энергии. Чем больше энергия химической связи, тем устойчивее молекула. Длина связи – это межъядерное расстояние взамодействующих атомов. Она зависит от размеров электронных оболочек атомов и степени их перекрывания. Увеличение размеров атомов в соединениях приводит к увеличению межъядерного расстояния, длины связи и уменьшению энергии связи. И, напротив, с уменьшением длины связи обычно повышается энергия связи и, значит, устойчивость соединений. По современным представлениям химическая связь имеет электрическую природу, но осуществляется она по-разному. Валентный угол – это угол между двумя ковалентными связями, образованными одним атомом с двумя другими атомами. Природа химической связи – единая – электрическая: химическая связь всегда возникает как результирующая сила между куло-лоновским (электростатическим) притяжением противоположных заря-доватомных ядер и электронов, -с одной стороны, и отталкиванием одноименно заряженных ядер и электронов друг от друга – с другой. Правило октета: В результате образования валентной химической связи атомы стремятся приобрести 8-элек-тронную конфигурацию валентных электронов, как у благородных газов (кроме Не). S – элементы в невозбужденном состоянии стремят-мятся иметь на внешнем уровне завершенную 2-электронную оболочку, как у Не). 2. Типы химической связи Силы, связывающие атомы друг с другом, имеют единую электрическую природу. Но вследствие различия в механизме образования и проявления этих сил химические связи могут быть разного типа. Различают три основных типа валентной химической связи: ковалентную, ионную и металлическую. Кроме них, большое значение и распространение имеют: водородная связь, которая может быть валентной и невалентной, и невалентная химическая связь - межмолекулярная (или Ван-дер-Ваальсова), образующая относительно небольшие ассоциаты молекул и огромные молекулярные ансамбли – супер- и супрамолекулярные наноструктуры. Ковалентная химическая связь (атомная, гомеополярная) – это химическая связь, осуществляемая общими для взаимодействующих атомов одной-тремя парами электронов. Эта связь – двухэлектронная и двухцентровая (связывает 2 атомных ядра). При этом ковалентная связь является наиболее распространенным и наиболее общим типом валентной химической связи в бинарных соединениях – между а) атомами неметаллов и б) атомами амфотерных металлов и неметаллов. Примеры: Н-Н (в молекуле водорода Н2); четыре связи S-О (в ионе SО42-); три связи Аl-H (в молекуле АlH3); Fe-S (в молекуле FeS) и др. Особенности ковалентной связи – ее направленность и насыщаемость. Направленность- важнейшее свойство ковалентной связи, от которого зависит структура (конфигурация, геометрия) молекул и химических соединений. Пространственная направленность ковалентной связи определяет химическое и кристаллохимическое строение вещества. Ковалентная связьвсегда направлена в сторону максимального перекрывания атомных орбиталей валентных электронов взаимодействующх атомов, с образованием общего электронного облака и наиболее прочной химической связи. Направленность выражают в виде углов между направлениями связи атомов в молекулах разных веществ и кристаллах твердых тел. Насыщаемость – это свойство, отличающее ковалентную связь от всех других видов взаимодействия частиц, проявляющееся в возможности атомов образовывать ограниченное число ковалентных связей, поскольку каждая пара связующих электронов образуется лишь валентными электронами с противоположно ориентированными спинами, число которых в атоме ограничено валентностью, 1 – 8. При этом запрещается использование одной и той же атомной орбитали дважды для образования ковалентной связи (принцип Паули). Валентность – это способность атома присоединять или замещать определенное число других атомов с образованием валентных химических связей. По спиновой теории ковалентной связи валентность определяется числом неспаренных электронов у атома в основном или возбужденном состоянии. Таким образом, у разных элементов способность к образованию определенного числа ковалентных связей ограничена получением максимального числа неспаренных электронов в возбужденном состоянии их атомов. Возбужденное состояние атома – это состояние атома с полученной им извне дополнительной энергией, вызывающей распаривание антипараллельных электронов, занимавших одну атомную орбиталь, т.е. переход одного из этих электронов из спаренного состояния на свободную (вакантную) орбиталь того же или близкого энергетического уровня. Например, схемызаполнения s-, р-АО и валентность (В) у атома кальция Са в основномивозбужденном состоянии следующие: С 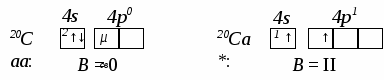 ледует отметить, что атомы с насыщенными валентными связями могут образовывать дополнительные ковалентные связи по донорно-акцепторному или иному механизму (как, например, в комплексных соединениях). Ковалентная связьможет быть полярной и неполярной. Ковалентная связь неполярна, если обобществленные валентные электроны равномерно распределены между ядрами взаимодействующих атомов, область перекрывания атомных орбиталей (электронных облаков) притягивается обоими ядрами с одинаковой силой и поэтому максимум общей электронной плотности не смещен ни к одному из них. Этот вид ковалентной связи осуществляется в случае соединения двух одинаковых атомов элемента. Ковалентную связь между одинаовыми атомами называют также атомной или гомеополярной. Полярная связь возникает при взаимодействии двух атомов разных химических элементов, если один из атомов за счет большего значения электроотрицательности сильнее притягивает валентные электроны, и тогда общая электронная плотность более или менее смещается в сторону этого атома. При полярной связи вероятность нахождения электрона у ядра одного из атомов выше, чем у другого. Качественная характеристика полярной связи – разность относительных электротрицательностей (|∆ОЭО|)связанных атомов: чем она больше, тем более полярна ковалентная связь. Количественная характеристика полярной связи, т.е. мера полярности связи и сложной молекулы - электрический момент дипо-ля μсв, равный произведению эффективного заряда δ на длину диполя lд: μсв = δ ∙ lд. Единица измерения μсв – Дебай. 1Дебай = 3,3.10 -30 Кл/м. Электрический диполь – это электрически нейтральная система двух равных и противоположных по знаку электрических зарядов +δ и –δ. Дипольный момент (электрический момент диполя μсв) – векторная величина. Принято считать, что направление вектора от (+) к (–)совпадаетс направлением смещения области общей электронной плотности (суммарного электронного облака) поляризованных атомов. Общий дипольный момент сложной многоатомной молекулы зависит от числа и пространственной направленности полярных связей в ней. Таким образом, определение дипольных моментов позволяет судить не только о характере связей в молекулах, но и об их расположении в пространстве, т.е. о пространственной конфигурации молекулы. С увеличением разности электроотрицательностей |∆ОЭО| атомов, образующих связь, электрический момент диполя возрастает. Следует заметить, что определение дипольного момента связи – сложная и не всегда решаемая задача (взаимодействие связей, неизвестность направления μсв и т.д.). Квантово-механические методы описания ковалентной связи –объясняют механизм образования ковалентной связи. Проведенный В.Гейтлером и Ф.Лондоном, нем. учеными (1927гг.), расчет энергетического баланса образования ковалентной связи в молекуле водорода Н2 позволил сделать вывод: природа ковалентной связи, как и любого другого типа химической связи, заключается в электрическом взаимодействии, происходящем в условиях квантово-механической микросистемы. Для описания механизма образования ковалентной химической связи используют два приближенных квантово-механических метода: валентных связей и молекулярных орбиталей – не исключающих, но взаимно дополняющих друг друга. 2.1. Метод валентных связей(МВС или локализованных электронных пар), предложенный В. Гейтлером и Ф. Лондоном в 1927г.,основывается на следующихположениях: 1) химическая связь между двумя атомами возникает в результате частичного перекрывания атомных орбиталей с образованием общей электронной плотности совместной пары электронов с противоположными спинами, - более высокой, чем в других областях пространства вокруг каждого ядра; 2) ковалентная связь образуется лишь при взаимодействии электронов с антипараллельными спинами, т.е. с противоположными по знаку спиновыми квантовыми числами mS= + 1/2; 3) характеристики ковалентной связи (энергия, длина, полярность и др.) определяются видом связи (σ–, π –, δ –), степенью перекрывания АО (чем она больше, тем прочнее химическая связь, т.е. выше энергия связи и меньше длина), электроотрицательностью взаимодействующих атомов; 4) ковалентная связь по МВС может образоваться двумя способами (двумя механизмами), принципиально разными, но имеющими одинаковый результат – обобществление пары валентных электронов обоими взаимодействующими атомами: а) обменным, за счет перекрывания одноэлектронных атомных орбиталей с противоположными спинами электронов, когда каждый атом дает для перекрывания по одному электрону на связь – при этом связь может быть как полярной, так и неполярной, б) донорно-акцепторным, за счет двухэлектронной АО одного атома и свободной (вакантной) орбитали другого, по которому один атом (донор) предоставляет для связи пару электронов, находящихся на орбитали в спаренном состоянии, а другой атом (акцептор) – свободную орбиталь. При этом возникает полярная связь. 2.2. Комплексные (координационные) соединения, многие молекулярные ионы, являющиеся комплексными, (аммония, тетрагидрида бора, др.) образуются при наличии донорно-акцепторной связи – иначе, координационной связи. Например, в реакции образования иона аммония NH3 + H+ = NH4+ молекула аммиака NH3 - донор пары электронов, а протон Н+ - акцептор. В реакции ВН3 + Н – = ВН4– роль донора электронной пары играет гидрид-ион Н–, а акцептора – молекула гидрида бора ВН3, в которой имеется вакантная АО. Кратность химической связи. Связи σ-, π– , δ–. Максимальное перекрывание АО разного типа (с установлением наиболее прочных химических связей) достигается при их определенной направленности в пространстве, вследствие разной формы их энергетической поверхности. Тип АО и направление их перекрывания определяют σ-, π– , δ– связи: σ (сигма)–связь – это всегда одинарная (простая) связь, возникающая при частичном перекрывании одной пары s-, px-, d- АО вдоль оси, соединяющей ядра взаимодействующих атомов. Одинарные связи всегда являются σ– связями. Кратные связи – π (пи)– (также δ (дельта)–связи), двойные или тройные ковалентные связи, осуществляемые соответственно двумяили тремя парами электронов при перекрывании их атомных орбиталей. π (пи)– связь осуществляется при перекрывании рy-, pz - иd- АО по обе стороны оси, соединяющей ядра атомов, во взаимно перпендикулярных плоскостях; δ (дельта)– связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях. Самой прочной из σ-, π– , δ– связей являетсяσ– связь, но π– связи, налагаясь на σ– связь, образуют еще более прочные кратные связи: двойные и тройные. Любая двойная связь состоит из одной σ– и одной π– связей, тройная – из одной σ– и двух π– связей. |
