План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Пример 3. Не производя вычислений, определить знак изменения энтропии в следующих реакциях:
Решение. В реакции (1) 1 моль вещества в кристаллическом состоянии образует 3 моля газов, следовательно, ∆S>0. В реакциях (2) и (3) уменьшается как общее число молей, так и число молей газообразных веществ, так что ∆S2 < 0 и ∆S3 < 0. При этом ∆S3 имеет более отрицательное значение, чем ∆S2, так как Изменение энтропии при различных процессах (изменениях температуры системы, в химических реакциях): 1. Нагревание (т.е. повышение температуры) вещества сопровождается увеличением энтропии, а охлаждение - ее уменьшением. изменение энтропии определяют через удельную теплоемкость по формуле: 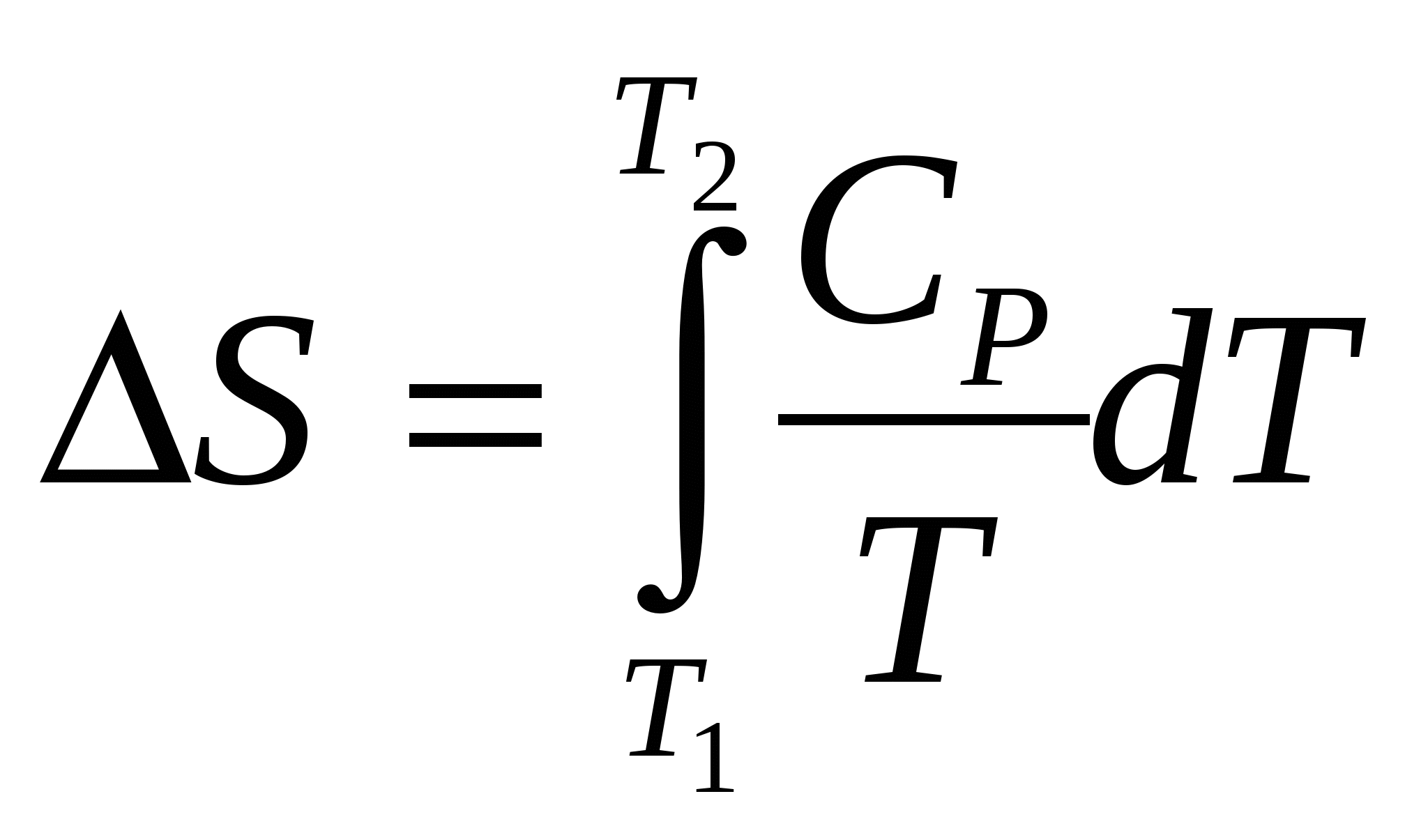 – для 1 моля вещества. – для 1 моля вещества. 2. При увеличении объема газа (Т = const) энтропия возрастает: ∆S = R lnV2 /V1 , а при увеличении давления – уменьшается: ∆S = R ln p1 / р2 , где V2 > V1 и р2 > p1 . 3. При одновременном повышении температурыиувеличении объема, рост энтропии для 1 моля вещества определяют по формуле: 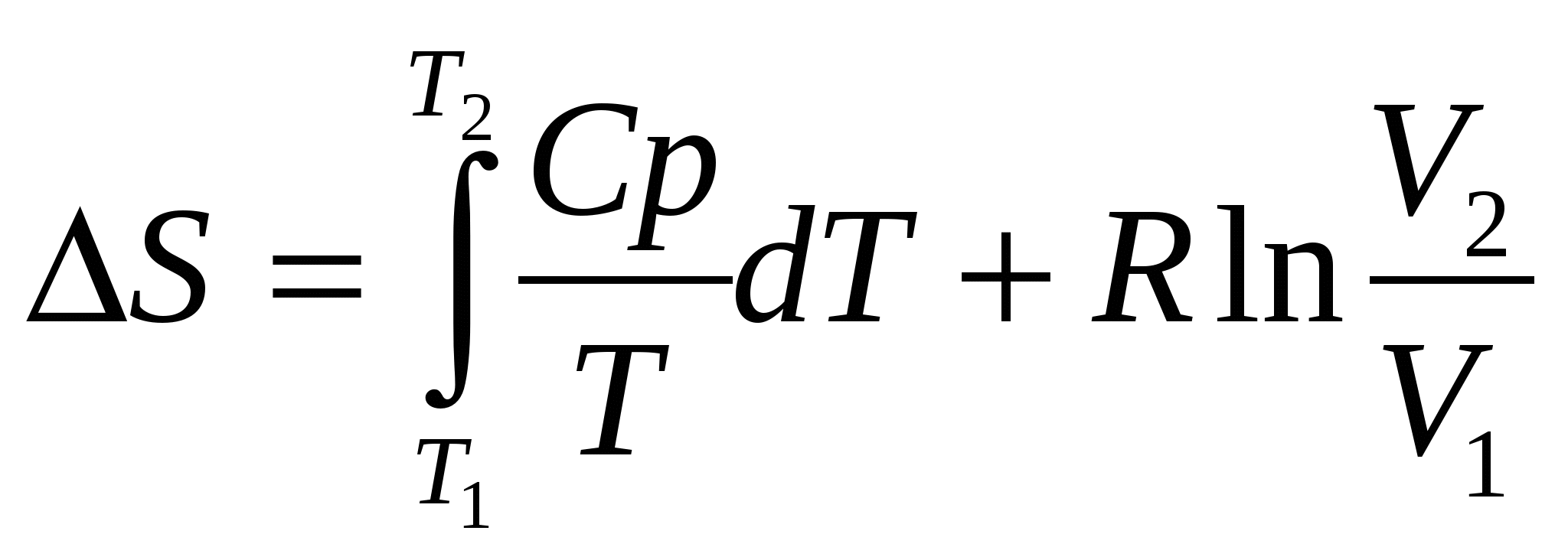 . .4. При смешении двух газов, находящихся при одинаковых давлении и температуре, энтропия зависит от количеств этих газов и отношений сумм их объемов к их индивидуальным объемам: где n1 и n2 – количества газов (число молей), а V1 и V2 – объемыгазов, первого и второго. 5. Фазовые переходы (изменения агрегатного состояния вещества): Плавление: Испарение: где ∆Нпл и ∆Нисп. – соответственно удельные теплоты плавления и испарения (равные количествам теплоты, затрачиваемым для расплавления и испарения 1 г твер-дого или жидкого вещества). 6. В химических реакциях: Для изменения энтропии химической реакции (∆Sх.р.) справедливо утверждение, аналогичное рассмотренному выше первому следствию закона Гесса (для ∆Нх.р.): Изменение энтропии химической реакции (∆Sх.р.) равно сумме стандартныхэнтропий продуктов реакции за вычетом суммы стандартных энтропий исходных веществ (реагентов), –с учетом соответствующих стехиометрических коэффици-ентов:∆Sх.р.=ni ∑(Sпрод) – nj ∑(Sреаг) Стандартнаяэнтропия S0298– энтропия веществав егостандартном состоянии (ст. у .: 1 моль, 100 кПа, 298 К, устойчивое агрегат-ное состояние) (Парциальное давление – давление компонента газовой смеси, которое он имел бы при предоставлении ему объема, занимаемого всей смесью газов). Связь между КС и КР устанавливают с помощью уравнений р = СмRТи – ∆G = Амах, получая выражение: КР = КС (RТ)∆п , где ∆п – разность сумм стехиометрических коэффициен-тов у продуктов и исходных веществ в уравнении данной химической реакции. В состоянии термодинамического равновесия ∆G = 0. Константы химического равновесия КС и КР связаны со стандартной энергией Гиббса реакции простыми соотношениями: ∆G0 = – RТ ln КС и ∆G0 = – RТ ln КР . Константа равновесия реакции дает представление о выходе продуктов реакции при заданной температуре. Так, например, если константа равновесия КС процесса А при температуре Т равна единице (КС = СВ/СА = 1), то равновесный состав реакционной смеси харак-теризуется равенством концентраций СА и СВ , т.е. процесс А → В при температуре Т идет самопроизвольно до тех пор, пока концентрация вещества В не станет равной концентрации вещества А в смеси этих веществ. Самостоятельная работа: вопросы лекции 3, 7. Фазовое равновесие 1. Агрегатные (физические) состояния веществ: газообразное (идеальные и реальные газы, уравнения их состояния, состав земной атмосферы, воздуха), плазменное, конденсированные жидкое (в том числе - жидкокристаллическое) и твердое (аморфное и кристаллическое),– особенности их структуры и свойств. Типы кристаллов, химических связей и свойства твердых веществ. 2. Молекулярно-кинетические теории газов и жидкостей. Жидкие кристаллы. Понятия: давление насыщенного пара, температура кипения, вязкость, сверхтекучесть и поверхностное натяжение жидкости. 3. Твердые вещества в аморфном и кристаллическом состояниях, особенности их свойств. Типы кристаллических структур веществ и их свойства. Понятия изо- и полиморфизма. Кристаллы с несколькими типами химической связи. Супер- и супрамолекулярные соединения класса клатратов: слоистые (интеркаляты), газовые гидраты и др. Реальные кристаллы. Типы дефектов в кристаллах. Ионная и суперионная проводимости. Соединения переменного состава (нестехиометрические) и явление сверхпроводимости. 5. Диаграммы состояния одно- и двухкомпонентных систем. Диаграммы плавкости. 1. Гетерогенное химическое и фазовое равновесие (фазовые равновесия в гетерогенных системах). Понятие о термическом анализе. 2. Диаграммы состояния (фазовые) гетерогенных систем. Понятия: независимый компонент системы, степень свободы. Правило фаз Гиббса. Правило рычага и его применение. Самостоятельная работа: 1. Построение диаграмм состояния одно- и двухкомпонентных систем и их анализ. Правила: фаз Гиббса, рычага – и их использование в фазовом анализе. III. Дисперсные системы. Растворы. Вопросы: 1. Определения раствора, дисперсной системы и их классификации. Понятия истинного и коллоидного растворов, дисперсионной среды и дисперсной фазы. Молекулярно-кинетические, оптические и электрические свойства коллоидных систем. Строение коллоидной частицы, мицеллы. Гели, полимеры и их типы. 2. Способы выражения количественного состава (концентрации) растворов: молярная, моляльная, нормальная (эквивалентная) концентрации и процентная (массовая доля), титр раствора, растворимость и коэффициент растворимости. 3. Растворы неэлекролитов и электролитов. Коллигативные свойства растворов неэлектролитов: осмос и осмотическое давление, давление пара растворителя над раствором, изменение температур кипения и замерзания растворов – законы Вант-Гоффа и Рауля. 4. Равновесие в растворах электролитов. Теория электролитической диссоциации. Ступенчатая диссоциация. Диссоциация слабых электролитов. Закон разведения Оствальда. 5. Ионное произведение воды, кислотность (рН) и основность (рОН) растворов; понятия индикаторов, буферных растворов. 6. Гидролиз солей и его типы. 7. Гетерогенное равновесие в растворах. Произведение растворимости веществ. Лекция № (4 часа) Тема: Классы и взаимодействия неорганических веществ. Вопросы: 1. Общая классификация химических веществ. 2. Основные классы неорганических соединений. Взаимосвязь соединений разных классов. 3. Комплексные соединения: общая характеристика (теория Вернера), классификация, свойства. Супрамолекулярные вещества. Понятие комплементарности. 4. Современные химические номенклатуры простых и сложных неорганических веществ, ионов. Самостоятельная работа: 1. Металлы, их свойства. Отношение металлов к воде, кислотам, щелочам. 2. Неметаллы, их свойства. 3. Оксиды, гидроксиды, кислоты, соли: свойства. 2. Основные классы неорганических соединений Главной особенностью атомов химических элементов является их способность образовывать химические соединения. Исключение составляют лишь некоторые инертные газы (гелий, неон, аргон), которые при всех условиях атомарны и не проявляют химической активности. Химические соединения, состоящие из атомов двух химических элементов, называют бинарными. В их химических формулах справа обычно записывают более электроотрицательный элемент (с отрицательной степенью окисления), дающий название этой группе бинарных соединений (корень латинского названия этого элемента + суффикс «ид»). Это, например, гидриды - соединения элементов с водородом (корень «гидр» от латинского названия водорода «гидрогениум» + «ид»): LiH, CaH2,NH3. В соединениях с металлами водород имеет степень окисления –1, с неметаллами +1. Среди бинарных водородных соединений следует отметить обширные классы углеводородов с безграничным многообразием форм, относящихся к органическим соединениям, которые имеют другую, особую систему наименований (номенклатуру), принятую в органической химии. Таковы, например, соединения с общими формулами СnH2n+2, CnH2n , CnH2n–2 (алканы, алкены, алкины и др.). Кислород образует бинарные соединения – оксиды – со всеми другими элементами (кроме гелия, неона, аргона). В оксидах он имеет степень окисления (с.о.) – 2. Примеры оксидов: Na2O, MgO, Al2O3и т.п. В бинарных соединениях, называемых пероксидами (Н2O2,,Na2O2, CaO2и др.), с.о.(кислорода) =– 1, а в соединениях со фтором, более электроотрицательным, чем кислород, с.о.(кислорода) =+ 2: например,в ОF2 . Соединения с галогенами – галогениды (фториды, хлориды, бромиды, иодиды: NaF, NaCl, NaBr, NaI), соединения с азотом – нитриды (GaN, BN, AlN и др), соединения с углеродом – карбиды(CaC2, Al4C3 и др.), соединения с фосфором – фосфиды (Ca3P2, Ni5P2 и др.), соединения с кремнием – силициды (CrSi2, FeSi2, MnSi2 и др.) или силаны (соединения водорода с кремнием, SiН4 ), соединения с мышьяком – арсениды (GaAs, AlAs и др.) или арсины (соединения водорода с мышьяком, AsН3) соединения двух металлов – интерметаллические соединения (ИМС) – интерметаллиды: Сu3Au, MgCu2, CaZn10 и др. 2.1. Оксиды По химическим свойствам оксиды подразделяют прежде всего на солеобразующие и несолеобразующие. Солеобразующие оксиды в свою очередь делят на основные, кислотные и амфотерные. Основными называют оксиды, которые образуют соли при взаимодействии с кислотами и кислотными оксидами: СаO + 2HCl = СaCl2 + H2O К2O + SO3 = К2SO4 Основным оксидам соответствуют основания – основные гидроксиды, образующиеся в результате прямого или косвенного присоединения воды: Na2O (+ Н2О) 2NaOH, CaO (+ Н2О) Ca(OH)2, NiO (+ Н2О) Ni(OН)2. Кислотныминазывают оксиды, образующие соли при взаимодействии с основаниями и основными оксидами. Их называют ангидридами соостветствующих кислот: SO3 + 2NaOH = Na2SO4 + H2O SO3 + MgO = MgSO4 SO3, триоксид серы, оксид серы (VI) – ангидрид серной кислоты. Кислотным оксидам соответствуют кислородосодержащие кислоты (оксокислоты) – кислотные гидроксиды, образующиеся в результате присоединения воды: SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3 Следует подчеркнуть, что любой химичекий элемент в соответствующихоксидах и гидроксидах имеет одну и ту же степень окисления. Основные оксиды являются оксидами металлов, кислотные – оксидами неметаллов. Поскольку нет четкой границы между металлами и неметаллами, существует большая группа амфотерных оксидов. Амфотерность определяется положением элемента в Периодической системе (ПС) и зависит от его степени окисления (с.о.). Амфотерны практически все металлы побочных подгрупп (d – металлы) и металлы средних (IV, V) групп. С увеличением степени окисленияодного и того же элемента растет его относительная электроотрицательность (ОЭО), поэтому свойства оксидовего изменяются от основных (прис.о.данного элемента +1,+2) к кислотным (еслис.о. = +5 ÷ +7). При средних (промежуточных) степенях окисления амфотерный оксид может проявлять как основные, так и кислотные свойства. Например, оксиды хрома: CrO – основный, Cr2O3 – амфотерный, CrO3 – кислотный. Элементы, образующие амфотерные оксиды, имеют значения ОЭО* =1,4 ÷ 2,0 истепени окисления (+1,+2) ÷ (+4). Если ОЭО < 1,4 при степени окисления (+1) ÷ (+3), то оксиды (и отвечающие им гидроксиды) обладаютосновными свойствами (ОЭO[Ca(+2)]=1). Еслипри степени окисления ≥ +4ОЭОэлемента≥ 1,9, тооксидобладает, как правило,кислотными свойствами. Например, ОЭО [С(+4),Si(+4),Ge(+4)] равны соответственно 2,5; 1,9; 1,8. Это означает, что углерод и кремний проявляют кислотные свойства, образуя кислотные оксиды и гидроксиды (кислоты), а германий – амфотерен. |
