План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Для многих соединений не удается осуществить реакцию их образования из простых веществ и тем более измерить теплоту образования. Но! В большинстве случаев можно осуществить реакцию полного сгорания. Стандартная теплота сгорания (∆Нc0) – это теплота, вы-деляющаяся при сгорании в атмосфере кислорода 1 моль вещества при ст. давлении 1,013.105 Па до простых оксидов При этом все участники реакции должны быть в устойчи-вых агрегатных состояниях. Пример: рассчитать тепловой эффект горения спирта: С2Н5ОН + 3 О2 = 2 СО2 + 3 Н2О Решение: ∆Нх.р= ∆Нc0(С2Н5ОН) + 3∆Нc0(О2) - 2∆Нc0(СО2) - 3∆Нc0(Н2О) Далее находим (в таблицах термодинамических величин) стандартные теплоты сгорания ∆Нc0 всех веществ и определяем ∆Нх.р . Следствие 4. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным состояниям, то разность между их тепловыми эффектами равна тепловому эффекту перехода системы из одного состояния в другое. Это следствие позволяет точно вычислять тепловые эффекты процессов, которые мы даже не имеем возможности осуществить практически. Пример (классический!): Определить тепловой эффект превращения графита в алмаз: С (графит) → С (алмаз). Решение: определим неизвестный тепловой эффект (∆Нх) путем анализа реакций горения графита и алмаза по закону Гесса: С (графит) + О2 = СО2 + 393, 51 кДж (1) С (алмаз) + О2 = СО2 + 395, 34 кДж (2) С (графит) → С (алмаз) = (1) – (2) ∆Н1 = - Q = - 393, 51 кДж; ∆Н2 = - 395, 34 кДж ∆Нх= ∆Н1 - ∆Н2 = 395, 34 - 393, 51= + 1, 83 (кДж) Таким образом, переход графита в алмаз сопровождается поглощением сравнительно небольшого количества теплоты. Примеры решения типовых задач Задача 1. Рассчитать теплоту образования CuCl2 по реакции: Cu(T)+ Cl2(T)= CuCl2(T) при 500С, если ∆H298(CuCl2(T)) = –205,9 кДж/моль, а молярные теплоемкости веществ имеют следующие значения : Cp(Cu(T))=22,6 + 6,28·10-3·T Дж/(моль·К); Cp(Cl2)=36,7 + 1,05·10-3·T Дж/(моль·К); Cp(CuCl2(T))=64,5 + 50,2·10-3·T Дж/(моль·К); Решение. Используем уравнение Кирхгоффа  где где∆Cp= Cp(CuCl2)–(Cp(Cu(T))+ Cp(Cl2(T))). Найдем ∆Cp: ∆Cp=64,5 + 50,2·10-3·T –22,6 – 6,28·10-3·T – 36,7 + 1,05·10-3·T; ∆Cp=5,2 + 42,9·10-3·T Представим ∆Cp выражением ∆Cp= a + bT, где a = 5,2; b = 42,9·10-3. Определим теплоту образования CuCl2 при температуре 500С или 773 К:  . .Подставляя числовые значения a, b, T, ∆H298 (из условия задачи), получим: 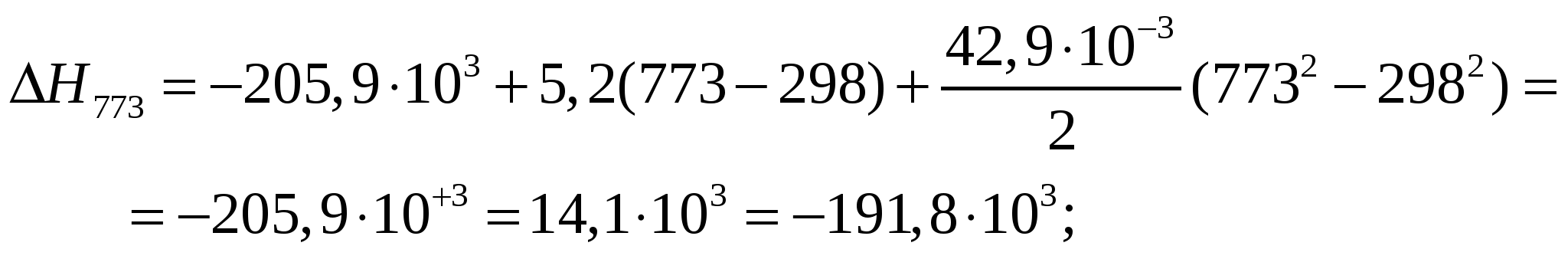 ∆H773=–191,8 (кДж/моль). Процессы в живых организмах В человеческом организме идут многочисленные химические превращения (под общим названием «обмен веществ» или «метаболизм»), каждое из кото-рых сопровождается изменениями внутренней энергии и энтальпии организма. Основные источники энергии для человека – пища и вода (напитки). По сравнению с этим энергия, поступающая в тело человека в виде тепла (например, когда греемся у печки, костра) – ничтожно мала. Энергию организму дают, как известно, основные компоненты любой пищи: жиры (38 ккал/г), белки (17 ккал/г), углеводы (16 ккал/г). Организмом расходуется большая часть этой энергии, причем точное ее значе-ние зависит от возраста, пола, роста, веса и вида деяте-льности человека. Мужчины расходуют ежедневно от 9200 до 12100 кДж, женщины – от 6700 до 8800 кДж. Если поглощается энергии больше, чем тратится, то ее избыток запасается в теле в виде жира. Каж-дый 1 г жира образуется за счет избыточной энер-гии, равной ≈ 35000 кДж. (см.: Коровин. Химия – с.128-130. Калорийность пищи) Теплоемкость - количество теплоты, необходимое для нагрева единицы массы (в граммах) или количества вещества (моль) на единицу температуры (на 1 градус Цельсия , 1 Кельвин ). Различают удельную, мольную (молярную), истинную, среднюю теплоемкости. Удельная теплоемкость определяется количеством теплоты, необходимым для нагрева 1 г вещества на 1 К. Мольная теплоемкость определяется количеством теплоты, необходимым для нагрева 1 моля вещества на 1 К. Средняя теплоемкость – количество теплоты, необходимое для нагрева единицы количества вещества от Т1 до Т2: Истинная теплоемкость определяется выражением: где dQ и dТ – бесконечно малые приращения теплоты и температуры. Связь между средней и истинной теплоемкостью определяется выражением:  Различают теплоемкостипри постоянном давлении Ср (изобарная)и при постоянном объеме СV (изохорная). ПосколькуQp = ∆H при р = const, а QV = ∆U при V = const, то Связь между Ср и СVопределяется выражением: Ср - СV= R, где R - универсальная газовая постоянная, R = 8,314 Дж/моль∙К. Правило Дюлонга-Пти Атомная теплоемкость химических элементов (Сат) в твердом состоянии, т.е. произведение атомной массы (А) элемента наего удельную теплоемкость (Суд) приблизительно одинакова для всех элементов и равна ≈ 25 Дж/моль .К: Сат = Аr.Суд ≈ 25,1 Дж/моль .К, При этом Сp(ат) = Аr.Сp= 25,1 Дж/моль .К, СV (ат) =Аr .СV = 24,85 Дж/моль .К Правило Неймана - Коппа (аддитивности) Молярная теплоемкость (Смол) химических сое-динений в твердом состоянии, т.е. произведение их молекулярной массы (Мr) на удельную теплоем-кость, равна сумме атомных теплоемкостей химических элементов, входящих в данное соединение: Смол = Мr.Суд = ∑Сат (Nатомов), т.е. Смол = Сат (1) + Сат(2) + …+ Сат (N), Дж/моль .К Зависимость теплового эффекта реакции от темпе-ратуры (при постоянном давлении или объеме) определяется уравнением (законом) Кирхгоффа: ∆Ср для условного уравнения реакции: аА + bВ = сС + dD определяется так: Ср(А),, Ср(В), Ср(С), Ср(D) – мольные теплоемкости веществ А, В, С, D при р = const; ∆Ср - общее изменение в реакции мольных теплоемкостей веществ А, В, С, D; a, b, c, d – стехиометрические коэффициенты для этих веществ в уравнении данной химической реакции. Второе начало (закон) термодинамики Значение второго начала Все процессы можно разбить на две группы: 1. Процессы, не требующие затраты энергии извне, в результате которых может быть совершена работа против внешних сил – самопроизвольные процессы; 2. Процессы, для осуществления которых требуют-ся затраты энергии извне - несамопроизвольные про-цессы (подъем груза, переход тепла от горячего тела к холодному, разложение воды на водород и кислород…) 1-е начало термодинамики позволяет составить энергетический баланс системы или процесса. С помощью закона Гесса, основного закона термохимии, и его следствий, можно рассчитать тепловые эффекты как самопроизвольных и несамопроизвольных реакций, так и вообще реально не осуществимых. 2-е начало т/д-ки: 1) позволяет установить принципиальную осуществи-мость интересующего нас процесса; 2) определяет, какие из процессов в данной системе при заданных условиях могут протекать самопроизво-льно – т.е. вводит критерий самопроизвольного протекания того или иного процесса; 3) устанавливает предел самопроизвольного протека-ния того или иного процесса, т.е. состояния равновесия 4) дает возможность определить внешние условия для протекания интересующего нас процесса в нужном направлении и в нужной степени – все это имеет большое значение для решения множества научных и технологических задач. Второе начало термодинамики, вместе с первым началом, устанавливает точные количественные соотношения между различными макроскопическими параметрами систем в состоянии термодинамического равновесия. Формулировкавторого закона термодинамики Клаузиуса Р. (1850 г.): а) Невозможен процесс, при котором теплота переходила бы от тел более холодных к телам более нагретым. Для количественной оценки степени необратимости реальных процессов Клаузиус Р. (1865 г.) ввел новую т/д-кую величину, названную им «энтропия» (от греч. «поворот, превращение»). Энтропия (S) – величина, изменение которой в ходе равновесного процесса при изотермическом сообщении системе некоторого количества теплоты равно отношению теплового эффекта этого процесса (Q, ∆Н) к абсолютной температуре (Т): ∆S > ∆Н / Т (при р,Т = const). (При этом знак = относится к обратимым процессам, а знак > - к необратимым) Энтропия – т/д-кая функция состояния системы, определяющая меру вероятности состояния, разупорядоченности (хаоса) системы. Как любая функция состояния, энтропия не зависит от пути процесса и определяется начальным и конечным состояниями системы. Энтропия в разных формулировках выражает суть второго закона (начала) термодинамики. Предложено несколько формулировок второго начала. 1. Согласно Клаузиусу Р. (1850 г.): а) В изолированных системах (Q=0, А=0, U= сопst) самопроизвольно идут только те процессы, которые сопровождаются ростом энтропии системы, т.е. ∆S > 0. Иначе: изолированная система всегда стремится достичь состояния с максимальной энтропией (максимальным беспорядком), т.е состояния термодинамического равновесия. б) Любой самопроизвольный процесспротекает в направлении, при котором система переходит из менее вероятного состояния в более вероятное, сопровождающееся увеличением энтропии, т.е. ∆S > 0. Энтропия – мера приближения системы к равновесию Равновесное состояние является наиболее вероятным состоянием любой системы, и в этом состоянии ееэнтропиямаксимальна. 2. Энтропию как меру хаотичности системы, ее разупорядоченности определяют выражением Л. Больцмана: S = RlnWили S = КБlnW, где R – универсальная газовая постоянная; КБ – постоянная Больцмана (КБ = R /NA), W – т/д-кая вероятность состояния системы, равная числу мик-росостояний системы, т.е. числу возможных рас-пределений каждой ее частицы по координатам и скоростям (параметров положения и скорости каж-дой частицы системы) при данных температуре, объеме, давлении и количестве частиц. Из выражения Больцмана следует: при повы-шении температуры энтропия возрастает, при охлаждении – уменьшается и при приближении к абсолютному нулю стремится к нулю. - Это и позволяет сделать вывод об энтропии как мере хаотичности, неупорядоченности системы. Энтропия является аддитивной величиной: энтропия системы равна сумме значений энтропии ее компонентов (исключение составляют растворы). Термодинамическая вероятность состояния системы в случае обратимых процессов остается постоянной: W1 =W2 и ∆S = 0 (W1 и W2 - т/д-кие вероятности состояний 1 и 2 системы, тогда lnW1 = lnW2 , W1 / W2= 1,ln(W1 / W2) = 0 и ∆S = 0). В необратимых процессах W1 < W2,lnW1 / lnW2 < 1 и энтропия возрастает: ∆S > 0. Это означает, что необратимый процесс переводит систему в более вероятное состояние. Поскольку энтропия- мера хаотичности (разупорядоченности) системы, то она возрастает (∆S > 0) при переходе вещества в менее упорядоченное состояние: из кристаллического - в жидкое, из жидкого (или твердого) - в газообразное состояние, при растворении кристаллов, при расширении газов, при химических взаимодействиях, приводящих к увеличению числа частиц, и прежде всего - в газообразном состоянии. Напротив, все процессы, в результате которых упорядоченность системы возрастает (конденсация, полимеризация, сжатие, уменьшение числа частиц), сопровождаются уменьшением энтропии (∆S < 0). |
