План лекц.. Строение вещества. I. Строение атома
 Скачать 14.08 Mb. Скачать 14.08 Mb.
|
|
Качественная характеристика полярной связи – разность относительных электротрицательностей (|∆ОЭО|)связанных атомов: чем она больше, тем более полярна ковалентная связь. Количественная характеристика полярной связи, т.е. мера полярности связи и сложной молекулы - электрический момент дипо-ля μсв, равный произведению эффективного заряда δ на длину диполя lд: μсв = δ ∙ lд. Единица измерения μсв – Дебай. 1Дебай = 3,3.10 -30 Кл/м. Электрический диполь – это электрически нейтральная система двух равных и противоположных по знаку электрических зарядов +δ и –δ. Дипольный момент (электрический момент диполя μсв) – векторная величина. Принято считать, что направление вектора от (+) к (–)совпадаетс направлением смещения области общей электронной плотности (суммарного электронного облака) поляризованных атомов. Общий дипольный момент сложной многоатомной молекулы зависит от числа и пространственной направленности полярных связей в ней. Таким образом, определение дипольных моментов позволяет судить не только о характере связей в молекулах, но и об их расположении в пространстве, т.е. о пространственной конфигурации молекулы. С увеличением разности электроотрицательностей |∆ОЭО| атомов, образующих связь, электрический момент диполя возрастает. Следует заметить, что определение дипольного момента связи – сложная и не всегда решаемая задача (взаимодействие связей, неизвестность направления μсв и т.д.). Квантово-механические методы описания ковалентной связи –объясняют механизм образования ковалентной связи. Проведенный В.Гейтлером и Ф.Лондоном, нем. учеными (1927гг.), расчет энергетического баланса образования ковалентной связи в молекуле водорода Н2 позволил сделать вывод: природа ковалентной связи, как и любого другого типа химической связи, заключается в электрическом взаимодействии, происходящем в условиях квантово-механической микросистемы. Для описания механизма образования ковалентной химической связи используют два приближенных квантово-механических метода: валентных связей и молекулярных орбиталей – не исключающих, но взаимно дополняющих друг друга. 2.1. Метод валентных связей(МВС или локализованных электронных пар), предложенный В. Гейтлером и Ф. Лондоном в 1927г.,основывается на следующихположениях: 1) химическая связь между двумя атомами возникает в результате частичного перекрывания атомных орбиталей с образованием общей электронной плотности совместной пары электронов с противоположными спинами, - более высокой, чем в других областях пространства вокруг каждого ядра; 2) ковалентная связь образуется лишь при взаимодействии электронов с антипараллельными спинами, т.е. с противоположными по знаку спиновыми квантовыми числами mS= + 1/2; 3) характеристики ковалентной связи (энергия, длина, полярность и др.) определяются видом связи (σ–, π –, δ –), степенью перекрывания АО (чем она больше, тем прочнее химическая связь, т.е. выше энергия связи и меньше длина), электроотрицательностью взаимодействующих атомов; 4) ковалентная связь по МВС может образоваться двумя способами (двумя механизмами), принципиально разными, но имеющими одинаковый результат – обобществление пары валентных электронов обоими взаимодействующими атомами: а) обменным, за счет перекрывания одноэлектронных атомных орбиталей с противоположными спинами электронов, когда каждый атом дает для перекрывания по одному электрону на связь – при этом связь может быть как полярной, так и неполярной, б) донорно-акцепторным, за счет двухэлектронной АО одного атома и свободной (вакантной) орбитали другого, по которому один атом (донор) предоставляет для связи пару электронов, находящихся на орбитали в спаренном состоянии, а другой атом (акцептор) – свободную орбиталь. При этом возникает полярная связь. 2.2. Комплексные (координационные) соединения, многие молекулярные ионы, являющиеся комплексными, (аммония, тетрагидрида бора, др.) образуются при наличии донорно-акцепторной связи – иначе, координационной связи. Например, в реакции образования иона аммония NH3 + H+ = NH4+ молекула аммиака NH3 - донор пары электронов, а протон Н+ - акцептор. В реакции ВН3 + Н – = ВН4– роль донора электронной пары играет гидрид-ион Н–, а акцептора – молекула гидрида бора ВН3, в которой имеется вакантная АО. Кратность химической связи. Связи σ-, π– , δ–. Максимальное перекрывание АО разного типа (с установлением наиболее прочных химических связей) достигается при их определенной направленности в пространстве, вследствие разной формы их энергетической поверхности. Тип АО и направление их перекрывания определяют σ-, π– , δ– связи: σ (сигма)–связь – это всегда одинарная (простая) связь, возникающая при частичном перекрывании одной пары s-, px-, d- АО вдоль оси, соединяющей ядра взаимодействующих атомов. Одинарные связи всегда являются σ– связями. Кратные связи – π (пи)– (также δ (дельта)–связи), двойные или тройные ковалентные связи, осуществляемые соответственно двумяили тремя парами электронов при перекрывании их атомных орбиталей. π (пи)– связь осуществляется при перекрывании рy-, pz - иd- АО по обе стороны оси, соединяющей ядра атомов, во взаимно перпендикулярных плоскостях; δ (дельта)– связь возникает при перекрывании двух d-орбиталей, расположенных в параллельных плоскостях. Самой прочной из σ-, π– , δ– связей являетсяσ– связь, но π– связи, налагаясь на σ– связь, образуют еще более прочные кратные связи: двойные и тройные. Любая двойная связь состоит из одной σ– и одной π– связей, тройная – из одной σ– и двух π– связей. 2.4. Гибридизация ковалентной связи. В образовании нескольких химических связей часто участвуют разные электронные орбитали одного и того же атома (s-, р-, d-, f- AO). При образовании молекул происходит изменение формы и энергии различных АО. Вместо, например, s- и р–орбиталей образуются равноценные sр-, sp2-, sp3- гибридные орбитали, т.е. происходит гибридизация – процесс смешения различных атомных орбиталей с образованием равноценных гибридных орбиталей, одинаковых по форме и энергии. Число гибридных орбиталей всегда равно общему числу исходных атомных орбиталей. Необходимое условие возникновения гибридных орбиталей: исходные АО должны иметь небольшую разницу в энергиях. Например, 1s-орбитали не могут гибридизоваться с 2р-орбиталями из-за сильного различия их энергий. Прочность химических связей, образованных с участием гибрид-ных орбиталей, выше, чем связей за счет чистых негибридных АО. Гибридизация АО определяет пространственную конфигурацию молекул. Так, при sр – гибридизации молекулы имеют линейную форму, при sр2 – гибридизации – плоскую треугольную, с валентными углами 120°; в случае sр3 – гибридизации образуются тетраэдрические структуры с валентными углами 109°. Таблица. Типы молекул и гибридизации связей, соответствующие им пространственные структуры и примеры. Тип молекулы (и гибридизации) Пространственное строение Примеры АВ2 (sp- гибр.) а) угловое а) Н2О, Н2S, OF2, SO2; б)линейное б) ВеСl2, CO2, CS2. AB3 (sp2- гибр.) а) пирамидальное а) NH3, PCl3, AsH3; б) треугольное б) ВСl3, AlBr3. АВ4 (sp3- гибр.) тетраэдрическое СН4, ССl4, SiH4. Метод валентных связей (МВС) является основой современной теории химической связи. Достоинства МВС: 1)достаточно прост и нагляден, 2) позволяет получать информацию о структуре и свойствах различных соединений. Недостаток МВС – не объясняет ряд экспериментальных фактов: 1) существование устойчивых, не склонных к ассоциации молекул, таких как О2, В2, NO, имеющих неспаренные электроны, и их магнитные свойства (в частности, парамагнитность); 2) существование двухатомных молекул Ве2, Мg2, Са2 и других активных металлов IIA-подгруппы и их крайне малую энергию связи; 3) факт упрочнения связи между атомами в молекулах О2, F2 после отрыва одного электрона и превращения их в молекулярные ионы; почему при ионизации молекулы все связи в образовавшемся молекулярном ионе сохраняют свою равноценность (как, например, в ионе СН4+) – и других. Такие явления и свойства можно понять с позиций метода молекулярных орбиталей), который считают более общим и универсальным методом. Метод молекулярных орбиталей (ММО). В методе МО Р.Малликена и Ф.Гунда (1928-30 гг.), молекула рассматривается как единая система ядер и электронов взаимодействующих атомов, а не как простая совокупность атомов, сохраняющих некоторую индивидуальность. Она образуется, если энергия такой системы ниже, чем энергия исходных частиц. В основе метода МО лежит представление об общих молекулярных орбиталях (МО) валентных электронов взаимодействующих атомов: При образовании молекулы возникают МО двух видов: связывающие (МОсв) и разрыхляющие (МО*),- соотношение которых определяет существование и устойчивость образующейся структуры. Если при образовании молекулы переход электрона с атомной орбитали на МО сопровождается уменьшением энергии, то образуется МОсв, если увеличением энергии, то – МО*, разрыхляющая. Метод МО - один из наиболее распространенных в настоящее время методов квантовой химии, образующий основу многих модельных представлений современной химии, в том числе зонной теории кристаллов. Основные положения метода молекулярных орбиталей с линейной комбинацией атомных орбиталей (ММО ЛКАО): 1. В поле ядер связанных атомов, как и в свободных атомах, имеются разрешенные квантовые состояния электронов - волновые функции Ψ(x, y, z), определяющие энергетические уровни в молекуле и общие для обоих атомов области наиболее вероятного нахождения электронов – молекулярные орбитали (МО), заполняющиеся обобществленными электронами этих атомов. Каждой МО соответствует свой набор молекулярных квантовых чисел. Иными словами, электроны в атоме принадлежат не каждому атому в отдельности, а всей молекуле в целом, занимая молекулярные орбитали, которые охватывают все ядра атомов в молекуле и заполняют весь объем молекулы. Таким образом, метод МО рассматривает молекулу как ˝многоатомный атом˝, в котором электроны располагаются на орбиталях, называемых молекулярными; 2. Для построения волновых функций МО каждую молекулярную орбиталь описывают каклинейную комбинацию (сложение или вычитание) близких по энергии атомных орбиталей (волновых функций ΨАи ΨВ) двух взаимодействующих атомов, А и В: МО = к1 ΨА+ к2 ΨВ . При сложении волновых функций атомов образуется молекулярная орбиталь с меньшей энергией – связывающая МО (МО св), при вычитании – разрыхляющая МО (МО*)с повышенной по сравнению с энергией атомных орбиталей энергией: МО св = к1 ΨА + к2 ΨВ , МО* = к1 ΨА - к2 ΨВ . Коэффициенты к1 и к2 зависят от электроотрицательностей атомов, энергетического состояния каждой АО и определяют долю участия соответствующих атомных орбиталей в молекулярных. Когда взаимодействуют одинаковые атомы, то к1 = к2 и образуется неполярная связь. Для характеристики связи в соединениях различных атомов учитывают электроотрицательности атомов. Атомные орбитали более электроотрицательного атома принимают большее участие в формировании связывающих МО и меньшее – разрыхляющих, поэтому энергетически ближе расположены к связывающим МО и дальше - от разрыхляющих. Наоборот, АО менее электроотрицательного атома сильнее энергетически отличаются от связывающих МО и ближе к разрыхляющим. 3. Связывающая МО имеет повышенную электронную плотность и более низкую энергию, т.к. образуется при перекрывании (суперпозиции) АО электронов с антипараллельными спинами. Она повышает устойчивость связи. Разрыхляющие МО возникаютпри взаимодействии электронов с параллельными спинами. Отталкивание таких электронов друг от друга соответствует операции вычитания их волновых функций (атомных орбиталей). При этом электронная плотность между ядрами атомов равна 0, атомы расталкиваются, общая энергия такой системы повышается, а устойчивость - падает. 4. Молекулярные орбитали,обозначаемые св–, св–, св–, φ св – МОсв (связывающие) и *–, *–, *–, φ*–МО*(разрыхляющие), образуются путем линейной комбинацииs–, р–, d–, f– АО, не только близких по энергии, но и с одинаковой симметрией относительно межъядерной оси обеих связанных частиц. Число образующихся МО равно общему числу исходных АО. Например, – МО комбинируется из s– и рх –АО с одинаковой симметрией относительно оси связи ядер атомов, с образованием различных по энергии МО, связывающих и разрыхляющих: две s-АО образуют две σs–МО, σSсв - и σS*-, а две рх–АО образуют две σpX-МО: σpXсв- и σpX*-МО. Взаимодействие ру-ирz–АО дает две пары разных по энергии (пару связывающих и пару разрыхляющих) πру -πрz -МО, в каждой из которых - две энергетически эквивалентных орбитали, занимающих один уровень энергии: πрусв- πрzсв- и πру*-πрz*-МО. Таким образом, три р-АО ( pX, рY, рZ – АО) каждого атома (всего шесть) дают три связывающих и три разрыхляющих МО: σpXсв, πрYсв, πрZсв и σpX*, πрY*, πрZ* ; 5. Совокупность молекулярных орбиталей, занятых электронами, называют электронной конфигурацией молекулы, которую описывают электронной формулой МО. Порядок размещения электронов по молекулярным орбиталям устанавливается по тем же принципам и правилам, что при заполнении АО - наименьшей энергии, Паули, Гунда: 1) молекулярные орбитали заполняются в порядке возрастания их энергии, начиная с орбитали самого низкого энергетического уровня. Например, у частиц, образованных элементами до кислорода, молекулярные орбитали заполняются в следующем порядке: 1sсв <1s* < 2sсв < 2s*<2рх св <2русв =2рzсв < 2русв =2рzсв <2рх*. Участиц, образованных кислородом и другими элементами II периода, стоящими после кислорода, энергия 2рх св-МО выше, чем2русв =2рzсв-МО: 1sсв <1s* < 2sсв < 2s*<2русв =2рzсв < 2рх св <2русв =2рzсв <2рх*. 2) в соответствии с принципом Паули: в молекуле не может быть даже двух электронов со всеми 4-мя одинаковыми квантовыми числами n, l, ml, ms (электронов, одновременно находящихся на одной молекулярной орбитали), т.е. на каждой МО может быть не более двух электронов с антипараллельными спинами ; 3) по правилу Гунда: энергетически равноценные МО одного квантового уровня заселяются сначала одиночными электронами, а затем происходит спаривание новых электронов с уже имеющимися. 6. Схему формирования молекулярных орбиталей принято изобра-жать в виде энергетической диаграммы МО. По вертикали откладывают значения (уровни) энергии, по горизонтали на соответствующих энергети-ческих уровнях – квантовые ячейки: в центре - МО образующегося соеди-нения, а по обе стороны от уровней МО располагают уровни и квантовые ячейки исходных АО. Атомные орбитали более электроотрицательного элемента всегда ниже АО менее электроотрицательного. Связывающие МО находятся ниже исходных АО. 7. Устойчивое соединение с ковалентной химической связью образуется только в том случае, если число электронов на связывающих МО больше числа электронов на разрыхляющих МО. Полуразность числа связывающих и разрыхляющих электронов называют в ММО порядком связи (п): п =1/2(NeСв – Ne*). Чем больше порядок связи, тем выше устойчивость соединения. Порядок, равный нулю, означает получение неустойчивого соединения. 8. Молекулярная орбиталь, а значит, и химическая связь, могут быть образованы не только парой обобществленных электронов, но и единственным, неспаренным, электроном, если он занимает св-МО. Связь, образованная одним электроном, слабее двухэлектронной связи. При этом полученные молекулярные частицы, имеющие на МО неспаренные электроны, обладают парамагнитными свойствами (втягиваются во внешнее магнитное поле). Соединения, в которых все электроны на МО – парные, являются диамагнитными(выталкиваются из внешнего магнитного поля). 9. Существует еще третий вид МО - несвязывающие МО (например, 0ру – s и 0рz –s), энергетические уровни которых не отличаются от уровней образующих их АО. Поэтому несвязывающие МО не влияют на устойчивость соединения и более подробно не рассматриваются. Пример. Описать схемы процессов образования из атомов и электронные конфигурации (в виде электронных формул) следующих частиц: а) молекулы Н2 ; б) молекулярного иона Н2+; в) молекулы NO. Решение. Схему процесса образования записывают с указанием электронных формул взаимодействующих атомов и полученных молекул в квадратных скобках. а) у молекулы Н2 два электрона на 1sсв – МО, по одному от каждого атома Н.Схема образованияН2: 2Н [1s1] → H2 [(1sсв)2]. Порядок связи равен 1 (п=2-0/2), молекула устойчива. Электроны спарены, значит, молекула диамагнитна. б) молекулярный ион Н2+ образуется по схеме: Н [1s1]+ Н+[1s1]→ Н2+[(1sсв)1]. На 1sсв – МО у него один электрон, ион парамагнитен. Порядок связи п = ½. в) молекула NO состоит из атомов разных элементов II периода (гетероядерная), полная схема образования ее: N7[1s22s22p3] + O8[1s22s22p4] → → NO [(1sсв)2(1s*)2(2sсв)2(2s*)2(2русв)2(2рzсв)2(2рх св)2(2ру*)1]. Краткую схему записывают, обозначая невалентные слои электронов 1-го, 2-го, 3-го и т.д. энергетических уровней буквами К, L, M и т.д., соответственно: N7[К 2s22p3] + O8[К 2s22p4] →NO[КК(2sсв)2(2s*)2(2русв)2(2рzсв)2(2рхсв)2(2ру*)1]. Молекула NO устойчива (порядок связи больше 0: п=(8 - 3)/2=2,5) иобладает парамагнитными свойcтвами, т.к. имеет один неспаренный электрон на2ру*. 3. Ионная химическая связь (электровалентная, гетерополярная) - электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает лишь в случае большой разности электроотрицательности взаимодействующих атомов, например, между металлами IA, IIA-групп (s – элементами) и неметаллами VIA, VIIA-групп Периодической системы (р – элементами) - LiF, CsCl, К2О и др. Как показывают экспериментальные исследования и квантово-механические расчеты, полностью ионной связи не существует. Ионная связь – предельно полярная ковалентная связь. Чем больше разность электроотрицательностей атомов в молекуле, тем больше степень ионности химической связи. Между ионной и ковалентной связями нет четкой границы. Даже при взаимодействии щелочных металлов IA-группы с галогенами VIIA-группы не происзодит полного удаления электрона у щелочного металла и присоединении его к более электроотрицательному атому галогена. Электрон только смещается к галогену, образуя около него область повышенной электронной плотности. Ионная связь не имеет свойств насыщаемости и направленности. Это приводит к образованию ионных кристаллов – своего рода гигантских полимерных молекул. Главное отличие ионных кристаллов от ковалентных в том, что в узлах кристалличекой решетки у ионных соединений находятся положительные и отрицательные ионы, а у ковалентных – атомы или молекулы. Понятие валентности к ионной связи неприменимо. Каждый ион имеет неограниченное число связей с другими ионами, нахдящимися относительно этого иона в ближнем и дальнем порядке. Каждый ион окружен сферическим электрическим полем, действующим на любой другой ион независимо от места расположения. Сила взаимодействия между ионами определяется только величиной их заряда и расстоянием между ними в соответствии с законом Кулона. 4. Металлическая связь - – многоцентровая делокализованная химическая связь, характерная для металлов и металлоподобных веществ в конденсированном (жидком, т.е. расплавленном, или твердом) состоянии, основанная на обобществлении валентных электронов атомов всей структурой вещества и удерживающая атомы в единой кристаллической решетке. В паро- и газообразном состоянии атомы всех веществ, в том числе металлов, связаны между собой только ковалентной связью. В соответствии с положением в Периодической системе атомы металлов имеют небольшое число валентных электронов и, напротив, большое количество незаполненных орбиталей на внешнем квантовом уровне. За счет этого атомы металла упаковываются в кристаллической решетке с максимально возможной плотностью так, чтобы их незаполненные орбитали оказались как можно более полно заселены небольшим числом валентных электронов соседних атомов. В этих условиях валентные электроны (их часто называют электронным газом) достаточно слабо связаны со своими ядрами и поэтому обладают большой свободой перемещения по доступным орбиталям всех атомов, обеспечивая связь между ними в кристалле металла. Иными словами, металлическая связь - это химическая связь, обусловленная взаимодействием электронного газа с остовом решетки кристалла , в узлах которой - атомы и ионы (катионы) металлов или, в более сложных металлоподобных структурах - атомы и ионы металлов и неметаллов . Непрерывное движение электронов в кристалле обусловливает динамическое равновесие процессов перехода атомов металла в ионы и наоборот. Металлическая связь в наиболее чистом виде осуществляется между атомами типичных металлов, к которым относят щелочные и щелочноземельные металлы IA- и IIA-групп. Это наиболее реакционноспособные металлы, в силу слабой связи своих одного – двух валентных электронов с ядрами атомов и низких значений энергии ионизации. Чрезвычайной химической активностью объясняют многие физические свойства их кристаллов: мягкость, непрочность в обычных условиях, небольшие плотности и температуры плавления, кипения. Наличием свободных электронов объясняют общие свойства большинства других металлов: металлический блеск, высокие пластичность, теплопроводность и электропроводность, механическая прочность. Самыми пластичными металлами считают медь, серебро, золото. Наибольшие тепло- и электропроводность имеют серебро, медь, золото, алюминий, железо; наименьшие – марганец, свинец и ртуть. Теплопроводность вызвана обменом энергии при столкновении свободных электронов с колеблющимися ионами и атомами и обеспечивает выравнивание температуры во всем объеме металла. С увеличением числа валентных электронов и уменьшением межатомного расстояния в металлических кристаллах возрастают механическая прочность, твердость, плотность, температуры плавления и кипения. У переходных металлов (элементов побочных Б- подгрупп) V, VI, VII, VIII групп наблюдаются самые прочные кристаллические решетки, самые высокие плотности, температуры плавления и кипения, значения энергии атомизации, межатомные расстояния. Такие физические свойства металлов свидетельствует об определенной доле ковалентности в связях между атомами. Например, установлено, что такой типично переходный металл, как ниобий (VB-группа), имеет концентрацию свободных электронов всего 1,2 моль электронов на моль атомов ниобия. Остальные электроны (3,8 моль их на 1моль атомов, т.е 76%, большая часть свободных электронов) осуществляют направленные ковалентные связи между соседними атомами. Во многих металлах металлическая связь включает и вклад ионной составляющей, когда, например, одноименно заряженные ионы электростатически отталкиваются. Индивидуальные свойства металлов зависят от кристаллических решеток, тип которых определяется размерами атомов и числом валентных электронов. Типы образуемых металлами кристаллических решеток (кубическая гранецентрированная, кубическая объемноцентрированная и гексагональная) зависят от положения соответствующих элементов в Периодической системе элементовД.И.Менделеева. Например, металлы IА-группы образуют кубические гранецентрированные и объемноцентрированные решетки, а металлы IIА-группы– в основном гексагональные. Гранецентрированные кристаллические решетки характерны для металлов побочных подгрупп, таких как медь, серебро, золото, никель, палладий и платина. В настоящее время для объяснения особенностей металлической связи в разных структурах используются современные квантово-механические модели, например, зонная теория металлов, в основе которой – метод МО. 5. Водородная связь. 6. Межмолекулярные взаимодействия: ион-дипольные, водородные и невалентные - Ван-дер-Ваальса (3 типа). Супер- и супрамолекулярные соединения образуются за счет невалентных водородных и межмолекулярных сил взаимодействия. 7. Агрегатные состояния веществ (газообразное и конденсированные), особенности их строения и свойств. Диаграммы состояния. 3.2. Примеры решения типовых задач Задача 1. Какую валентность и степень окисления имеют элементы в соединениях Na3N, F2, BCl? Показать направление перекрывания электронных облаков, конфигурацию молекул и типы связей по направлениям. Решение. а) Na3N: поскольку Na в соединениях всегда имеет степень окислениия (с.о.), равную +1, то с.о.(N) = – 3. П 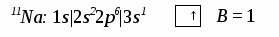 остроим электронные формулы Na и Nи краткие электронно-графические формулы, иначе – схемы заполнения электронами их АО внешнего энергетического уровня: В 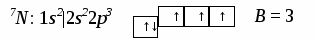 алентность элемента определяется количеством неспаренных электронов на внешнем энергетическом уровне, поэтому валентность Na равна 1. Поскольку валентный электрон находится в s–состоянии, формой его электронного облака является сфера. Атом азота имеет три неспаренных р–электрона на внешнем энергетическом уровне, поэтому его валентность В = 3. Поскольку у азота в соединении Na3Nстепень окисления (по модулю) и валентность численно совпадают, то гибридизации атома не будет. Три валентных р–электрона имеют форму электронного облака в виде гантели и располагаются в околоядерном пространстве п 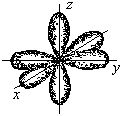 о взаимно перпендикулярным осям: В 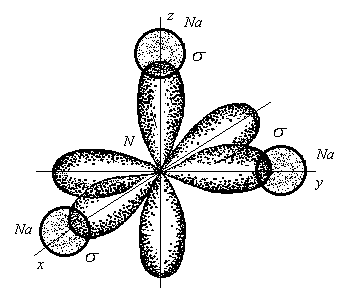 молекуле Na3N каждый валентный р–электрон азота перекрывается с валентным s–электроном каждого из трех атомов натрия. Таким образом, конфигурация молекулы будет следующей: Поскольку перекрывание s– и р– электронов находится на оси, соединяющей центры атомов, то по всем направлениям имеет место σ– связь. б) F2 – простое вещество, поэтому степень окисления его (с.о.) равна 0. Электронная формула атома фтора и схема заполнения его валентных АО: Н 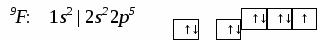 а внешнем энергетическом уровне атома F находится один неспаренный рX–электрон. Поэтому валентность фтора, В(F) = 1; рX–электрон имеет конфигурацию электронного облака в  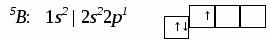 ) В молекуле BCl3степени окисления хлора и бора: с.о.(Cl) = –1, с.о.(В) = +3. Построим электронные формулы и схемы заполнения валентными электронами АО (BиCl): Поскольку атом бора имеет один неспаренный рX–электрон на внешнем энергетическом уровне, то в невозбужденном состоянии его валентность В = 1. Степень окисления бора в соединении BCl3 не совпадает с этой валентностью, значит, при взаимодействии атома бора с хлором происходит его возбуждение, распариваниеs–электронов, переход одного из них во вторую ячейку р–подуровня и гибридизация. Электронная формула атома бора в возбужденном состоянии и схема распределения валентных электронов по АО имеют следующий вид: 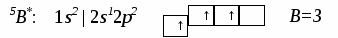 Химическая термодинамика и самопроизвольное протекание процесса Любой самопроизвольный процесспротекает в направлении, при котором система переходит из менее вероятного состояния в более вероятное, сопровождающееся увеличением энтропии, т.е. ∆S > 0. Это – условие, критерий самопроизвольного протекания процессов в изолированной системе. Чтобы ответить на главный вопрос: как с по-мощью 2-го начала термодинамики предсказать возможность самопроизвольного химического или физико-химического процесса – используют две термодинамические (характеристические)функции – 2 т/д-ких потенциала – – в зависимости от условий протекания процесса: 1) При p, T = constиспользуютизобарно–изотер-мичеcкийпотенциалG-свободную энергию Гиббса:G=H–TS; 2) При V,T = constиспользуют изохорно–изотер-мичеcкий потенциалF-свободную энергию Гельмгольца:F=U–TS Все потенциалы имеют размерность энергии Е (кДж) и все они не имеют абсолютного значения (в отличие от энтропии) Зависимость т/д-ких потенциалов от их естественных переменных (Р, V, Т) описывается основным уравнением т/д-ки, которое объединяет 1-е и 2-е начала. Это уравнение записывают в эквивалентных формах: 1)∆G= V∆р - S∆Т 2) ∆F= - S∆Т - р∆V Энергия Гиббса (Р, Т = соnst). Направление, в котором любой физический или химический процесс протекает самопроизвольно, определяется совместным действием двух факторов: 1) энтальпийным, т.е. тенденцией к переходу системы в состояние с наименьшей внутренней энергией (или энтальпией)∆Н< 0; и 2) энтропийным, т.е. тенденцией к достижению наиболее вероятного состояния, т.е. максимальногочисла частицсистемы, большего беспорядка в ней. Энергия Гиббса - термодинамическая функциясостояния, учитывающая влияние энтальпийного и энтропийногофакторов (∆Н < 0, ∆S > 0) на возможность и направле-ние протекания любогосамопроизвольного химического процесса в изобарно-изотерми-ческих условиях: ∆G = ∆Н – Т∆S. Стандартную энергию Гиббса образования (∆fG0) относят к 1 молювещества и обычно выражают в кДж/моль; при этом∆fG0образования наиболее устойчивой модификации простого вещества принимают равной нулю. Условия стандартного состояния веществ Состояние веществ - Стандартное состояние 1. Простое твердое - Кристаллическое состоя- вещество ние 2. Простое жидкое - Чистая жидкость вещество 3. Газообразное - Давление (парциаль- вещество ное рi или относительное, рi/100 кПа ) 4. Растворенное - Молярная концентрация вещество СМ = 1 моль/л Во многих случаях значениями ∆fG0298можно пользоваться для приближенной оценки направ-ленности химического процесса в нестандартных условиях, принимая, что ∆fG0Т = ∆fG0298. Для любой химической реакции при стандартных условиях ( или близких к ним) изменение энергии Гиббса определяется уравнением: ∆G0х.р.=∑ni∆G0i(продукты) - ∑ni ∆G0i(реагенты) Критерием возможности (самопроизво-льности) протекания процесса, идущего при р, Т = const, при любых иных условиях, явля-ется уменьшение энергии Гиббса (∆G < 0). ∆G – энергия Гиббса, т.е. свободная энергия химической реакции, любого физико-химического процесса, идущего при р, Т = const, - «движущая сила» процесса. Убыль свободной энергии реакции, идущей при р, Т = const, т.е. энергия Гиббса, не зависит от пути процесса и равна максимальной полезной работе реакции: – ∆G = Амах . Самопроизвольный процесс протекает до тех пор, пока система не достигнет минимального значения энергии Гиббса (Gmin = 0). При ∆G = 0 система переходит в состояниетермодинамического равновесия. Из выражения ∆G = ∆Н – Т∆S, видно, что при температурах, близких к 0 К (Т∆S = 0), знак и величина ∆G0определяются изменением энта-льпии реакции, т.е. при низких температурах направление реакции определяется разницей в прочности химических связей продуктов и исходных веществ. Например, тот факт, что х.р.: Н2(г) + Cl2(г) = 2 HCl(г), ∆Н0х.р.= -184,8 кДж - протекает с уменьшением энтальпии, указывает на то, что связи в HCl(г) прочнее, чем средние значения связей в молекулах исходных веществ. Разрыв химических связей всегда требует затраты энергии, равной сумме энергий разрушаемых свя-зей. Соединение атомов в молекулы сопровожда-ется выделением энергии, равной сумме энергий образующихся связей. Разность между энергией, затраченной на разрушение связей в реагентах, и энергией, полученной при образовании новых свя-зей в молекулах продуктов, и составляет энталь-пию химической реакции ∆Н0х.р.. |
