Токсиколгия. Токсикология
 Скачать 128.06 Kb. Скачать 128.06 Kb.
|
|
Специфика, причины и механизм токсического действия Понятие «химическая травма» Острые отравления целесообразно рассматривать как химическую травму, развивающуюся вследствие введения в организм токсической дозы чужеродного химического вещества. Последствия, связанные со специфическим воздействием на организм токсического вещества, относятся к токсикогенному эффекту химической травмы. Он носит характер патогенной реакции и наиболее ярко проявляется в ранней стадии острых отравлений – токсикогенной, когда токсический агент находится в организме в дозе, способной оказывать специфическое действие. Одновременно могут включаться патологические процессы, лишенные «химической» специфичности. Таким образом, общий токсический эффект является результатом специфического токсического действия и неспецифических реакций организма. В токсикогенной фазе отравления выделяют два основных периода: период резорбции, продолжающийся до момента достижения максимальной концентрации токсичного вещества в крови, и период элиминации, от окончания момента резорбции до полного очищения крови от яда. С точки зрения токсикодинамики специфическая симптоматика отравлений, отражающих «избирательную токсичность» ядов, наиболее ярко проявляется в токсикогенной фазе, особенно в период резорбции. Для последнего характерно формирование тяжело протекающих патологических синдромов острых отравлений, таких как экзотоксический шок, токсическая кома, асфиксия и др. В соматогенной фазе обычно развиваются патологические синдромы, лишенные выраженной токсической специфичности. Они трактуются как осложнения острых отравлений – это пневмония, острая почечная недостаточность, сепсис и др. Фазы и периоды отравлений представлены на схеме 2. Фазы и периоды отравлений  Схема 2. Основные факторы, определяющие развитие острого отравления. R – пространственный, С – концентрационный, t – временной. Теория рецепторов токсичности Представление о рецепторе как месте конкретного приложения и реализации токсичного действия яда до настоящего времени остается недостаточно ясным, несмотря на то, что эта идея была выдвинута Дж. Ленгли более ста двадцати лет назад. Рецепторы (от лат. «rezeptiо» – принимать) – это органы или устройства, принимающие из внешней или внутренней среды организма и передающие их в центральную нервную систему. В токсикологическом понимании термин «рецептор» был предложен в начале 20-го века немецким ученым Эрлихом. Это получило научное обоснование после количественных исследований А. Кларка (1937 г.), показавшего, что между чужеродными веществами и их рецепторами возникает связь, по-видимому, аналогичная взаимодействию субстрата со специфическим ферментом. Ферменты. Помимо тканевых белков в организме есть особые, специфические белки, называемые ферментами. Такие белки являются биологическими катализаторами, способными в очень высокой степени направлять, ускорять или замедлять химические процессы в организме и тем самым оказывать решающее влияние на жизненные процессы. Ни один процесс в организме не обходится без ферментов. Они расщепляют сложные вещества пищевых продуктов на более простые и синтезируют из простых веществ необходимые для организма сложные соединения; участвуют в химических превращениях, обеспечивающих организм энергией; регулируют деятельность нервной системы и многое, многое другое. В живом организме имеется свыше тысячи различных ферментов. Характерной особенностью ферментов является специфичность их действия; каждому типу химических превращений соответствует свой наиболее активный вид фермента. Некоторые ферменты имеют широкий диапазон действия, область действия других ограничена активным участием в каком-нибудь одном превращении. Например, очень важную роль в деятельности нервной системы играет особое вещество – ацетилхолин. Оказалось, что это вещество образуется только при помощи фермента холинацетилазы, а разрушение ацетилхолина происходит при обязательном участии фермента холинэстеразы. Несмотря на столь важное значение ферментов для деятельности организма, количественное содержание каждого из них чрезвычайно мало по сравнению с количеством белков, входящих в состав тканей. Естественно, что только благодаря очень высокой производительности этих небольших количеств ферментов обеспечивается нормальное существование живых организмов. Фермент пепсин, к примеру, за 1,5-2 ч. в мягких условиях организма расщепляет яичный белок, чего нельзя достигнуть без фермента за такой короткий срок даже при помощи самых активных химических реагентов; известно также, что одна молекула холинэстеразы за 1 сек. расщепляет примерно 10000 молекул ацетилхолина. В живом организме деятельность всех ферментов строго согласована и координирована, тем самым обеспечивается существование белковых тел и непрерывный обмен с окружающей средой; нарушение нормальной деятельности ферментов приводит к заболеванию или гибели организма. В состав любого фермента входит белок, обычно связанный с разнообразными соединениями небелкового характера – коферментами, которые придают всему ферменту высокую каталитическую и специфическую активность. В качестве коферментов могут быть некоторые биологически активные вещества (витамины, гормоны и др.), а также соединения различных металлов. Каждый фермент имеет определенный объем и определенную поверхность, образованную полипептидными цепями белка. Рельеф поверхности фермента может иметь самые причудливые очертания, определяемые первичной, вторичной и третичной структурами белка, а также функциональными группами аминокислот. В химическом отношении эта поверхность неоднородна и на ней обычно имеется только небольшой участок, так называемый активный центр, ответственный за деятельность фермента. Все химические превращения в организме протекают на поверхности фермента, причем решающее значение имеет активный центр. Очевидно, что специфическое действие фермента, выступающего при этом в качестве реагента, только на вполне определенные вещества (субстраты) и на вполне определенный тип химических превращений связано с более или менее полным соответствием структуры активного центра фермента со структурой субстрата. Чем больше соответствуют эти структуры друг другу, тем ближе подходит субстрат к ферменту; при полном соответствии структур субстрат входит в фермент, как ключ в замок. При этом происходит активация субстрата, вследствие чего он легко подвергается химическим превращениям, быстро освобождая поверхность фермента. На приведенном ниже рисунке изображена схема действия фермента 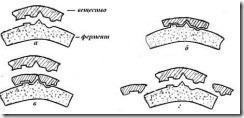 Рис.1. Схема взаимодействия фермента с веществом: а - вещество и фермент удалены друг от друга; б - вещество подошло к ферменту; в - расщепление вещества на ферменте; г - остатки вещества при соответствии его структуры структуре субстрата. Из этого рисунка можно уяснить и один из возможных вариантов нарушения деятельности ферментов. Например, какой-то другой субстрат, с другими свойствами, но обладающий сходной структурой, может присоединиться к ферменту таким образом, что частично или полностью закроет его активный центр и тем самым нарушит или совсем прекратит деятельность фермента (см. рисунок ниже). При этом "ложный" субстрат не подвергается никаким химическим превращениям и в то же время препятствует взаимодействию фермента с его естественным субстратом. 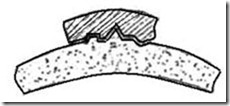 Рис. Блокировка фермента токсичным веществом Вещество закрыло активную часть фермента, расщепление вещества не происходит. Вещества, нарушающие нормальную деятельность ферментов, т.е. обладающие антиферментной активностью, называются ингибиторами. Помимо такого, можно сказать, геометрического подобия структур фермента и субстрата существенное значение имеет и химическое строение активного центра. Высокая реакционная способность активного центра фермента, очевидно, связана с наличием в его структуре тех или иных функциональных группировок, принадлежащих аминокислотам полипептидной цепи, т.е. группировкам ОН, SН, NH2 ,СООН и т.д. При этом решающее значение имеет активация этих группировок, обусловленная влиянием соседних атомных групп и строением всего фермента в целом. Как видно из приведенных примеров, большинство реакционноспособных группировок, входящих в активные центры ферментов, являются нуклеофильными. Поэтому такие группировки, а, следовательно, и ферменты в целом наиболее легко будут вступать в реакции нуклеофильного замещения и присоединения с веществами, химическая активность которых обусловлена наличием электрофильного центра, т.е. будут вступать во взаимодействие с электрофильными реагентами. В соответствии с этим, антиферментной активностью могут обладать галоидированные соединения, производные кислот, соединения, имеющие в своем составе атомы с незаполненной электронной оболочкой, а также полярные молекулы, имеющие атомы с сильно пониженной электронной плотностью. При этом могут протекать процессы алкилирования, ацилирования и комплексообразования. В результате произойдет более или менее сильное нарушение структуры фермента и соответственно этому нарушение его функций, вплоть до полного их прекращения. Поскольку нарушение функций ферментов приводит к нарушению деятельности организма, то вполне оправданным кажется представление о том, что токсическое действие отравляющих веществ связано с их определенно выраженным антиферментным действием. Характер и степень токсического действия отравляющих веществ зависят в основном как от той роли, которую играют в организме поражаемые системы, так и от их способности легко и быстро реагировать с отравляющими веществами, образуя устойчивые соединения. Кроме того, важное значение имеют такие факторы, как восстановление активности ингибированного фермента (реактивация фермента) и скорость образования свежего фермента взамен потерявшего активность. В процессе жизнедеятельности организма происходит непрерывное обновление белковых систем, в том числе и ферментов: разрушение старых, потерявших свою активность белков и образование взамен их новых, работоспособных белков той же структуры и того же назначения. В одних случаях эти процессы происходят медленно и не очень заметно, например отмирание старого рогового слоя кожи и образование нового, в других случаях быстро. Так, гемоглобин, содержащий в своей молекуле 300 аминокислот, образуется всего за 1,5 мин., а в каждую секунду разрушается и заново образуется 3 млн. эритроцитов (форменный элемент крови). Во всех этих и им подобных процессах ткани, клетки и образующийся белок ничем не отличаются от им подобных, как существовавших до них, так и существующих одновременно с ними. Это постоянство строения и функций всех белковых систем обеспечивается аппаратом наследственности, управляющим процессами воспроизводства белков, клеток, тканей и всего организма в целом. Согласно современным представлениям ответственной за воспроизводство является клетка ткани. Сама клетка является сложным образованием, состоящим из оболочки, плазмы и ядра с его оболочкой. В плазме клетки находятся субмикроскопические включения – рибосомы, митохондрии, лизосомы, так называемые органоиды. Очень важную роль в созидательной деятельности клетки играют входящие в ее состав нуклеиновые кислоты (высокомолекулярные соединения небелкового характера), которые впервые были выделены из ядер клеток ("нуклеос" по-латыни – ядро, отсюда и название), хотя впоследствии они были найдены и в других частях клетки. Например, в настоящее время точно установлено, что синтез белка осуществляется в мельчайших образованиях или органоидах клетки при помощи различных нуклеиновых кислот и специфических ферментов. При воспроизводстве белков, клеток, тканей и даже организма в целом возможны всякого рода нарушения работы аппарата наследственности, которые могут привести к тяжелым и даже гибельным для организма последствиям. Эти нарушения могут происходить под влиянием различных факторов, в том числе и под воздействием отравляющих веществ, которые могут либо умертвить клетку, либо затормозить некоторые ее функции, либо извратить созидательную деятельность клетки по синтезу белка, воздействуя на ее нуклеиновые кислоты. Во всех этих случаях отравляющие вещества являются клеточными ядами. В связи с этим можно указать, что некоторые химические соединения изменяют состав нуклеиновых кислот, в результате чего нарушаются процессы воспроизводства и появляются мутации, в подавляющем числе случаев вредные для организма, нарушающие его нормальное функционирование. Степень нарушения функций или поражения организма зависит как от количества и роли претерпевших мутации белков систем, так и от скорости их образования. |
