Таблица А2 – Степени окисления s- и р-элементов
Группа
|
I
|
II
|
III
|
IV
|
V
|
VI
|
VII
|
VIII
|
|
s элементы
|
р элементы
|
Валентные
электроны
|
ns1
|
ns2
|
ns2р1
|
ns2р2
|
ns2р3
|
ns2р4
|
ns2р5
|
ns2р6
|
Элемент
Степени
окисления
|
Li
1
|
Be
2
|
B
3
|
C
4,2
-4
|
N
5,3
-3
|
O
2
-2
|
F
-
-1
|
Ne
-
-
|
Элемент
Степени
окисления
|
Na
1
|
Mg
2
|
Al
3
|
Si
4,2
-4
|
P
5,3
-3
|
S
6,4
-2
|
Cl
1,3,5,7
-1
|
Ar
-
-
|
Элемент
Степени
окисления
|
K
1
|
Ca
2
|
Ga
3
|
Ge
4,2
-4
|
As
5,3
-3
|
Se
6,4
-2
|
Br
1,3,5,7
-1
|
Kr
2,4
-
|
Элемент
Степени
окисления
|
Rb
1
|
Sr
2
|
In
3
|
Sn
4,2
-4
|
Sb
5,3
-3
|
Te
6,4
-2
|
I
1,3,5,7
-1
|
Xe
2,4,6,8
-
|
Элемент
Степени
окисления
|
Cs
1
|
Ba
2
|
Tl
1,3
|
Pb
2,4
-4
|
Bi
3,5
-3
|
Po
4,6
-2
|
At
5,7
-1
|
Rn
(2,4,6,8)
-
|
* Серым выделены символы неметаллов
Приложение Б
Таблица Б1 – Основные классы неорганических веществ
Вещества
|
Классификация
|
Примеры
|
Простые
|
Металлы
|
s– элементы (кроме Н, Не)
р – элементы Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi
d – элементы
f – элементы
|
|
Неметаллы
|
s– элементы Н, Не
р – элементы B, C, Si, N, P, As, O, S, Se, Te
галогены (VII A группа)
благородные газы (VIII A группа)
|
Сложные
|
Бинарные
соединениия
|
гидриды
карбиды
нитриды
оксиды
сульфиды
галиды
|
LiH, NaH, CaH2, AlH3
Be2C, CaC2, Al4C3
Na3N, Mg3N2, Si3N4
Na2O, CaO, Al2O3, SO3
K2S, ZnS, Fe2S3
NaCl, BaCl2, FeCl3
|
|
Гидроксиды
|
кислоты
основания
амфолиты
(амфотерные)
|
HNO3, H2SO4, H3PO4
KOH, Ba(OH)2, Ni(OH)3
Э(ОН)n = Н nЭОn
Форма основания:
Zn(OH)2, Al(OH)3, Be(OH)2
Форма кислоты:
H2ZnO2, H3AlO3, H2BeO2
|
|
Соли
|
средние
кислые
сновные
|
NaNO3, Al2(SO4)3, K3PO4
NaHSO4, KH2PO4, Ca(HCO3)2
MgOHCl, (CuOH)2SO4, Fe(OH)2Cl
|
Таблица Б2 – Взаимосвязь простых веществ, оксидов, оснований и кислот (реакции солеобразования)
1. Металл + кислота → соль + водород
Fe + 2HCl = 2FeCl2 + H2↑
2. Металл + неметалл → соль бескислородной кислоты
2Fe + 3Cl2 → 2FeCl3
3. Металл (1) + соль (1) → Соль (2) + металл (1)
Fe + CuCl2 → FeCl2 + Cu
4. Основный оксид + кислотный оксид → соль
BaO + SO3 → BaSO4
5. Основный оксид + кислота → соль + вода
BaO + 2HCl → BaCl2 + H2O
6. Основание + кислота → соль + вода (реакция нейтрализации)
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
7. Основание + кислотный оксид → соль + вода
Ba(OH)2 + SO3 → BaSO4 + H2O
8. Основание(1) + Соль(1) → Основание (2) + Соль(2)
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH
9. Соль(1) + Кислота(1) → Соль(2) + Кислота(2)
BaCl2 + H2SO4 → BaSO4 + 2HCl
10. Соль(1) + Соль(2) → Соль(3) + Соль(4)
BaCl2 + K2SO4 → BaSO4 + 2KCl
Амфотерные соединения могут проявлять и кислотные и основные свойства в зависимости от того, с чем реагируют:
![]()
NaOH
H2SO4
NaOH
H2SO4
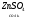
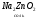
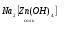 в растворе в растворе

Приложение В
Окислительно-восстановительная характеристика веществ
Степень окисления
максимальная
|
промежуточная
|
минимальная
|
равна номеру группы
|
любая другая
|
- (8 - номер группы)
для металлов равна 0
|
окислитель
|
окислитель и
восстановитель
Как правило,
либо окислительные,
либо восстановительные свойства преобладают
|
восстановитель
|
Существуют вещества, для которых окислительно-восстановительные свойства нехарактерны. Это наблюдается в том случае, когда атомы всех элементов находятся в своих самых устойчивых степенях окисления.
Таблица В1 – Стандартные электродные потенциалы металлов
Электрод
|
Электродный процесс
|
Ео, В
|
Li+/ Li
|
Li+ + ē = Li
|
-3,02
|
Rb+/ Rb
|
Rb+ + ē = Rb
|
-2,99
|
K+/ K
|
K+ + ē = K
|
2,92
|
Ba2+/ Ba
|
Ba2+ + 2ē = Ba
|
-2,90
|
Sr2+/ Sr
|
Sr2+ + 2ē = Sr
|
-2,89
|
Ca2+/ Ca
|
Ca2+ + 2ē = Ca
|
-2,87
|
Na+/ Na
|
Na+ + ē = Na
|
-2,71
|
Mg2+/ Mg
|
Mg2+ + 2ē = Mg
|
-2,34
|
Ве2+ / Ве
|
Ве2+ + 2ē = Ве
|
-1,85
|
Al3+/ Al
|
Al3+ + 3ē = Al
|
-1,67
|
Ti2+/ Ti
|
Ti2+ + 2ē = Ti
|
-1,63
|
Mn2+/ Mn
|
Mn2+ + 2ē = Mn
|
-1,05
|
Zn2+/ Zn
|
Zn2+ + 2ē = Zn
|
-0,76
|
Cr3+/ Cr
|
Cr3+ + 3ē = Cr
|
-0,71
|
Fe2+/ Fe
|
Fe2+ + 2ē = Fe
|
-0,44
|
Cd2+/ Cd
|
Cd2+ + 2ē = Cd
|
-0,40
|
Co2+/ Co
|
Co2+ + 2ē = Co
|
-0,28
|
Ni2+/ Ni
|
Ni2+ + 2ē = Ni
|
-0,25
|
Sn2+/ Sn
|
Sn2+ + 2ē = Sn
|
-0,14
|
Pb2+/ Pb
|
Pb2+ + 2ē = Pb
|
-0,13
|
Fe3+/ Fe
|
Fe3+ + 3ē = Fe
|
-0,04
|
2H+/ H2
|
2H+ + 2ē = H2
|
0,00
|
Sb3+/ Sb
|
Sb3+ + 3ē = Sb
|
+0,20
|
Bi3+/ Bi
|
Bi3+ + 3ē = Bi
|
+0,23
|
Cu2+/ Cu
|
Cu2+ + 2ē = Cu
|
+0,34
|
Cu+/ Cu
|
Cu+ + ē = Cu
|
+0,52
|
Ag+/ Ag
|
Ag+ + ē = Ag
|
+0,80
|
Hg2+/ Hg
|
Hg2+ + 2ē = Hg
|
+0,86
|
Pt2+/ Pt
|
Pt2+ + 2ē = Pt
|
+1,20
|
Au3+/ Au
|
Au3++ 3ē = Au
|
+1,42
|
Au+/ Au
|
Au+ + ē = Au
|
+1,69
| |
 Скачать 433.45 Kb.
Скачать 433.45 Kb.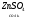
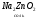
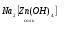 в растворе
в растворе
