3методичка химия под себя. тюменский государственный архитектурностроительный университет
 Скачать 433.45 Kb. Скачать 433.45 Kb.
|
|
Пример 2. Составление цепочки превращений неорганических веществ Для данного типа заданий алгоритм включает следующие действия: 1. Определить класс соединений; 2. По химическим свойствам данного вещества подобрать реагент, обратить внимание изменяется ли степень окисления элементов; 3. Написать уравнение реакции; 4. Указать тип реакции; 5. Если реакция окислительно-восстановительная, указать окислитель и восстановитель, какое вещество окисляется, какое – восстанавливается, составить электронно-ионный (или электронный) баланс; 6. Для реакций ионного обмена написать ионно-молекулярное уравнение; 7. Назвать продукты реакции. Необходимо указать условия протекания процессов (температура, наличие катализаторов), особенности процессов. Пример задания. Напишите уравнения реакций, при помощи которых можно осуществить следующие химические превращения: S → SO3→ Н2SO4 → SO2 → Na2SO3 → NaHSO3 → Na2SO3 → Na2SO4 Пример ответа. S → SO3→ Н2SO4 → SO2 → Na2SO3 → NaHSO3 → Na2SO3 → Na2SO4 0 +6 +6 +4 +4 +4 +4 +6 1 2 3 4 6 5 7 1. Реакция окисления. Оксид серы (VI) получают окислением диоксида серы, необходимы две стадии. Сера сгорает в кислороде с образованием диоксида серы S + О2 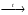 SO2, SO2, каталитическое окисление диоксида серы 2SO2 + О2 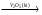 2SO3. 2SO3.2. Кислотный оксид SO3 энергично соединяется с водой с образованием серной кислоты: SO3 + Н2О = Н2SO4. 3. Реакция восстановления. Окислительные свойства за счет серы Н2SO4 проявляет в концентрированных растворах. Сера S+6 восстанавливается до S+4 малоактивными металлами или неметаллами (см. пример 1, с. 8). 0 +6 +4 +2 Сu + 2H2SO4 (конц.) = CuSO4 + SO2↑ + 2H2O 1 Cu0 – 2 e- → Cu+2 востановитель
2P + 5H2SO4 = 5SO2↑ + 2H3PO4 + 2H2O 0 +6 +4 +5
2 SO42– +4H+ + 2ē → SO2↑ + 2H2O окислитель 4. При пропускании кислотного оксида SO2 через избыток раствора щелочи образуется средняя соль: SO2 + 2NaOH = Na2SO3 гидроксид сульфит натрия натрия 5. При пропускании избытка SO2 через раствор сульфита натрия образуется кислая соль – гидросульфит натрия: Na2SO3 + SO2 + H2О = 2NaНSO3 гидросульфит натрия кислота Н2SО3 6. Гидросульфит натрия при нагревании разлагается: 2NaНSO3 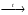 Na2SO3 + SO2↑ + H2О Na2SO3 + SO2↑ + H2О7. Сульфиты легко окисляются кислородом воздуха в сульфаты и разлагаются сильными кислотами: Na2SO3 + ½ О2= Na2SO4 +6 +4 Na2SO3 + H2SO4 → Na2SO4 + H2SO3 - реакция обмена H2О SO2↑ 3.2.1 Свойства s-элементов В главных подгруппах первой и второй группы периодической системы (подгруппа IА, IIA) расположены s- элементы (приложение А). Атомы s 1 элементов имеют на последнем уровне единственный электрон и проявляют степень окисления только +1, являются сильными восстановителями, самыми активными металлами. В соединениях преобладает ионная связь. С кислородом образуют оксиды Э2О. Оксиды образуются при недостатке кислорода или косвенно, через пероксиды Э2О2 и супероксиды ЭО2 (исключение Li2O). Оксидам соответствуют сильные растворимые основания – щелочи ЭОН, поэтому s 1 элементы называют щелочными металлами. Щелочные металлы активно реагируют с водой по схеме: Э + 2Н2О = 2ЭОН + Н2↑ Соли s 1 металлов, как правило, хорошо растворимы в воде. Для s-элементов II группы характерна степень окисления +2. Это тоже довольно активные металлы. На воздухе окисляются до оксидов ЭО, которым соответствуют основания Э(ОН)2. Растворимость и основный характер гидроксидов возрастают от Ве(ОН)2 к Rа(ОН)2. Ве(ОН)2 – амфотерное соединение. Бериллий с водой не реагирует, магний взаимодействует при нагревании, остальные металлы реагируют по схеме: Э + 2Н2О = Э(ОН)2 + Н2↑ образуя щелочи и называются щелочноземельными. Щелочные и некоторые щелочноземельные металлы из-за высокой активности не могут находиться в атмосфере, эти металлы хранят в специальных условиях. При взаимодействии с водородом s элементы образуют ионные гидриды, которые в присутствии воды подвергаются гидролизу: ЭН + Н2О = ЭОН + Н2↑ ЭН2 + 2Н2О = Э(ОН)2 + 2Н2↑. 3.2.2 Свойства р-элементов Атомыр-элементов содержат на последнем уровне от 3 до 8 электронов. Большинство р-элементов – неметаллы (приложение А). У типичных неметаллов электронная оболочка близка к завершению, т.е. они способны принимать электроны на последний уровень (окислительные свойства). Окислительная способность элементов увеличивается в периоде слева направо, а в группе – снизу вверх. Наиболее сильными окислителями являются фтор, кислород, хлор, бром. Неметаллы могут проявлять и восстановительные свойства, кроме F2, например: S + O2 = SO2 S + Cu = CuS восстановитель окислитель 0 0 +4 -2 0 0 +2 -2 Преимущественно восстановительные свойства проявляют элементы – водород, бор, углерод, кремний, германий, фосфор, мышьяк, астат, теллур. Примеры соединений с отрицательной степенью окисления неметалла: бориды, карбиды, нитриды, сульфиды и др. (таблица Б1 приложения). В определенных условиях неметаллы реагируют между собой, при этом получаются соединения с ковалентной связью, например, НCl, H2O, SF6, CH4. С водородом неметаллы образуют летучие соединения (искл. Н2О). Гидриды VI и VII группы в водных растворах проявляют кислотные свойства. При растворении в воде аммиака NH3, образуется основание NH4OH. С кислородом р – элементы образуют оксиды. Оксиды неметаллов имеют кислотный характер (искл. N2O, NO, CO – несолеобразующие). Элементы, расположенные левее диагонали бор – астат, относятся к металлам. Их металлические свойства выражены гораздо слабее, чем у s элементов. Для р-металлов характерны амфотерные соединения. Кислотно-основные свойства изменяются периодически, например, в III периоде:
Многие р – элементы могут проявлять переменную степень окисления, образуя оксиды и кислоты разного состава, например:
Кислотные свойства усиливаются с увеличением степени окисления. Например, кислота НNО3 сильнее НNО2, H2SO4 сильнее H2SO3, PbО – амфотерный, PbО2 – кислотный оксид. Кислоты, образованные элементами в высшей степени окисления являются сильными окислителями. 3.3 Свойства d-элементов В больших периодах периодической системы между s- и р- элементами расположены d-элементы, их называют переходными металлами. ns np (n-1) d У d-элементов валентными являются энергетически близкие девять орбиталей. На внешнем слое атомов d-элементов находятся 1–2 электрона (ns), остальные расположены в предвнешнем (n-1)d слое. Примеры электронных формул: Mn 4d55s2, Cr 3d54s1, W 5d46s2. Подобное строение элементов определяет общие свойства. Простые вещества, образованные переходными элементами, являются металлами, это объясняется наличием одного или двух электронов на внешнем уровне. Наличие в атомах d-элементов частично заполненных d-орбиталей обусловливает у них разнообразие степеней окисления. Почти для всех из них возможна степень окисления +1 или +2 – по числу внешних электронов. Высшая степень окисления отвечает номеру группы (исключение составляют железо, элементы подгруппы кобальта, никеля, меди). Соединения с высшей степенью окисления более устойчивы, по форме и свойствам сходны с аналогичными соединениями главных подгрупп:
Оксиды и гидроксиды данного d-элемента в разных степенях окисления имеют различные кислотно – основные свойства. Наблюдается закономерность: с ростом степени окисления характер соединений изменяется от основного через амфотерный к кислотному. Например:
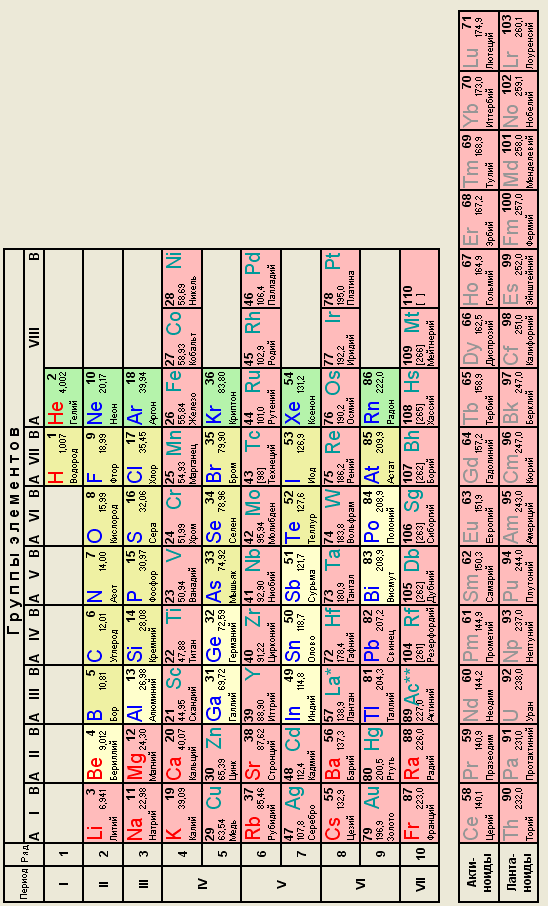
Вследствие разнообразия степеней окисления для химии d-элементов характерны окислительно-восстановительные реакции. В высших степенях окисления элементы проявляют окислительные свойства, а в степени окисления +1, +2 – восстановительные. В промежуточной степени соединения могут быть и окислителями, и восстановителями. d-элементы имеют большое количество вакантных орбиталей и поэтому являются хорошими комплексообразователями, соответственно входят в состав комплексных соединений. Например: K3[Fe(CN)6] – гексацианоферрат (III) калия; Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия; [Ag(NН3)2]Cl – хлорид диамминсеребра(I). [Co(NH3)3 Cl3] – трихлоротриамминкобальт; Приложение А
|