химия. Учебником Основы химии
 Скачать 294.23 Kb. Скачать 294.23 Kb.
|
|
1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного) номера. Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона. Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются. Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). современная формулировка Периодического закона звучит так: Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома. Период — это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом. В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. 1–3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4–7 — большие периоды, состоят из 18 и более элементов. Группы — это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы: Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы — I A, галогены — VII A, инертные газы — VIII A). Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы. (под буквой «Б» или «B») 2. Основные классы неорганических соединений: примеры соединений, различие в их составе Простые вещества состоят из одного химического элемента. К ним относятся металлы и неметаллы. Сложные вещества состоят из двух или более химических элементов. Сложные вещества, или соединения, подразделяют на классы: Оксиды Кислоты Основания Соли Оксидами называют вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2) Осно́вным соответствуют основания. Это оксиды металлов, например натрия Na2O, Основные оксиды реагируют с кислотами с образованием соли и воды. Кислотным соответствуют кислоты. Это оксиды неметаллов, например, серы SO2, фосфора P2O5, или металлов в высшей степени окисления, например, оксид хрома (VI) CrO3. Кислотные оксиды реагируют со щелочами с образованием соли и воды Амфотерные оксиды реагируют и с кислотами, и со щелочами. Примером могут служить оксиды цинка и алюминия. Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относятся некоторые оксиды неметаллов, например, оксид азота (II) NO. Кислоты — это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Кислоты могут быть бескислородными, как соляная HCl, или кислородсодержащими: серная H2SO4. кислоты делят на одноосно́вные, например, азотная HNO3, двухосно́вные — серная H2SO4, трехсно́вные — фосфорная) H3PO4. Основания — это сложные вещества, состоящие из металла и одной или нескольких гидроксогрупп (OH). Основания могут быть растворимыми в воде — гидроксид натрия NaOH, или нерастворимыми, как гидроксид меди (II) Cu(OH)2 Соли — это сложные вещества, в составе которых имеется металл (или сложный положительный ион) и кислотный остаток. Соли бывают: • средние — в составе нет ионов водорода и гидроксогрупп, например, хлорид натрия NaCl, • кислые — содержат в своем составе ионы водорода, например, гидрокарбонат натрия NaHCO3 • осно́вные — содержат в своем составе гидроксогруппы, например, основный карбонат меди (II) (CuOH)2CO3 3 Строение атомов химических элементов. Состав атомного ядра. Строение электронных оболочек атомовАтом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Атомное ядро состоит из положительно заряженных протонов и нейтральных частиц — нейтронов, не имеющих заряда.число протонов, равно атомному номеру. Чтобы найти число нейтронов в атоме, нужно от атомной массы отнять заряд ядра (число протонов). Например, в атоме натрия 23Na число протонов p = 11, а число нейтронов n = 23 − 11 = 12 Число нейтронов в атомах одного и того же элемента может быть различным. Такие атомы называют изотопами. Атомная орбиталь – часть пространства, в которой вероятность нахождение электрона максимальна Орбитали и бывают четырех типов: s, p, d и f. Электронная оболочка атома слоистая. Орбитали одного слоя образуют электронный ("энергетический") уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.  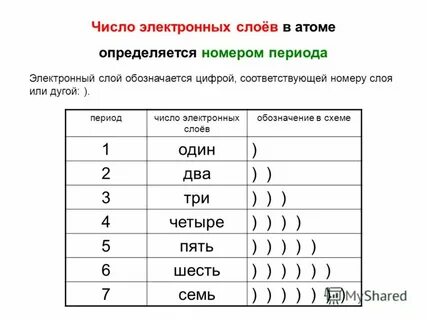 4 Положение металлов в периодической системе, строение их атомов Элементы, образующие простые вещества — металлы, занимают левую нижнюю часть периодической системы (для наглядности можно сказать, что они расположены влево от диагонали, соединяющей Be и полоний, № 84), также к ним относятся элементы побочных (Б) подгрупп. Для атомов металлов характерно небольшое число электронов на внешнем уровне. Этим обусловлены их физ.свойства электрическую проводимость, хорошую теплопроводность, ковкость, пластичность. Металлы также отличает характерный металлический блеск. химических реакциях металлы выступают в роли восстановителей: При взаимодействии с кислородом металлы образуют оксиды, например, магний сгорает с образованием оксида магния: 2Mg + O2 = 2MgO Наиболее активные металлы (щелочные) при горении на воздухе образуют пероксиды: 2Na + O2 = Na2O2 (пероксид натрия) Активные металлы, например, натрий, реагируют с водой с образованием гидроксидов: 2Na + 2HOH = 2NaOH + H2↑ или оксидов, как магний при нагревании: Mg + H2O = MgO + H2↑ Металлы, расположенные в электрохимическом ряду напряжений левее водорода (Н), вытесняют водород из кислот (кроме азотной). Так, цинк реагирует с соляной кислотой с образованием хлорида цинка и водорода: Zn + 2HCl = ZnCl2 + H2↑ Металлы, в том числе правее водорода, за исключением золота и платины, реагируют с азотной кислотой, с образованием различных соединений азота: Cu + 4HNO3 (конц.) = Cu(NO3)2 + 2H2O + 2NO2↑ 5 Положение неметаллов в периодической системе, строение их атомов Простые вещества — неметаллы образуют элементы главных подгрупп, расположенные в правой верхней части периодической системы (правее диагонали, соединяющей бор и астат). Для их атомов характерно наличие на внешнем уровне 4-8 электронов. Электроны в атомах этих элементов прочнее связаны с ядром, поэтому для неметаллов характерны такие физические свойства, как отсутствие электрической проводимости (исключение — графит), низкая, по сравнению с металлами, теплопроводность, хрупкость Химические свойства В реакциях с металлами и водородом неметаллы являются окислителями. Например, порошок серы при нагревании реагирует с железными опилками с образованием сульфида железа: Fe0 + S0 = Fe+2S−2 При высокой температуре сера реагирует с водородом (например, если пропускать водород через расплавленную серу). Образуется газ с запахом тухлых яиц — сероводород: H20 + S0 = H2+1S−2 В реакциях с кислородом неметаллы являются восстановителями: S0 + O20 = S+4O2−2 (при горении серы образуется оксид серы (IV), или серни́стый газ) C0 + O20 = C+4O2−2 (графит сгорает с образованием оксида углерода (IV), или углекислого газа) Галогены не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7. Фторид кислорода O+2F2−1 — соединение, в котором кислород проявляет положительную степень окисления 6 Виды химической связи: ковалентная (полярная и неполярная), ионная Химическая связь-между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов . Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи. Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра 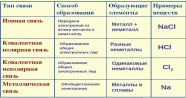 СХОДСТВОНаиболее очевидное сходство заключается в том, что результат один и тот же: как ионная, так и ковалентная связь приводят к созданию стабильных молекул.Реакции, которые создают ионные и ковалентные связи, являются экзотермическими, потому что элементы связываются вместе, чтобы понизить их потенциальную энергию. По своей природе этот процесс выделяет энергию в форме тепла.РАЗЛИЧИЕРазличие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.Типы кристаллических решетокИонная — в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4). Атомная — в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний. Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления. Молекулярная кристаллическая решетка образована молекулами, связанными слабыми межмолекулярными взаимодействиями CO2, йод I2 Металлическая кристаллическая решетка характерна для металлов, например, Fe 7. Взаимосвязь между классами неорганических соединений: возможность получения одних веществ из других 1)Между классами неорганических соединений возможны взаимные превращения. Осно́вные оксиды (щелочных и щелочноземельных металлов) реагируют с водой, при этом получаются основания. Например, оксид кальция (негашеная, или жжёная известь) реагирует с водой с образованием гидроксида кальция (гашеной извести): CaO + H2O = Ca(OH)2 2)Нерастворимые основания не могут быть получены таким путем, но они разлагаются при нагревании с образованием основных оксидов. Например, при нагревании гидроксида меди (II) образуются оксид меди (II) и вода: Cu(OH)2 = CuO + H2O 3)Большинство кислотных оксидов реагируют с водой с образованием кислот. Так, оксид серы (VI), присоединяет воду с образованием серной кислоты: SO3 + H2O = H2SO4 4)Слабые кислоты разлагаются при нагревании с выделением оксидов. Серни́стая кислота разлагается на оксид серы (IV), или серни́стый газ, и воду: H2SO3 = H2O + SO2↑ 5) Соли могут быть получены как при взаимодействии оснований с кислотами (реакция нейтрализации): 2NaOH + H2SO4 = Na2SO4 + 2H2O (образовался сульфат натрия), 6) так и при взаимодействии щелочей с кислотными оксидами: Ca(OH)2 + CO2 = CaCO3↓ + H2O 7)Нерастворимые основания могут быть получены из растворов солей в результате реакции обмена: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ 8)Кислоты можно получать из солей, вытесняя их более сильными (менее летучими) кислотами: Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ (при избытке HCl в осадок выпадает нерастворимая кремниевая кислота) 9)Наконец, прокаливанием известняка получают оксид кальция (жженую известь) и углекислый газ: CaCO3 = CaO + CO2↑ 8) Классификация химических реакций по различным признакам Соединения — из двух или нескольких веществ образуется одно сложное вещество Разложения — из одного сложного вещества образуется два или несколько веществ Замещения — атомы простого вещества замещают один из элементов в сложном веществе Обмена — 2 сложных вещества обмениваются составными частями Реакции, протекающие с выделением энергии (тепла), называются экзотермическими. К ним относятся реакции горения, например серы: S + O2 = SO2 + Q Образуется оксид серы (IV), выделение энергии обозначают + Q Реакции, требующие затрат энергии, т. е. протекающие с поглощением энергии, называются эндотермическими. Эндотермической является реакция разложения воды под действием электрического тока: 2H2O = 2H2 + O2 − Q ♦ Реакции, сопровождающиеся изменением степеней окисления элементов, т. е. переходом электронов, называются окислительно-восстановительными: Fe0 + S0 = Fe+2S−2 Противоположностью являются электронно-статичные реакции, часто их называют просто реакции, протекающие без изменения степени окисления. К ним относятся все реакции обмена: H+1Cl−1 + Na+1O−2H+1 = Na+1Cl−1 + H2+1O−2 9) Окислительно-восстановительные реакции. Окислитель и восстановитель Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления. Широко распространенными реакциями этого типа являются реакции горения. Также сюда относятся реакции медленного окисления (коррозия металлов, гниение органических веществ) Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.лабораторной практике наиболее часто используются следующие окислители: азотная кислота (HNO3); концентрированная серная кислота (H2SO4); пероксид водорода (H2O2); . К восстановителям,которые применяются в лабораторной практике относятся: магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы; водород (Н2) и углерод ПРИМЕР РЕАКЦИИ \S0 + O20 = S+4O2−2 В этой реакции сера является восстановителем, кислород окислителем. Образуется оксид серы (IV) 10)Реакции ионного обмена реакция ионного обмена — это химическая реакция между двумя сложными веществами, которая приводит к обмену заряженными частицами (ионами), в результате чего образуются новые сложные соединения. Эти реакции протекают до конца в 3-х случаях: Если в результате реакции выпадает осадок (образуется нерастворимое или малорастворимое вещество, что можно определить по таблице растворимости): CuSO4 + BaCl2 = BaSO4↓ + CuCl2 Если выделяется газ (образуется часто при разложении слабых кислот): Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ Если образуется малодиссоциирующее вещество. Например, вода, уксусная кислота: HCl + NaOH = NaCl + H2O Реакции ионного обмена не сопровождаются переходом электронов и изменением степени окисления элементов в отличие от окислительно-восстановительных реакций. 11) Кислоты в свете представлений об электролитической диссоциации. Химические свойства кислот: взаимодействие c металлами, основными оксидами, основаниями, солями (на примере хлороводородной кислоты) С точки зрения теории электролитической диссоциации кислотами называются вещества, диссоциирующие в растворах с образованием ионов водорода: HCl → H+ + Cl− Более строгая формулировка: отщепляющие в качестве катионов только ионы водорода. Под ионом водорода подразумевают гидратированный протон (т. е. протон, присоединивший воду). Если хотят показать состав иона водорода, его обычно изображают H3O+ Кислоты окрашивают растворы индикаторов лакмуса и метилового оранжевого в красный цвет Взаимодействуют с металлами, находящимися в ряду напряжений левее водорода, например, с цинком, с образованием соли (хлорида цинка) и газообразного водорода: Zn + 2HCl = ZnCl2 + H2↑ Взаимодействуют с основными оксидами с образованием соли и воды: CuO + 2HCl = CuCl2 + H2O Взаимодействуют с основаниями с образованием соли и воды: NaOH + HCl = NaCl + H2O Вытесняют слабые кислоты из растворов их солей, например, карбоната натрия: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ Реакция с солями может протекать с образованием осадка: AgNO3 + HCl = HNO3 + AgCl↓ Щёлочи — это растворимые основания. С точки зрения теории электролитической диссоциации основаниями являются вещества, диссоциирующие в растворах с образованием гидроксид-ионов, т. е. основные гидроксиды: NaOH → Na+ + OH− 1)Растворы щелочей окрашивают индикатор фенолфталеин в малиновый цвет. 2)Лакмус окрашивают в синий, метилоранж — в желтый, но это в школьной лаборатории видно плохо, не дает возможности отличить от нейтрального раствора. 3)Щёлочи реагируют с кислотами с образованием соли и воды (реакция нейтрализации): NaOH + HCl = NaCl + H2O 4)Щёлочи реагируют с кислотными оксидами с образованием соли и воды: 2NaOH + CO2 = Na2CO3 + H2O Ca(OH)2 + CO2 = CaCO3↓ + H2O 5)Щелочи реагируют с растворами солей, если в результате реакции образуется осадок: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ 5)Например, при сливании с растворимыми солями меди (II) выпадает синий осадок гидроксида меди (II). 6)При нагревании солей аммония со щелочами выделяется газообразный аммиак: Ca(OH)2 + 2NH4Cl = CaCl2 + 2NH3↑ +2H2O 13. Водород Водород — химический элемент с порядковым номером 1 Атом водорода состоит из одного протона и одного электрона. Такое строение обусловливает уникальные свойства водорода. В периодической системе водород занимает особое место: подобно щелочным металлам водород обладает способностью отдавать один электрон, поэтому он может быть помещён в главную подгруппу группы; однако, как и галогены, водород способен присоединять один электрон, поэтому его можно поместить в главную подгруппу группы. В соединениях водород всегда одновалентен. Для него характерны две степени окисления: +1 и -1 Химические свойства: Водород горит, образуется вода; смесь водорода с воздухом сгорает со взрывом: 2H2 + O2 = 2H2O Водород продолжает гореть в атмосфере хлора (т. е. реагирует с хлором при нагревании), образуется хлороводород: H2 + Cl2 = 2HCl Сходным образом протекают реакции со многими неметаллами. Водород восстанавливает металлы из их оксидов: H2 + CuO = Cu + H2O В лаборатории водород получают взаимодействием цинка с соляной кислотой: Zn + 2HCl = ZnCl2 + H2↑ Водород собирают в сосуд, перевернутый кверху дном. ФИЗИЧЕСКИЕ СВ-СТ При обычных условиях водород — бесцветный, не имеющий запаха газ, почти не растворяется ни в каких растворителях. При сильном сжатии и охлаждении переходит в жидкое состояние. Газообразный водород обладает рядом уникальных свойств. Благодаря маленькому радиусу атомы и молекулы водорода могут проникать через резину, стекло и даже через металлы. ПРИМЕНЕНИЯ ВОДОРОДА Основной областью применения водорода является производство химических продуктов — аммиака, метанола, хлористого водорода и его раствора — соляной кислоты. 14.Вода Молекула воды состоит из атома кислорода и двух атомов водорода В атоме водорода один неспаренный электрон, в атоме кислорода шесть валентных электронов, два из которых неспарены. Неспаренные электроны образуют две общие электронные пары по обменному механизму. молекула воды имеет угловое строение. Валентный угол 104 градуса Физические свойства Вода при комнатной температуре — бесцветная прозрачная жидкость. Температура плавления 0º C, температура кипения при атмосферном давлении — 100° С. Чистая вода не проводит электрический ток. Если глубина слоя воды превышает 5 м, то она кажется голубой. Теплоемкость воды очень высокая, поэтому в знойный летний день возле водоемов всегда прохладно. Химические свойства: Вода разлагается при пропускании электрического тока* на водород и кислород: 2H2O = 2H2↑ + O2↑ Вода взаимодействует с натрием и некоторыми другими активными металлами, которые вытесняют из нее водород, образуется щелочь (гидроксид натрия): 2Na + 2HOH = 2NaOH + H2↑ Оксид кальция (негашеная известь) бурно взаимодействует с водой (гасится) с выделением большого количества тепла, что может быть даже причиной пожара. Образуется гидроксид кальция (гашеная известь): CaO + H2O = Ca(OH)2 + Q Большинство оксидов неметаллов реагируют с водой с образованием кислот. Оксид серы (IV) взаимодействует с водой с образованием серни́стой кислоты: SO2 + H2O = H2SO3 15.Сера Положение в периодической системе: сера находится в 3 периоде, VI группе, главной (А) подгруппе. Атомный номер серы 16, следовательно, заряд ядра атома серы равен +16, число электронов 16. Три электронных уровня (равно периоду), на внешнем уровне 6 электронов Схема расположения электронов по уровням: 16S ) ) ) 2 8 6 Сера как простое вещество образует аллотропные модификации: кристаллическая сера и пластическая. Кристаллическая сера — твердое вещество желтого цвета, хрупкое, легкоплавка, нерастворима в воде. Сера и многие руды, содержащие серу, не смачиваются водой. Поэтому порошок серы может плавать на поверхности, хотя сера тяжелее воды Пластическая сера темного цвета и способна растягиваться, как резина. 1.При нагревании порошков серы и железа образуется сульфид железа: Fe + S = FeS 2.Со ртутью, натрием порошок серы реагирует при комнатной температуре: Hg + S = HgS 3.При пропускании водорода через расплавленную серу образуется сероводород: H2 + S = H2S 5.Оксид серы (IV) — кислотный оксид. Реагирует с водой с образованием серни́стой кислоты: SO2 + H2O = H2SO3 6.Оксид серы (VI) реагирует с водой с образованием серной кислоты: SO3 + H2O = H2SO4 Оксид серы (IV) – это кислотный оксид. Бесцветный газ с резким запахом, хорошо растворимый в воде. Один из способов получения 1. Сжигание серы на воздухе: S + O2 → SO2 16.Оксиды Оксиды — сложные вещества, состоящие из двух элементов, один из которых кислород (в степени окисления −2). Оксиды делят на кислотные, осно́вные, амфотерные и несолеобразующие (безразличные). Кислотным оксидам соответствуют кислоты. Кислотными свойствами обладают большинство оксидов неметаллов и оксиды металлов в высшей степени окисления, например CrO3. 1)Многие кислотные оксиды реагируют с водой с образованием кислот. Например, оксид серы (IV), или серни́стый газ, реагирует с водой с образованием серни́стой кислоты: SO2 + H2O = H2SO3 2) Кислотные оксиды реагируют со щелочами с образованием соли и воды. Например, оксид углерода (IV), или углекислый газ, реагирует с гидроксидом натрия с образованием карбоната натрия (соды): CO2 + 2NaOH = Na2CO3 + H2O Осно́вным оксидам соответствуют основания. К осно́вным относятся оксиды щелочных металлов (главная подгруппа I группы), Оксиды щелочных и щелочноземельных металлов реагируют с водой с образованием оснований. Так, оксид кальция реагирует с водой, получается гидроксид кальция: CaO + H2O = Ca(OH)2 Основные оксиды реагируют с кислотами с образованием соли и воды. Оксид кальция реагирует с соляной кислотой, получается хлорид кальция: CaO + 2HCl = CaCl2 + H2O Амфотерные оксиды реагируют и с кислотами, и со щелочами. Так, оксид цинка реагирует с соляной кислотой, получается хлорид цинка: ZnO + 2HCl = ZnCl2 + H2O Оксид цинка взаимодействует и с гидроксидом натрия с образованием цинката натрия: ZnO + 2NaOH = Na2ZnO2 + H2O С водой амфотерные оксиды не взаимодействуют. Поэтому оксидная пленка цинка и алюминия защищает эти металлы от коррозии. Несолеобразующим (безразличным) оксидам не соответствуют гидроксиды, они не реагируют с водой. Несолеобразующие оксиды не реагируют ни с кислотами, ни со щелочами. К ним относится оксид азота (II) NO. 17Углерод: положение этого химического элемента в периодической системе, строение его атома. Алмаз. Графит. Оксиды углерода, их принадлежность к подклассам оксидов. Угольная кислота и ее соли Положение в периодической системе: углерод находится во 2 периоде, IV группе, главной (А) подгруппе. Атомный номер углерода 6, следовательно, заряд ядра атома равен +6, число электронов 6. Схема расположения электронов по уровням: 6C ) ) 2 4 Углерод как простое вещество образует две аллотропные модификации: графит и алмаз. Алмаз — прозрачные бесцветные кристаллы. У алмаза атомная кристаллическая решетка. Каждый атом в кристаллической решетке алмаза соединен ковалентными связями с четырьмя соседними атомами, так что кристалл алмаза поэтому сравнивают с единой молекулой. Атомные кристаллические решетки обладают большой прочностью: алмаз — самое твердое из природных веществ. Огранённые алмазы называются бриллиантами. Графит — темно-серое вещество со слабым металлическим блеском. Кристалл графита состоит из слоев, в которых атомы связаны ковалентными связями. Связь между слоями обладает свойствами металлической связи (т. е. электроны принадлежат всем атомам). Поэтому графит проводит электрический ток Графит сгорает в кислороде с образованием оксида углерода (IV), или углекислого газа: C + O2 = CO2 При высокой температуре этот оксид реагирует с раскаленным углем, получается оксид углерода (II) — угарный газ: CO2 + C = 2CO Угарный газ горит голубоватым пламенем: 2CO + O2 = 2CO2 Угарный газ чрезвычайно ядовит, так как соединяется с гемоглобином крови, делая невозможным перенос кровью кислорода. Оксид углерода (II) реагирует при нагревании с гидроксидом натрия с образованием соли — формиата натрия Углекислому газу соответствует угольная кислота H2CO3 — слабая, существует только в растворе. Ее соли — карбонаты. Карбонат кальция широко встречается в природе в виде мела, известняка, мрамора. 18Кальций: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства кальция: взаимодействие с кислородом, водой, кислотамиПоложение в периодической системе: кальций находится в 4 периоде, II группе, главной (А) подгруппе. Атомный номер кальция 20, следовательно, заряд ядра атома равен +20, число электронов 20. Схема расположения электронов по уровням: 20Ca ) ) ) ) 2 8 8 2 ФИЗ СВОЙСТВА Простое вещество кальций — белый металл, легкий, более твердый по сравнению со щелочными металлами (всё же режется ножом). ХИМ СВОЙСТВА Кальций относится к щелочноземельным металлам, отличающимся химической активностью. Кальций хранят под слоем керосина, т. к. на воздухе он быстро покрывается слоем оксида. При нагревании горит: 2Ca + O2 = 2CaO Кальций вытесняет из воды водород. Если поместить кусочек кальция в воду, он тонет, но вскоре всплывает из-за образовавшихся на нём пузырьков водорода: Ca + 2HOH = Ca(OH)2↓ + H2↑ Кальций реагирует с кислотами, например, с соляной кислотой с образованием хлорида кальция: Ca + 2HCl = CaCl2 + H2↑ 19Железо: положение этого химического элемента в периодической системе. Химические свойства железа: взаимодействие с серой, хлороводородной кислотой, растворами солей. Оксиды и гидроксиды железа Положение в периодической системе: железо находится в 4 периоде, побочной (Б) подгруппе VIII группы. Атомный номер железа 26. Схема расположения электронов по уровням: 26Fe ) ) ) ) 2 8 14 2 Чистое железо — мягкий металл. Железо способно намагничиваться в магнитном поле. Если нагреть железные опилки с порошком серы, начинается экзотермическая реакция (с выделением теплоты), которая продолжается без дальнейшего нагревания. Образуется сульфид железа (II): Fe + S = FeS Железо находится в электрохимическом ряду напряжений левее водорода, поэтому вытесняет водород из кислот. При взаимодействии с соляной (хлороводородной) кислотой образуется хлорид железа (II): Fe + 2HCl = FeCl2 + H2↑ Железо вытесняет менее активные металлы (которые расположены правее в ряду напряжений) из растворов их солей. Если поместить железные опилки (или кнопку) в раствор хлорида меди (II), железо покрывается красным слоем меди, а голубой раствор приобретает зеленоватый цвет: Fe + CuCl2 = FeCl2 + Cu↓ Оксиды и гидроксиды железа нерастворимы в воде. Получены оксиды и гидроксиды с различной степенью окисления железа: Оксид железа (II) FeO, гидроксид железа (II) Fe(OH)2. Проявляют осно́вные свойства. Оксид железа (II) черного цвета. Гидроксид железа (II) выпадает в виде осадка зеленоватого цвета при добавлении щелочей в раствор соли железа (II). Железо горит в кислороде: 3Fe + 2O2 = Fe3O4 с образованием железной окалины (представляет из себя смешанный оксид Fe+2O•Fe2+3O3). Темно-серого цвета. Гидратированный оксид железа (III) Fe2O3• nH2O является основной составной частью ржавчины. Бурого цвета. Проявляет слабые амфотерные свойства. Гидроксид железа (III) получают воздействием щелочей на соли железа трехвалентного. Серная кислота — важнейший продукт химической промышленности. Формула серной кислоты H2SO4. Бесцветная маслянистая жидкость, тяжелее воды. При смешивании с водой образуются гидраты, происходит сильное разогревание, поэтому категорически запрещено вливать воду в концентрированную серную кислоту. Серная кислота — сильный электролит, в водном растворе диссоциирует полностью. Окрашивает индикаторы лакмус и метилоранж в красный цвет. Металлы, расположенные в ряду напряжений левее водорода, вытесняют из растворов серной кислоты водород: Zn + H2SO4 = ZnSO4 + H2↑ (образуется соль — сульфат цинка) Окислителем в данной реакции является водород кислоты: Zn0 + H2+1SO4 = Zn+2SO4 + H20↑ Концентрированная серная кислота взаимодействует при нагревании и с металлами правее водорода, кроме золота и платины. Окислителем будет сера. В реакции с медью восстанавливается до оксида серы (IV): Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O (выделяется бесцветный газ) С оксидами металлов реакция протекает с образованием соли и воды: MgO + H2SO4 = MgSO4 + H2O Серная кислота реагирует с основаниями, с образованием соли и воды: 2NaOH + H2SO4 = Na2SO4 + 2H2O Качественной реакцией на сульфат-ион является взаимодействие с солями бария — выпадает белый кристаллический осадок сульфата бария, нерастворимый в азотной кислоте: H2SO4 + BaCl2 = BaSO4↓ + 2HCl 2H+ + SO42− + Ba2+ + 2Cl− = BaSO4↓ + 2H+ + 2Cl− SO42− + Ba2+ = BaSO4↓ 21Натрий: положение этого химического элемента в периодической системе, строение его атома, физические свойства. Химические свойства натрия: взаимодействие с неметаллами, водойПоложение в периодической системе: натрий находится в 3 периоде, I группе, главной (А) подгруппе. Атомный номер натрия 11, следовательно, заряд ядра атома натрия равен + 11, число электронов 11. Три электронных уровня (равно периоду) Схема расположения электронов по уровням: 11Na ) ) ) 2 8 1 Простое вещество натрий — металл серебристо-белого цвета, легкий, мягкий (легко режется ножом), легкоплавкий Натрий, как и все щелочные металлы, — сильный восстановитель. Он энергично реагирует с неметаллами: При нагревании до 180° С в умеренном количестве кислорода образуется оксид натрия: 4Na + O2 = 2Na2O Натрий горит на воздухе с образованием пероксида натрия: 2Na + O2 = Na2O2 Натрий хранят под слоем керосина. Расплавленный натрий в хлоре сгорает с ослепительной вспышкой (можно говорить проще — реагирует с хлором при нагревании), на стенках сосуда образуется белый налет хлорида натрия: 2Na + Cl2 = 2NaCl Натрий может взрываться при растирании с порошком серы (образуется сульфид натрия): 2Na + S = Na2S Натрий при нагревании восстанавливает водород, образуется гидрид натрия: 2Na + H2 = 2NaH Если небольшой кусочек натрия поместить в воду, он бурно реагирует с водой. Металл плавится от выделяющейся теплоты и «бегает» по поверхности воды. Образуется раствор гидроксида натрия: 2Na + 2HOH = 2NaOH + H2↑ Натрий в природе содержится в различных минералах, в виде соли в морской воде. В человеческом организме соли натрия входят в состав плазмы крови, лимфу. 22. Круговорот химических элементов в природе (на примере углерода или азота). Роль живых существ в круговороте химических элементовУглерод в природе содержится в различных осадочных горных породах: меле, известняке. Большое количество углерода входит в состав растительной биомассы. Содержание в атмосфере углекислого газа сравнительно невелико — менее 1% но именно этот углерод приковывает сегодня внимание ученых. Углекислый газ необходим растениям для фотосинтеза. В процессе фотосинтеза образуются органические вещества, служащие источником питания для всех живых организмов. В то же время углекислый газ способен вызывать парниковый эффект. Краткая схема круговорота углерода в природе: углекислый газ используется растениями для фотосинтеза; продуктом фотосинтеза являются органические вещества, в частности углеводы; углерод попадает в тело травоядных животных, затем – хищников; обратно элемент возвращается в природу при дыхании животных и после их смерти в результате гниения (осуществляют бактерии, грибы Углекислый газ (СО2) является конечным продуктом метаболизма. Он образуется в процессе дыхания и полного распада углеводов, жиров, аминокислот. Из клетки с током крови углекислый газ попадает в лёгкие, а оттуда – в атмосферу при внешнем дыхании. Углекислый газ – продукт не только жизнедеятельности живых организмов. Газ образуется при сжигании органического топлива – нефти, природного газа, древесины, угля. При попадании углекислого газа в атмосферу круговорот элемента начинается заново 23Источники химического загрязнения воздуха. Пагубные последствия химического загрязнения воздуха. Меры предупреждения химических загрязнений воздуха1) С промышленными выбросами в атмосферу ежегодно поступает более 600 млн тонн различных химических соединений. Основным источником химического загрязнения воздуха считается металлургия, в первую очередь, коксохимическое производство. В атмосферу выбрасывается большое количество дыма, содержащего сажу и газы, вызывающие у людей астму, хронический бронхит и др. Для уменьшения выбросов необходимо устанавливать очистные сооружения. Снижать потребление металлов за счет производства изделий с меньшими затратами материалов, защиты металлических конструкций от коррозии, переработки металлолома. Металлургические цеха не должны располагаться на территории населенных пунктов. 2) Во многих регионах основным источником загрязнений является транспорт, главным образом, автомобильный. Выхлопы содержат оксиды азота, угарный газ CO, продукты неполного сгорания топлива. В городах это приводит к образованию смога, вызывает у людей заболевания дыхательных путей. Плоды, растущие около автомобильных дорог, нельзя употреблять в пищу. Для уменьшения загрязнения воздуха вводятся новые экологические стандарты для двигателей, они оснащаются каталитическими дожигателями выхлопных газов. Очистке воздуха растениями от вредных газов способствует озеленение городов. 3) Значительное количество серни́стого газа SO2 в атмосферу выбрасывают тепловые электростанции и котельные, работающие на каменном угле, который обычно содержит примеси серы. Выпадают кислотные дожди, разрушающие постройки из мрамора и известняка, ускоряющие коррозию металлов. Гибнут леса, в первую очередь хвойные. Для сокращения выбросов необходимо производить очистку дымовых газов, а улавливаемые соединения серы могут быть использованы для производства серной кислоты. 4) Сжигание ископаемого топлива повышает содержание в атмосфере углекислого газа CO2, вызывающего парниковый эффект, что может привести к глобальному потеплению климата. Так как зеленые растения связывают углекислый газ в процессе фотосинтеза, необходимо сохранять существующие леса и засаживать деревьями новые площади 6) Серьезную проблему в последние годы представляют свалки и сжигание мусора. При этом в атмосферу попадают продукты неполного сгорания полимеров (пластмасс), способные разрушать озоновый слой в атмосфере. 24 Энергетика химических процессов. Закон Гесса Количество выделенной (или поглощенной) теплоты Q в данном процессе называют тепловым эффектом процесса. Экзотермической является реакция, протекающая с выделением теплоты, а эндотермической – с поглощением теплоты из окружающей среды. Термохимические уравнения Химические уравнения, в которых дополнительно указывается величина изменения энтальпии реакции, а также агрегатное состояние веществ и температура, называются термохимическимиуравнениями. В термохимических уравнениях отмечают фазовое состояние и аллотропные модификации реагентов и образующихся веществ: г – газообразное, ж – жидкое, к – кристаллическое; Важно подчеркнуть, что с термохимическими уравнениями можно проводить алгебраические операции сложения, вычитания, деления, умножения. Закон Гесса Изменение энтальпии (внутренней энергии) химической реакции зависит от вида, состояния и количества исходных веществ и продуктов реакции, но не зависит от пути процесса. Изменение энтальпии реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов). Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции (суммирование проводится с учетом стехиометрических коэффициентов). |
