Обмен белков. Учебное пособие для самостоятельной работы студентов особая роль белков в питании
 Скачать 3.49 Mb. Скачать 3.49 Mb.
|
ОРНИТИНОВЫЙ ЦИКЛМочевина - основной конечный продукт азотистого обмена, в составе которого из организма выводится избыток азота. Экскреция мочевины в норме составляет около 25 г/сут. Синтезируется только в печени. Катаболизм аминокислот и образование аммиака происходят во многих тканях. Для транспорта азота из тканей в печень используется 3 соединения: глутамин, аланин и аммиак. Орнитиновый цикл в печени выполняет 2 функции: • превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; • синтез аргинина и пополнение его фонда в организме. Полный набор ферментов орнитинового цикла есть только в гепатоцитах (рис.6). В последней реакции цикла, которая происходит только в печени, под действием аргиназы аргинин распадается на мочевину и орнитин. Орнитин вновь поступает в митохондрии и повторно включается в цикл синтеза мочевины. Молекула мочевины содержит 2 атома азота: • первый атом N* поступает в цикл в виде аммиака, образующегося в митохондриях. Реакция катализируется митохондриальной карба-моилфосфатсинтетазой I. • второй атом N** вводится в мочевину из аспарагиновой кислоты. Аммиак, используемый карбамоилфосфатсинтетазой I, поставляется в печень главным образом из кишечника с кровью воротной вены. Роль других источников, в том числе окислительного дезаминирования глутаминовой кислоты, существенно меньше. Аспарагиновая кислота, необходимая для синтеза аргининосукцината, образуется в печени с использованием аминогруппы аланина, который поступает главным образом из мышц и клеток кишечника. Oбразующийся в орнитиновом цикле фумарат в результате 2 реакций превращается в оксалоацетат, из которого путем трансаминирования образуется аспартат. Таким образом, с орнитиновым циклом сопряжен цикл регенерации аспартата из фумарата. Пируват, образующийся в этом цикле из аланина, используется для глюконеогенеза. Еще один источник аспартата для орнитинови цикла - трансаминирование глутамата с оксалоацетатом.  Рисунок 6 В орнитиновом цикле расходуются 4 макроэргические связи 3 молекул АТР на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину обеспечивает сам себя энергией: - при регенерации аспартата из фумарата на стадии дегидрирования малата образуется NADH, который может обеспечить синтез 3 макроэргических связей (рис.7); - при окислительном дезаминироваиии глутамата в разных органах также образуется NADH, который может обеспечить образование 3 макроэргичес-ких связей. Затраты энергии происходят и при трансмембранном переносе веществ, связанном с синтезом и экскрецией мочевины. Первые 2 реакции орнитинового цикла исходят в митохондриях, а последующие 3 - в цитоплазме. Цитруллин, образующийся в митохондрии, должен бьпъ перенесен в цитозоль, а орнитин, образующийся цитозоле, должен быть перенесен в митохондрию. Кроме того, в почках перенос мочевины из крови в мочу происходит за счет градиента ионов натрия, создаваемого К+, Na+- АТРазой. 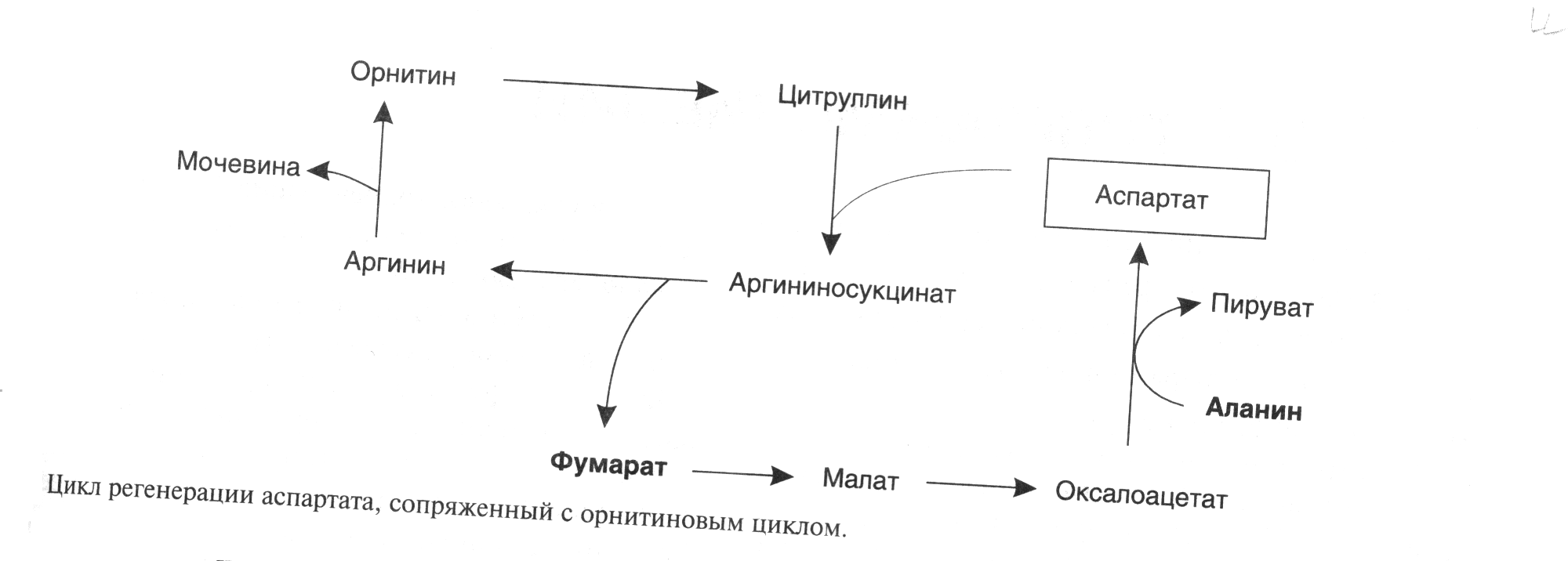 Рисунок 7 Отдельные ферменты орнитинового цикла обуживаются не только в печени, но и в других тканях. В энтероцитах, например, имеется 2 первых фермента и, следовательно, может синтезироваться цитруллин. В почках обнаружены 3-й и 4-й ферменты цикла. Цитруллин, образовавшийся в энгероцитах, может поступать в почки и превращаться там в аргинин, который переносится в печень и гидролизуется аргиназой. Активность этих водящихся в разных органах ферментов значимо ниже, чем в печени. СПЕЦИФИЧЕСКИЕ ПУТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ. Эти пути обмена определяются различиями в строении радикалов аминокислот, поэтому они разнообразны и многочисленны. Вступая в эти специфические реакции, аминокислоты принимают участие во многих важных процессах: а) в синтезе гормонов и нейромедиаторов, б) в синтезе простетических групп сложных белков - хромопротеинов и нуклеопротеинов, в) в синтезе сложных липидов, г) синтезе веществ, содержащих макроэргическую связь и являющихся источником энергии для клеток, д) в обезвреживании токсических веществ. Вступая в эти процессы, аминокислоты участвуют в них как всей своей молекулой, так и своими отдельными фрагментами (или группировками). Ими являются аминогруппа (NH2) и одноуглеродные фрагменты: -СН3, -CH2-, -С=О, -СН= , -СН2ОН. Одноуглеродные фрагменты образуются из простейших аминокислот - глицина, серина, аланина и треонина под действием ферментов, коферментом которых является тетрагидрофолиевая кислота/ТГФК/. ТГФК - производное витамина Вс (фолиевой кислоты), она образуется из фолиевой кислоты в результате ее восстановления с помощью НАДФН2. Одноуглеродный фрагмент, соединенный с ТГФК называют активным одноуглеродным фрагментом или " активный С1. ОБМЕН ГЛИЦИНА И СЕРИНА. Это заменимые аинокислоты, которые превращаются друг в друга. Основным путем распада глицина является его распад на СО2, Н2О и метилен-ТГФК (активный С1): 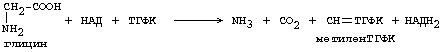 Из метилен-ТГФК могут образовываться все другие формы активного С1: формил-ТГФК, метил-ТГФК, метен-ТГФК, оксиметил-ТГФК в результате реакций окисления или восстановления метилен-ТГФК. Активный С1, образовавшийся из глицина участвует в синтезе пуриновых азотистых оснований. Кроме того, глицин всей своей молекулой участвует в синтезе гема гемоглобина и других гемопротеинов, в синтезе пуриновых азотистых оснований, в синтезе парных желчных кислот (гликохолевая кислота), в синтезе креатина, в синтезе трипептида глютатиона. Также глицин в печени участвует в обезвреживании бензойной кислоты, которая превращается в гиппуровую кислоту: 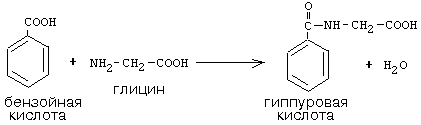 Основным путем распада серина является его превращение в метилен-ТГФК и глицин: 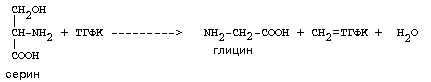 Всей своей молекулой серин участвует в синтезе сложных липидов - фосфолипидов. Он участвует в синтезе фосфатидилсерина, который декарбоксилируется и превращается в фосфатидилэтаноламин, который после метилирования превращается в фосфатидилхолин. В реакции метилирования участвует активная форма метионина - S-аденозилметионин. Серин в составе белков-ферментов участвует в формировании каталитического центра фермента, например, в сериновых протеазах: трипсине, химотрипсине и др. Также серин участвует в формировании гидратной оболочки белков, потому что является полярной аминокислотой. ОБМЕН СЕРУСОДЕРЖАЩИХ АМИНОКИСЛОТ: МЕТИОНИНА И ЦИСТЕИНА. Метионин - это незаменимая аминокислота, а цистеин - заменимая. 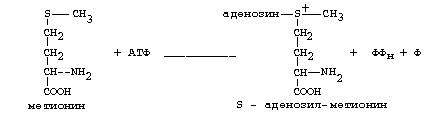 Главной особенностью обмена метионина является то, что из него тоже образуется активный С1 в виде СН3-группы, которая участвует в различных синтезах. Однако, этот активный С1 образуется без участия ТГФК. Чтобы стать источником СН3- группы, метионин подвергается активации с участием АТФ. В результате этой реакции от АТФ отщепляются все три остатка фосфорной кислоты, а аденозин присоединяется к атому серы метионина. Так образуется активная форма метионина - S- аденозил-метионин. S-аденозил-метионин участвует в реакциях трансметилирования. Наиболее важный из них синтез фосфатидилхолина из фосфатидилэтаноламина, обезвреживание биогенных аминов с участием О-метилтрансфераз, синтез адреналина из норадреналина, синтез ацетилхолина из холина и Ацетил-КоА, синтез креатина, который в виде креатинфосфата является резервной формой макроэргических связей и участвует в обеспечении нервной ткани и работающей мышцы АТФ. Синтез креатина. 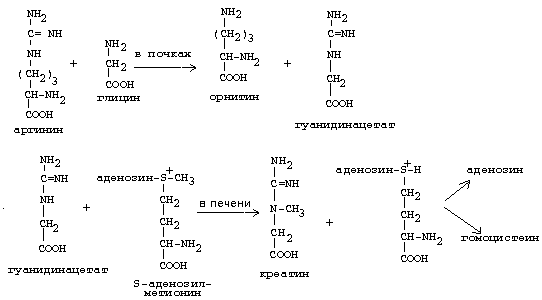 В синтезе креатина участвуют и другие аминокислоты - аргинин и глицин. В почках из аргинина и глицина образуется гуанидинацетат, который метилируется в печени с участием S-аденозил-метионина и в результате образуется креатин: Гомоцистеин участвует в синтезе амикислот - цистеина (гомоцистеин + серин). Креатин подвергается фосфорилированию с участием АТФ, в результате образуется соединение с макроэргической связью - креатинфосфат. Это обратимая реакция, которая катализируется ферментом креатинфосфокиназой (КФК). 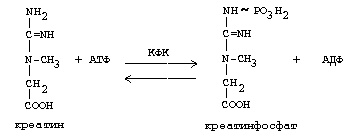 Эта реакция интенсивно идет в мышцах, особенно, в сердечной мышце, и в ткани мозга. Креатинфосфат активно синтезируется в покое и распадается при мышечной работе. Это наиболее быстрый способ регенерации АТФ. Креатин, образовавшийся из креатинфосфата распадается до креатинина, который является конечным продуктом и выводится с мочой. В сутки выводится 1-2 грамма креатинина. Это количество креатинина прямо пропорционально мышечной массе, поэтому у мужчин креатинина в моче больше, чем у женщин. Креатинин не реабсорбируется из первичной мочи, поэтому его количество во вторичной моче характеризует объем клубочковой фильтрации. 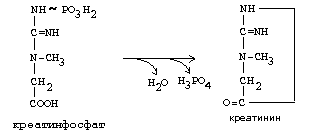 При поражении мышечных клеток и нарушении ткани мозга креатинфосфокиназа появляется в крови, это является диагностическим признаком. Известно, что КФК имеет три изофермента - кардиальный, церебральный и мышечный, появление их в крови позволяет определить поражение соответствующего органа. Появление в крови кардиального изофермента является ранним диагностическим признаком инфаркта миокарда. ОБМЕН ЦИСТЕИНА. Это заменимая аминокислота, она синтезируется из серина, гидроксильная группа которого замещается SН-группой, которую поставляет гомоцистеин. Цистеин в составе белков-ферментов своей -SН группой участвует в образовании каталитического центра (тиоловые протеазы), а также участвует в образовании дисульфидных связей, которые принимают участие в формировании третичной и четвертичной структуры белков. Также цистеин необходим для синтеза трипептида глютатиона, который состоит из цистеина и глютаминовой кислоты. Молекула глутатиона условно обозначается как (Г-SН). Глютатион способен легко окисляться и восстанавливаться: Окисляясь, глютатион предохраняет от окисления другие вещества, например, двухвалентное железо гемоглобина в эритроцитах: Восстанавливается глютатион с помощью НАДФН2 с участием фермента глютатионредуктазы. Цистеин подвергается и распаду, при этом он окисляется и декарбоксилируется, в результате образуется таурин, который участвует в образовании парных желчных кислот (таурохолевая и др.) в печени. 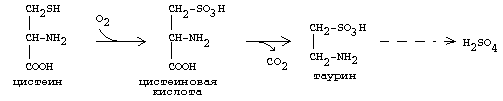 Серная кислота, которая образуется из таурина, участвует в обезвреживании токсических веществ в печени. 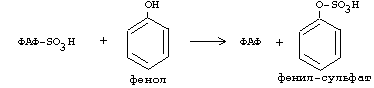 Так обезвреживаются продукты гниения белков в кишечнике - индол, скатол, фенол и крезол. В этих процессах серная кислота участвует в своей активной форме в виде 3’-фосфоаденозин-5’-фосфосульфата (ФАФC), которая образуется с участием АТФ. ОБМЕН АРГИНИНА Аргинин - частично незаменимая аминокислота. Она образуется в ходе синтеза мочевины в печени из карбомоилфосфата при участии аспарагиновой кислоты и орнитина. Аргинин участвует в синтезе креатина в почках, являясь донором гуанидиновой группы в образовании гуанидинацетата. В составе белков аргинин как полярная положительно заряженная аминокислота участвует в образовании ионных связей и в формировании гидратной оболочки белков. ОБМЕН ДИКАРБОНОВЫХ АМИНОКИСЛОТ - ГЛУТАМИНОВОЙ И АСПАРАГИНОВОЙ Эти аминокислоты вступают в многочисленные химические реакции, с которыми Вы уже знакомы и поэтому они играют главную роль в обмене аминокислот. 1. Они участвуют в реакциях синтеза заменимых аминокислот и следовательно в коррекции аминокислотного состава белков, а, значит, в коррекции аминокислотного состава клеток организма. 2. Участвуют в реакциях обезвреживания аммиака и других токсичных продуктов азотистого обмена. 3. Превращаясь в альфа-кетокислоты (альфакетоглутарат и ЩУК), они принимают участие во взаимосвязи обмена белков с обменом углеводов и жиров. 4. Дикарбоновые аминокислоты и их амиды (глутамин и аспарагин) участвуют в реакциях синтеза почти всех азотсодержащих соединений клеток (нуклеотидов, нуклеиновых кислот, аминосахаров и аминопроизводных липидов). В этих реакциях синтеза они являются донором азота в виде NН2-группы, или участвуют всей своей молекулой. КОНКРЕТНАЯ РОЛЬ КАЖДОЙ АМИНОКИСЛОТЫ: Глутаминовая кислота а) подвергается прямому окислительному дезаминированиюс образованием альфа-кетоглутарата, б) вступает в реакции трансаминирования, которые катализируют специфические трансаминазы, в) является субстратом для синтеза глютамина, который является транспортной формой аммиака и участвует в синтезе мочевины в печени, также глютамин участвует в синтезе пуриновых оснований нуклеотидов и нуклеиновых кислот, аминосахаров и аминопроизводных липидов. г) принимает участие в косвенном дезаминировании АК-т, д) участвует в синтезе трипептида глютатиона, е) является субстратом для образования гамма- аминомасляной кислоты. Аспарагиновая кислота а) участвует в реакциях трансаминирования, б) в синтезе мочевины, как донор NН2-группы, в) в синтезе пиримидиновых оснований (всей молекулой) и как донор NН2-группы - в синтезе пуриновых оснований, г) в синтезе аспарагина. Обе аминокислоты участвуют в формировании третичной и четвертичной структур белков, так как являются полярными заряженными аминокислотами и в образовании гидратной оболочки белков, а также эти аминокислоты принимают участие в формировании активных центров ферментов. Амидирование аспарагиновой и глутаминовой кислот приводит к образованию глутамина и аспарагина, необходимых для синтеза белков. ОБМЕН ЦИКЛИЧЕСКИХ АМИНОКИСЛОТ ФЕНИЛАЛАНИНА И ТИРОЗИНА Фенилаланин является незаменимой аминокислотой, а тирозин - заменимая аминокислота. Фенилаланин вступает в незначительное количество превращений в тканях. Кроме включения этой аминокислоты в структуру молекул белка, единственным путем метаболизма фенилаланина у здорового человека является его окисление в тирозин с участием фермента микросомального окисления, специфической монооксигеназой - фенилаланингидроксилазой: 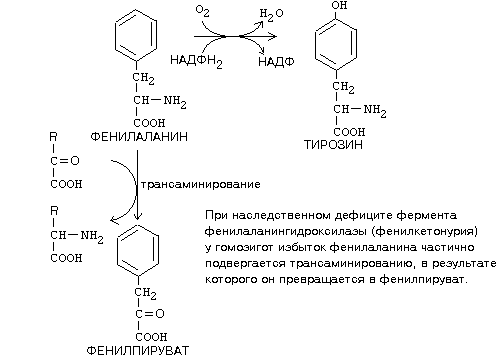 Тирозин вступает в многочисленные реакции в различных тканях. В результате этих превращений тирозин не только распадается до конечных продуктов, но и дает промежуточные метаболиты, из которых образуются ряд важных соединений, некоторые из которых являются биологически активными веществами. Из тирозина образуются: а) гормоны мозгового слоя надпочечников адреналин и норадреналин, б) меланины - пигменты кожи, волос, радужной оболочки глаза, в) йодсодержащие гормоны щитовидной железы - тироксин и трийодтиронин. 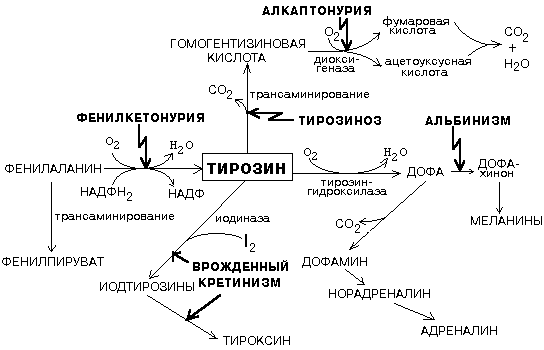 НАРУШЕНИЯ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА Нарушения обмена этих АК связано с нарушением биосинтеза некоторых ферментов, которые катализируют метаболические превращения этих АК. Результатом нарушения синтеза ферментов является возникновение наследственных генетических заболеваний: 1) фенилкетонурия - нарушен синтез фенилаланин-гидроксилазы, поэтому фенилаланин превращается в фенилпируват, который оказывает токсическое воздействие на развитие некоторых отделов головного мозга. 2) альбинизм - нарушен синтез ферментов, превращающих ДОФА в ДОФА-хром, поэтому нарушается синтез меланинов. 3) алкаптонурия - нарушен синтез диоксигеназы гомогентизиновой кислоты, она выделяется с мочой, моча приобретает черный цвет. 4) кретинизм - нарушен синтез йодиназы, что приводит к нарушению синтеза йодсодержащих гормонов щитовидной железы. 5) может быть нарушен синтез фермента тирозиназы, который катализирует превращение тирозина в ДОФА, следовательно будет нарушаться синтез гормонов мозгового слоя надпочечников и меланина. Из всех этих заболеваний в настоящее время удается лечить фенилкетонурию, для этого из рациона ребенка исключают фенилаланин и увеличивают в пище количество тирозина. Если ребенка держать на этой диете до 6-7 лет, тогда не возникает умственная отсталость, т.к. к 6-7 годам успевают развиться отделы головного мозга, развитие которых задерживается при избытке в ткани мозга фенилпирувата. ОБМЕН НУКЛЕОПРОТЕИНОВ Нуклеопротеины - это сложные белки, небелковым компонентом которых являются нуклеиновые кислоты - ДНК (дезоксирибонуклеиновая кислота) или РНК (рибонуклеиновая кислота). В живом организме нуклеиновые кислоты находятся в диссоциированном состоянии. В составе белковых компонентов очень много положительно заряженных аминокислот - аргинина и лизина, поэтому их можно отнести к поликатионам (гистоны). Белковые компоненты подвергаются обмену, как простые белки. ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ Нуклеиновые кислоты в организме постоянно обновляются. В норме синтез и распад находятся в состоянии динамического равновесия. КАТАБОЛИЗМ НУКЛЕИНОВЫХ КИСЛОТ Начинается с гидролиза 3',5'-фосфодиэфирной связи под действием ферментов нуклеаз: - ДНКазы - расщепляют ДНК - РНКазы - расщепляют РНК Среди ДНКаз и РНКаз различают: - экзонуклеазы (5' и 3'); эндонуклеазы - специфичны к мононуклеотидной последовательности, есть высокоспецифичные: рестриктазы - используются в генной инженерии. Далее происходит отщепление фосфата от мононуклеотида с участием ферментов нуклеотидаз с образованием нуклеозидов. Нуклеозид может расщепляться путем гидролиза под действием фермента нуклеозидазы на азотистое основание и пентозу, но чаще происходит фосфоролиз - при этом нуклеозид расщепляется на азотистое основание и фосфорибозу. 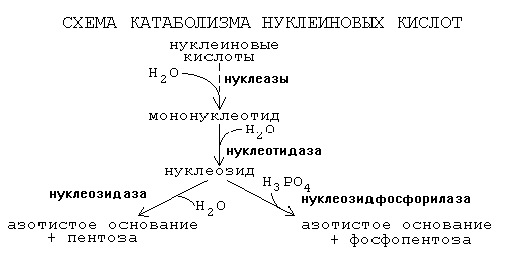 Нуклеазы очень многообразны. Различают ДНКазы и РНКазы. Отличаются друг от друга по месту действия. Бывают эндонуклеазы (расщепляют внутренние 3’5'-фосфодиэфирные связи) и экзонуклеазы (отщепляют концевые мононуклеотиды). Встречается 2 типа экзонуклеаз: 3'-экзонуклеазы - отщепляют мононуклеотид с 3'-конца молекулы, и 5'-экзонуклеазы - отщепляют 5'-концевой мононуклеотид. Нуклеазы могут отличаться друг от друга и по специфичности. Пищеварительные нуклеазы и нуклеазы лизосомальные отличаются низкой специфичностью, у них упрощенное строение активного центра. У высокоспецифичных нуклеаз очень сложное строение активного центра. Они способны «узнавать» целую последовательность нуклеотидов из 4-10 пар и расщеплять одну-единственную связь в строго определенном месте (если «узнаваемый» участок содержит содержит 4 нуклеотидные пары, то расщепляется, в среднем, одна связь из 250 возможных). Такие высокоспецифичные ДНКазы называются рестриктазами. Участки ДНК, «узнаваемые» рестриктазами, называются полиндромными последовательностями. Рестриктазы широко применяются в генной инженерии. Пентозы, образующиеся в ходе катаболизма нуклеиновых кислот, могут быть утилизированы во II-м этапе ГМФ-пути. Азотистые основания также подвергаются дальнейшему катаболизму, но по-разному, в зависимости от их типа - пуриновых (аденина, гуанина) или пиримидиновых (тимина, цитозина и урацила). Синтез и катаболизм пуриновых оснований Последовательность реакций, которая ведет к образованию пуриновых нуклеотидов, начинается с синтеза 5-фосфорибозил-1-дифосфата — ФРДФ (он же пирофосфат — ФРПФ), являющегося общим предшественником фосфорибозы в синтезе пуриновых и пиримидиновых нуклеотидов (рис.8). Перенос амидной группы глицина на ФРДФ с образованием 5-фосфорибозил-1-амина катализирует регуляторный фермент синтеза пуриновых нуклеотидов ФРДФ-амидотрансфераза. В синтезе пуриновых нуклеотидов не образуется свободное азотистое основание, а пуриновое кольцо формируется на остатке рибозо-5-фосфата при участии молекулы глицина, амидного азота глутамина, -NH2-группы аспарагина, СО2 и одноуглеродных производных: метенил- и формил-Н4-фолата . Синтезируется первый пуриновый нуклеотид — инозиновая кислота (IMP), которая двумя последовательными реакциями может превращаться в AMФ или в ГМФ. 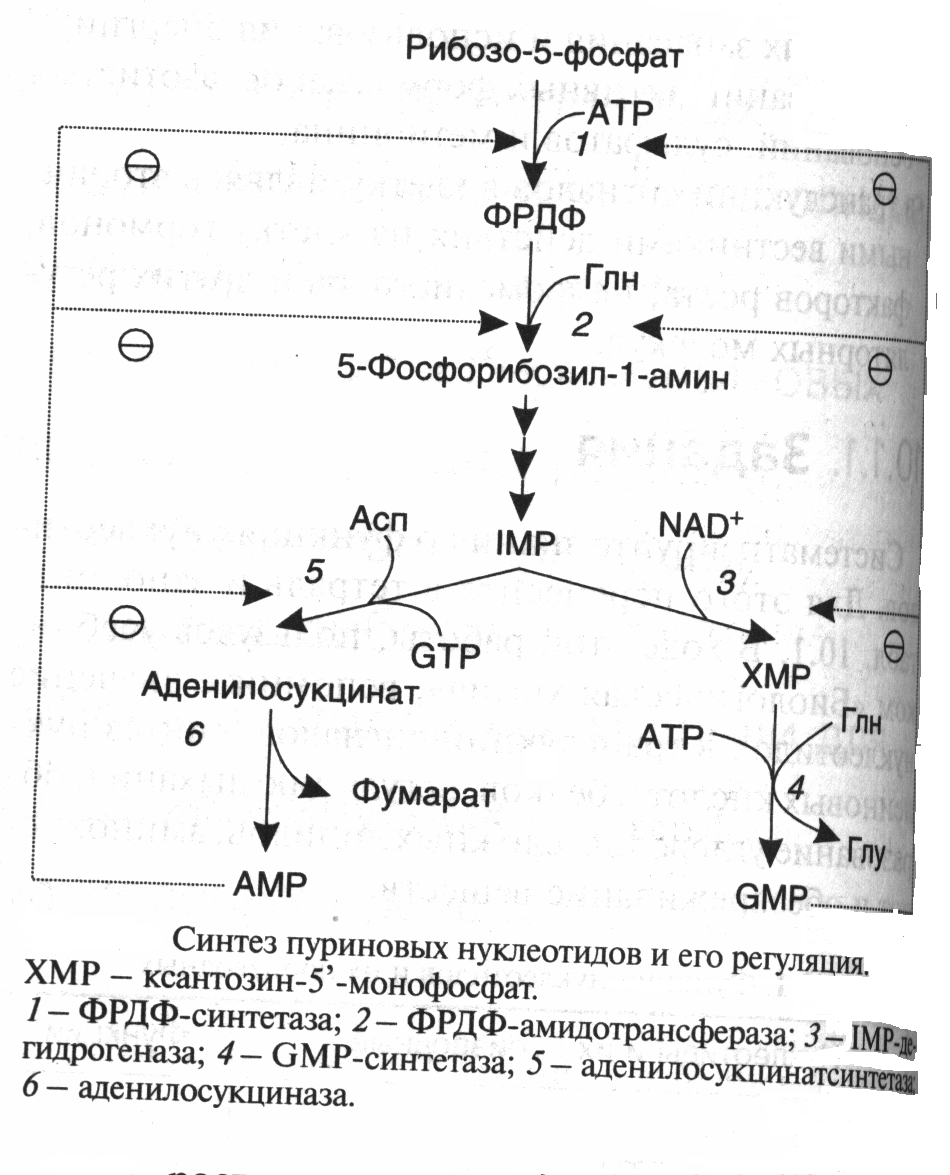 Рисунок 8 Печень является основным местом образования пуриновых нуклеотидов. Она снабжает пуринами ткани, не способные к их синтезу: эритроциты, полиморфно-ядерные лейкоциты и частично мозг. Синтез нуклеозиддифосфатов (НДФ) и нуклеозидтрифосфатов (НТФ) происходит при участии АТР и ферментов: нуклеозидмонофосфат (НМФ)- и НДФ-киназ. Например, АМР-киназа (миокиназа) катализирует реакцию: AMP+ATФ 2AДФ ГМФ-киназа катализирует: ГМФ + АТР ГДФ +ADP НДФ-киназа превращает НДФ в НТФ: НДФ +ATФ НТФ +АДФ AMФ, ГМФ и ИМФ ингибируют ключевые реакции своего синтеза по механизму отрицательной обратной связи. Первые 2 фермента отвечают за скорость синтеза пуриновых нуклеотидов по основному пути, и их ингибирование происходит лишь при одновременном повышении концентрации AMФ, ГМФ Скорость синтеза ФРДФ зависит от 2 факторов: доступности рибозо-5-фосфата и активности ФРДФ-синтетазы, регуляция активности которой имеет большее физиологическое значение, чем регуляция активности ФРДФ-амидотрансферазы. Аденилосукцинатсинтетаза и IMP-дегидрогеназа являются регуляторными ферментами на пути превращения IMP в AMФ и ГМФ. AMФ снижает превращение IMP в аденилосукцинат, а ГМФ — превращение IMP в ксантозин –5 монофосфат, поэтому от них зависит сбалансированное содержание адениловых и гуаниловых нуклеотидов. Превращение IMP в аденилосукцинат в ходе синтеза AMФ требует ГТФ, а превращение ксантозин –5 монофосфата в ГМФ - АТФ. Перекрестная регуляция между путями использования IMP служит для того, чтобы снизить синтез одного пуринового нуклеотида при дефиците другого. Пуриновые нуклеотиды синтезируются «запасньм путем» из азотистых оснований и нуклеозидов. Этот путь имеет вспомогательное значение, давая от 10 до 20% общего количества нуклеотидов. При этом используются азотистые основания, образующиеся процессе катаболизма нуклеиновых кислот («путь спасения»). Два фермента катализируют эти реакции: i) аденинфосфорибозилтрансфераза, отвечающая и образование AMФ из аденина и ФРДФ: Аденин + ФРДФ AMP + Н4Р2О7 i) гипоксантингуанинфосфорибозилтрансфераза, которая использует в качестве субстратов гипоксантин и гуанин: Гуанин + ФРДФ ГМФ Гипоксантин + ФРДФ IMP В результате совместного действия этих ферментов снижается выход конечного продукта обмена пуринов - мочевой кислоты. Другой «запасной путь» включает фосфорилирование пуриновых нуклеозидов с помощью АТР. Так, аденозинкиназа катализирует фосфорилирование аденозина до AMФ или дезоксиаденозина до dAMФ: Аденозин + АТФ AMФ + AДФ Катаболизм пуриновых нуклеотидов приводит к образованию мочевой кислоты. Мононуклеотиды теряют фосфатный остаток гидролитически под действием фосфатаз или нуклеотидаз с образованием нуклеозидов. Дальнейшие превращения аденозина и иозина в мочевую кислоту показаны на рисунке 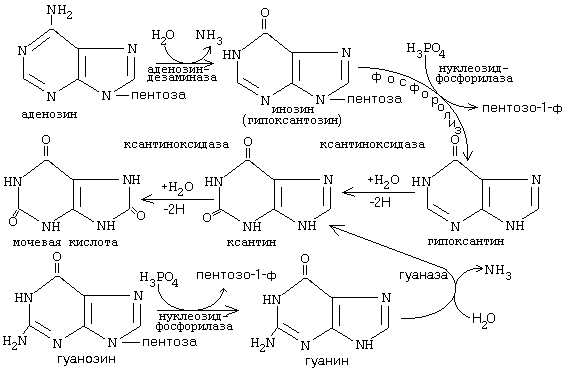 Фермент аденозиндезаминаза иногда образуется в дефектной мутантной форме, что приводит к врожденному иммунодефициту, так как нуклеотиды являются регуляторами функций лейкоцитов. Последним ферментом, участвующим в превращении азотистых оснований в мочевую кислоту, является ксантиноксидаза. Она окисляет гипоксантин в ксантин и ксантин в мочевую кислоту с участием молекулярного кислорода. У человека мочевая кислота является конечным продуктом обмена и выводится из организма с мочой. Мочевая кислота является одним из нормальных компонентов мочи. За сутки в организме образуется около 1 грамма мочевой кислоты. Мочевая кислота выводится из организма с мочой - это обычный ее компонент, но в почках организма человека происходит ее интенсивная реабсорбция. Концентрация мочевой кислоты в крови поддерживается на постоянном уровне 0.12-0.30 ммоль/л. Функции мочевой кислоты: 1. Является мощным стимулятором центральной нервной системы, ингибируя фосфодиэстеразу, которая служит посредником действия гормонов адреналина и норадреналина. Мочевая кислота пролонгирует (продлевает) действие этих гормонов на ЦНС; 2. Обладает антиоксидантными свойствами - способна взаимодействовать со свободными радикалами. Уровень мочевой кислоты в организме контролируется на генетическом уровне. Для людей с высоким уровнем мочевой кислоты характерен повышенный жизненный тонус Полиморфизм ферментов, участвующих в синтезе пуриновых нуклеотидов de novo, сопровождается образованием белков с низкой ферментативной активностью или нечувствительных к действию аллостерических эффекторов. При этом нарушается регуляция синтеза пуриновых нуклеотидов по механизму отрицательной обратной связи. Избыточно синтезирующиеся нуклеотиды подвергаются катаболизму, и образование мочевой кислоты повышается. Тот же результат получается при снижении активности «путей спасения» пуринов. Аденин, гуанин и гипоксантин не используются повторно, превращаются в мочевую кислоту, и возникает гипер-урикемия. Гиперурикемия – это состояние организма, при котором содержание мочевой кислоты в сыворотке крови превышает уровень растворимости. Сама мочевая кислота и, особенно, ее соли ураты (натриевые соли мочевой кислоты) плохо растворимы в воде. Даже при незначительном повышении концентрации они начинают начинают выпадать в осадок и кристаллизоваться, образуя камни. Кристаллы воспринимаются организмом как чужеродный объект. В суставах они фагоцитируются макрофагами, сами клетки при этом разрушаются, из них освобождаются гидролитические ферменты. Это приводит к воспалительной реакции, сопровождающейся сильнейшими болями в суставах. Такое заболевание называется подагра. Другое заболевание, при котором кристаллы уратов откладываются в почечной лоханке или в мочевом пузыре, известно как мочекаменная болезнь. Наследственное нарушение пути реутилизации пуринов вызывает развитие у мальчиков синдрома Леша—Нихена, при котором отмечается резкое снижение активности гипоксантингуанинфосфорибо-зилтрансферазы или она полностью отсутствует. Эта патология сопровождается 3—6-кратной гиперпродукцией уратов, образованием камней в почках, умственной отсталостью, агрессивным поведением и нанесением себе увечий. Синтез и катаболизм пиримидиновых оснований (рис.9) Синтез УМФ de novo, включающий 6 последовательных стадий, протекает главным образом в цитозоле клеток при участии 3 ферментов, 2 из которых полифункциональны: - первый полифункциональный фермент содержит домены, имеющие активность карбамоилфосфат-синтетазы II (КФС II), аспартаттранскарбамоилазы (АТК) и дигидрооротазы и катализирующие 3 первые реакции этого метаболического пути; 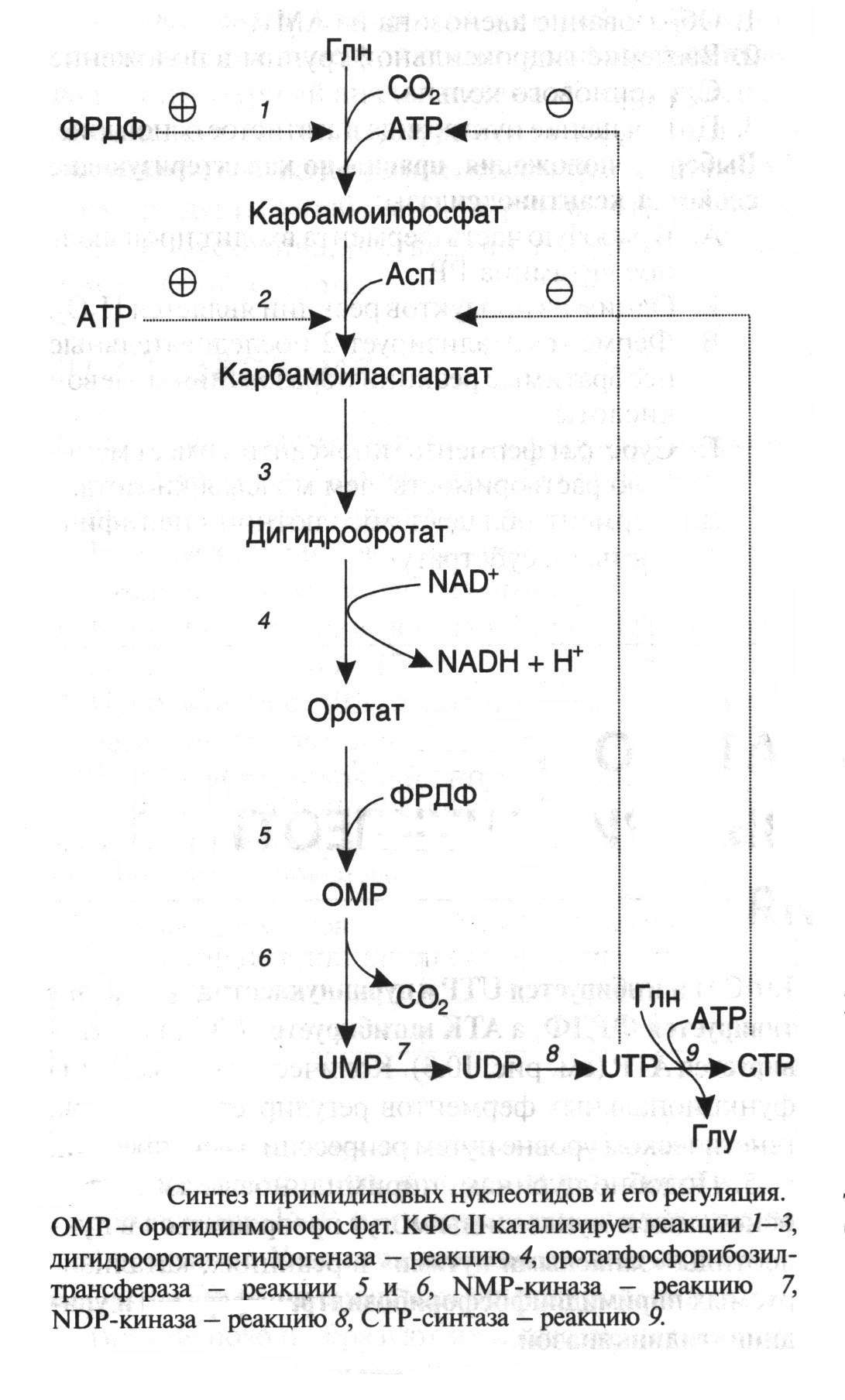 Рисунок 9 - митохондриальная NAD-зависимая дегидрооротатдегидрогеназа окисляет дигидрооротат в оротат; - превращение азотистого основания оротата в нуклеотид и его последующее декарбоксилирование до УМФ катализирует второй полифункциональный фермент, обнаруживающий оротатфосфорибозилтрансферазную и оротатдекарбоксилазную активность. НМФ- и НДФ-киназы катализируют превращение НМФ в полифосфорные производные за счет переноса фосфата АТФ на НМФ с образованием НДФ и НТФ. СТР-синтаза (ЦТФ- синтаза) превращает УТФ в ЦТФ, используя амидную группу глутамина и энергию АТР для аминирования пиримидинового кольца. Аллостерически регулируется активность 2 ферментов первого полифункционального комплекса: КФС II ингибируется УТФ и пуриннуклеотидами, но активируется ФРДФ, а АТК ингибируется ЦТФ, но активируется АТФ. Количество обоих полифункциональных ферментов регулируется также на генетическом уровне путем репрессии и дерепрессии. Подобно пуринам, пиримидиновые азотистые основания и нуклеозиды могут превращаться в нук-леотиды «запасными путями» в реакциях, катализируемых пиримидинфосфорибозилтрансферазой и ури-динцитидинкиназой. Синтез пуриновых и пиримидиновых нуклеотидов строго координируется: ФРДФ активирует оба синтеза, а накопление пурин - и пиримидиннуклеотидов ингибирует образование ФРДФ по механизму отрицательной обратной связи. Описано редкое наследственное заболевание — оротацидурия, при котором в результате мутации в гене второго полифункционального фермента нарушается превращение оротата в УМФ. С мочой выделяется до 1,5 г оротата (в 1000 раз больше, чем в норме), и развивается недостаточность пиримидиновых нуклеотидов. 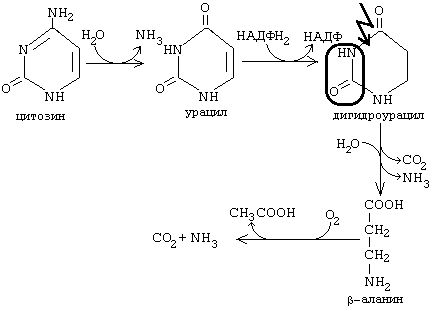 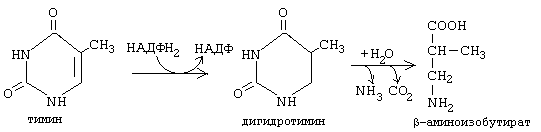 Ферментные системы организма способны разрушать пиримидиновые основания с образованием продуктов. Цитозин распадается с образованием CO2, NH3 и -аланина. Тимин распадается подобно урацилу, но сохраняется CH3-группа, и вместо -аланина образуется -аминоизобутират, а также CO2 и NH3. Поскольку тимин встречается только в ДНК, то по уровню -аминоизобутирата в моче судят об интенсивности распада ДНК. -аланин хорошо растворим в воде, имеет физиологическое значение, содержится в плазме в свободном виде или включается в мышечные белки - карнозин и ансерин. NH3 используется для синтеза мочевины. БИОСИНТЕЗ ДЕЗОКСИРИБОНУКЛЕОТИДОВКлетки, как правило, содержат в 5—10 раз больше РНК, чем ДНК. Пролиферирующие клетки для репликации генома нуждаются в дезоксинуклеозидтрифосфатах (dNTP), которые образуются путем прямого восстановления пуриновых и пиримидиновых НДФ в дезоксипроизводные и последующего фосфорилирования dNDP-киназами с использованием АТР. Восстановление всех рибонуклеотидов катали-ует рибонуклеотидредуктазный комплекс, который включает собственно рибонуклеотидредуктазу (РНР), белковый кофактор тиоредоксии и систему его регенерации: фермент флавиновой природы тиоредоксинредукгазу и НАДФН. Непосредственным восстановителем НАДФ является тиоредоксин, сульфгидрильные группы которого в ходе этой реакции окисляются. РНР — аллостерический фермент, и его активность зависит от концентрационных соотношений дезоксирибонуклеотидов: dATP является ингибитором восстановления всех рибонуклеотидов. Синтез dTMФ из dУМФ катализирует тимидилатсинтаза с участием N5N10-метилен-H4 -фолата, за счет которого: а) включается одноуглеродный радикал в молекулу dУМФ; б) восстанавливается метиленовая группа в метильную. Скорость синтеза dTMФ зависит от скорости восстановления продукта реакции дигидрофолата в H4-фолат с помощью дигидрофолатредуктазы. 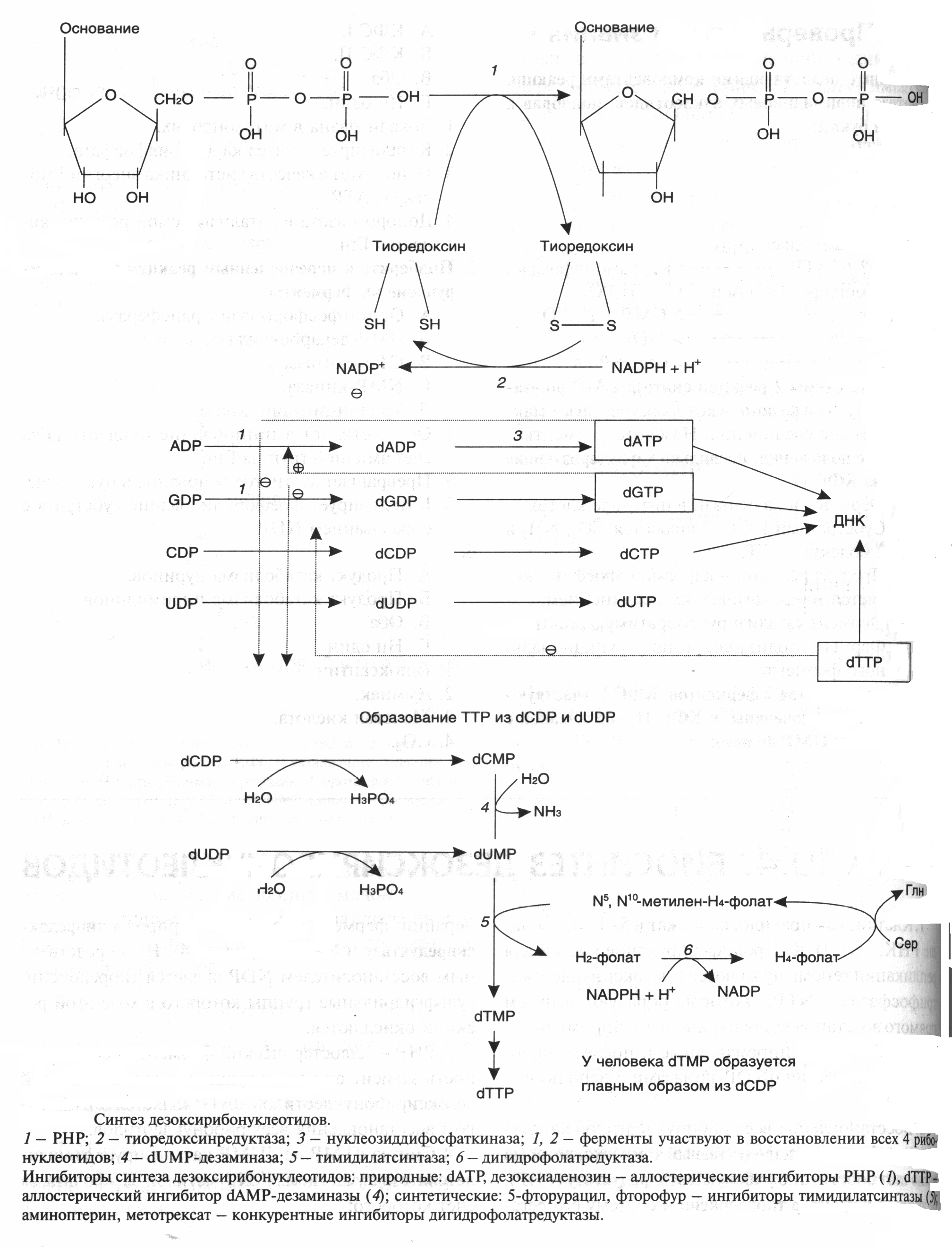 Рисунок 10 Образование dУМФ осуществляется двумя путями: дефосфорилированием dУДФ или дефосфорилированием dЦДФ и последующим гидролитическим дезаминированием dЦМФ с помощью dЦМФ-дезаминазы. В организме человека преобладает последний путь. Количество ферментов РНР и тимидилатсинтанзы регулируется на генетическом уровне по механизму индукции и зависит от скорости синтеза ДНК. Высокая активность РНР и тимидилатсинтазы наблюдается только тогда, когда клетки активно синтезируют ДНК и готовятся к делению. Некоторое количество дезоксирибонуклеотидов может образовываться по «запасному пути» в реакциях, катализируемых тимидинкиназой и дезокси-штидинкиназой. Нарушения обмена белковНарушения переваривания и всасывания: Дефицит пепсина может возникать при частичной резекции желудка за счет уменьшения секреции пепсиногена главными клетками слизистой (их количество сокращено), кроме того, при пониженной кислотности (низкое содержание соляной кислоты) пепсиноген плохо активируется до пепсина. В результате этого белки не полностью расщепляются до пептидов и вся нагрузка по их дальнейшему перевариванию ложится на тонкий отдел кишечника. Дефицит трипсина, энтеропептидазы, карбоксипептидазы может быть как результат смещения рН в более кислую сторону, патологии панкреаса или нарушение секреции желудком гормона гастрина, который контролирует секрецию ферментов панкреаса. В результате негидролизованные белки и пептиды не могут всосаться в стенки кишечника и поступают в тонкий отдел, где подвергаются массовому гниению. При этом происходит аутоинтоксикация организма на фоне низкого содержания в крови аминокислот. Молекулярные нарушения обмена аминокислотОбычно имеют наследственный характер, при этом аминокислоты и их метаболиты оказывают токсический эффект на организм. В первую очередь это выражается в виде расстройства деятельности центральной нервной системы (ЦНС). Гипераминоацидемии - повышенное содержание в крови отдельных аминокислот и аминоацидурии - обнаружение в моче аминокислот обусловлены дефектом ферментов обмена аминокислот Типичный пример: фенилкетонурия связанные с нарушением канальциевого транспорта аминокислот в почках. Нарушение биосинтеза мочевиныМожет проявляться в виде недостаточности карбомоилфосфатсинтетазы, катализирующей включение аммиака в орнитиновый цикл. Кроме того, известны случае дефицита всех остальных ферментов цикла мочевины, а поскольку аммиак является ядовитым веществом, то нарушения синтеза мочевины проявляется в виде расстройств нервной системы или развития комы. Литература: Биохимия. Краткий курс с упражнениями и задачами /под редакцией Е. С. Северина и А.Я. Николаева – М.:ГЭОТАР-МЕД, 2001.- 448 с. 2. Гринстейн Б., Гринстейн А. Наглядная биохимия: Пер. с англ. – М.:ГЭОТАР-МЕД, 2000.- 119 с.- («Экзамен на отлично») |
