Обмен белков. Учебное пособие для самостоятельной работы студентов особая роль белков в питании
 Скачать 3.49 Mb. Скачать 3.49 Mb.
|
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТКатаболизм аминокислот ускоряется при: поступлении с пищей больших количеств белка, гак как аминокислоты не могут запасаться в организме; голодании, так как распадаются белки тканей; сахарном диабете и других длительно протекающих тяжелых заболеваниях. Катаболизм аминокислот чаще всего начинается с реакции дезаминирования - удаления -аминогруппы. В отличие от трансаминирования при дезаминировании общее количество аминокислот уменьшается. -Аминогруппа отщепляется в виде аммиака. Аммиак - токсичное соединение, поэтому в клетках подвергается обезвреживанию. Безазотистый остаток представляет собой --кетокислоту, которая включается (рис.3): • в реакции трансаминирования для синтеза заменимых аминокислот; • в анаплеротические реакции для восполнения убыли метаболитов ОПК, используемых для синтеза других соединений; • в глюконеогенез; • в кетогенез; • в реакции окисления до СО2, и Н20. 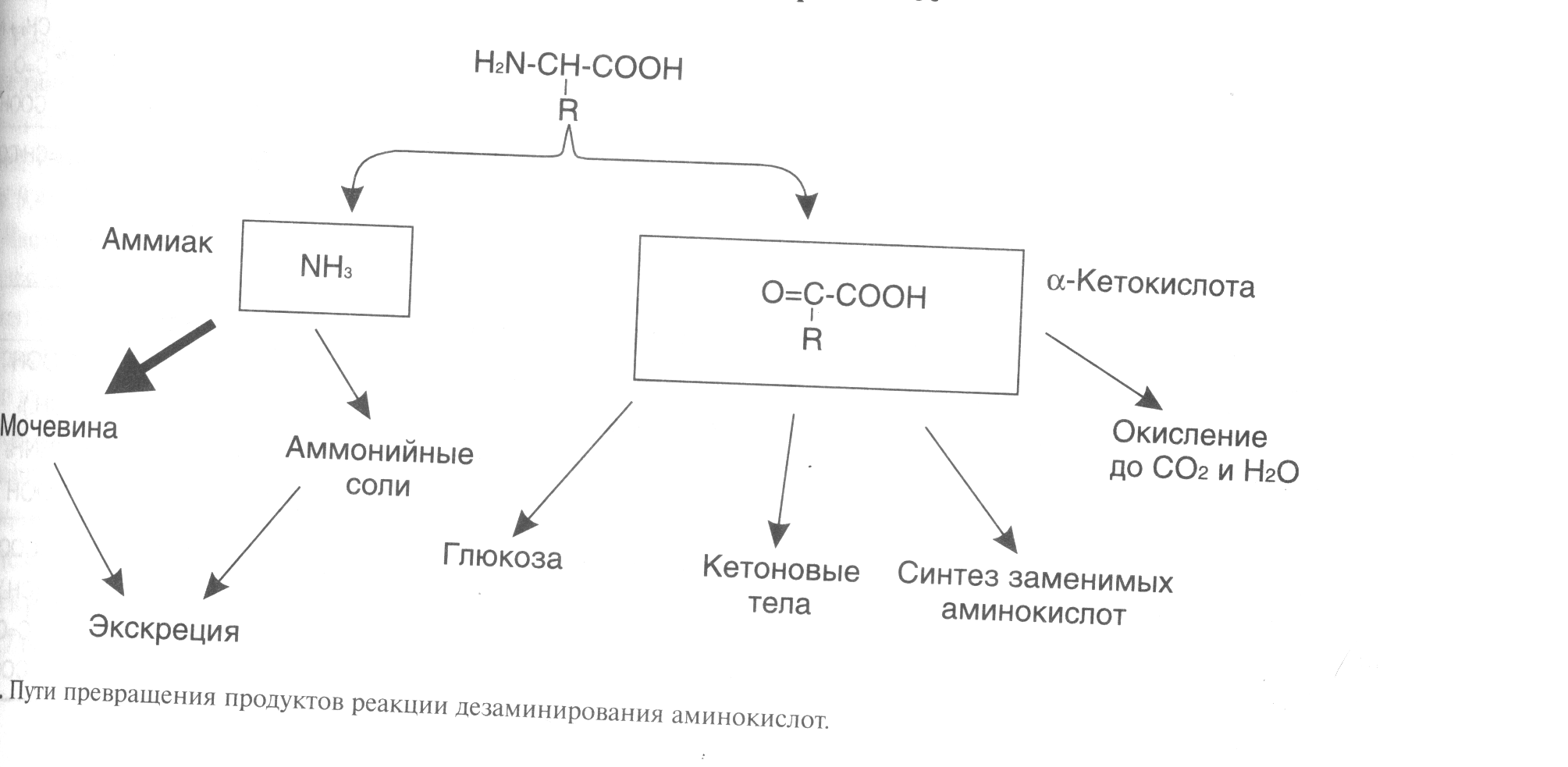 Рисунок 3 Дезаминированию подвергаются все аминокислоты, кроме лизина. Реакции дезаминирования: а) окислительное - для Глу; б) неокислительное - для Сер, Тре, Гис и Цис; в) непрямое - для остальных аминокислот. Окислительное дезаминирование глутамата происходит в присутствии кофермента NAD+. Реакция происходит в митохондриях многих тканей, наиболее активно в печени. Прямому окислительному дев минированию подвергается только глутамат. Фермент, катализирующий эту реакцию глутаматдегидрогеназа. Глутамат-ДГ является никотинамидной, то отнимаемые протоны и электроны не передаются сразу на кислород, а транспортируются по полной цепи МтО с образованием воды и параллельным образованием трех молекул АТФ. Прямому неокислительному дезаминированию подвергаются: • серии и треонин - дезаминирование происходит с отщеплением воды; • гистидин дезаминируется внутримолекулярным способом; • цистеин дезаминируется с выделением H2S и с использованием Н2О. Большинство аминокислот подвергается в клетке непрямому дезаминированию, которое включает двестадии: • трансаминирование с --кетоглутаратом, образование Глу в цитозоле клетки; • окислительное дезаминирование Глу в митохондриях. Центральную роль в непрямом дезаминированини играют глутамат и -кетоглутарат. ОБМЕН АММИАКАОсновным источником аммиака является катаболизм аминокислот, однако аммиак может образовываться при распаде других азотсодержащих соединений(биогенных аминов, нуклеотидов) в тканях (рис.4). Часть аммиака образуется в кишечнике в результате жизнедеятельности микрофлоры кишечника (гниение белков) и всасывается в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно выше, чем в общем кровотоке. 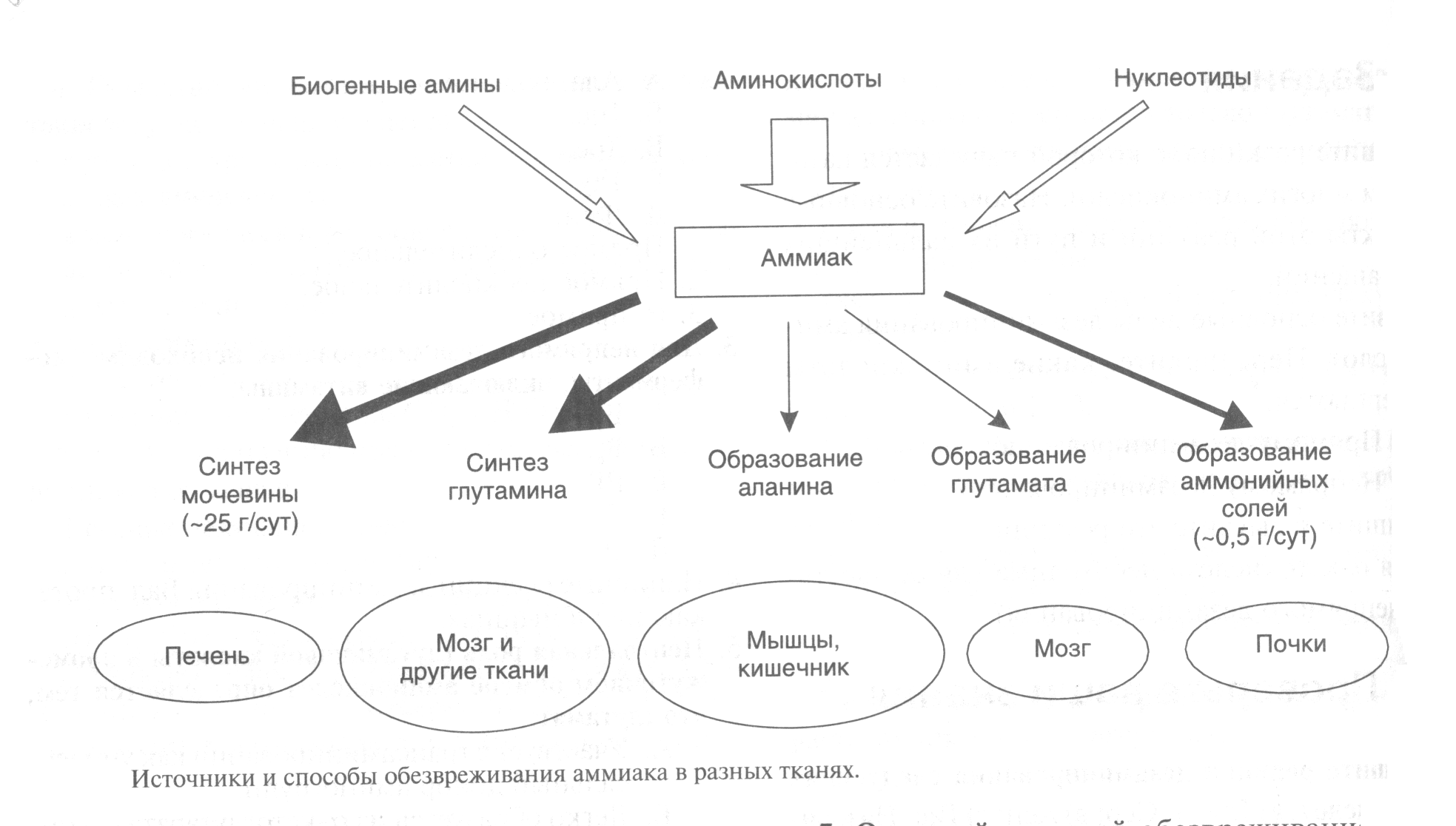 Рисунок 4 Катаболизм аминокислот и, следовательно, образование аммиака происходят во всех тканях. Концентрация аммиака в крови очень мала, так как он является токсичным веществом и быстро обезвреживается в клетках. Содержание аммиака в крови в норме 0.4 -0,7мг/л, или 25-40 мкмоль/л. Токсичность аммиака связана с его действием на центральную нервную систему. Образовавшийся в клетках аммиак связывается (обезвреживается) и выводится почками в виде конечных продуктов азотистого обмена: • мочевины - синтезируется в печени; • аммонийных солей - образуются в почках. Существует несколько способов обезвреживания и выведения аммиака в разных тканях (рис.5). Основной реакцией обезвреживания аммиака почти во всех тканях является синтез глутамина действием глутаминсинтетазы: Глутаминсинтетаза обладает высоким сродством к аммиаку, и благодаря этой реакции в крови и тканях поддерживается низкая концентрация NH3. Глутамин является транспортной формой аммиака, так как представляет собой нейтральную аминокислоту, способную легко проникать через клеточные мембраны путем облегченной диффузии (в отличие от глутаминовой кислоты, требующей механизмов активного транспорта). Из многих органов глутамин поступает в кровь, в наибольшем количестве - из мышц и мозга. Образовавшийся в тканях глутамин транспортируется в почки и кишечник. В клетках кишечника Глн отщепляется амидная группа в виде NH3, образовавшийся глутамат трансаминируется с образованием аланина. В энтероцитах амидная группа глутамина превращается в аммиак, а аминогруппа глутамина - в аминогруппу аланина. В почках глутамин также подвергается действию глутаминазы и расщепляется на аммиак и глутамат, который реабсорбируется и аозвращается в клетки тканей. Глутаминаза почек активируется при ацидозе, когда полученный аммиак используется для нейтрализации кислых продуктов и образования аммонийных солей, которые экскретируются с мочой. Эта реакция защищает организм от потери с мочой ионов натрия и калия, которые также могут быть использованы для выведения избытка анионов. Еще одной реакцией обезвреживания аммиака в мозге и некоторых других органах является восстановительное аминирование -кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, хотя, если учитывать последующее образование глутамина, является выгодным для клеток, так как способствует обезвреживанию сразу 2 молекул NH3 Из мышц и некоторых других тканей избыток аммиака выводится в виде аланина. Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, источником которого служат безазотистые остатки аминокислот, а также глюкоза. Особенно много аланина выделяют мышцы в силу их большой массы, а также потому, что работающие мышцы часть энергии получают за счет распада аминокислот Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Полученный аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там в процессе гликолиза окисляется до пирувата. Образование аланина в мышцах, его перенос в печет перенос глюкозы, синтезированной в печени в обратном направлении составляют глюкозо-аланиновый цикл. 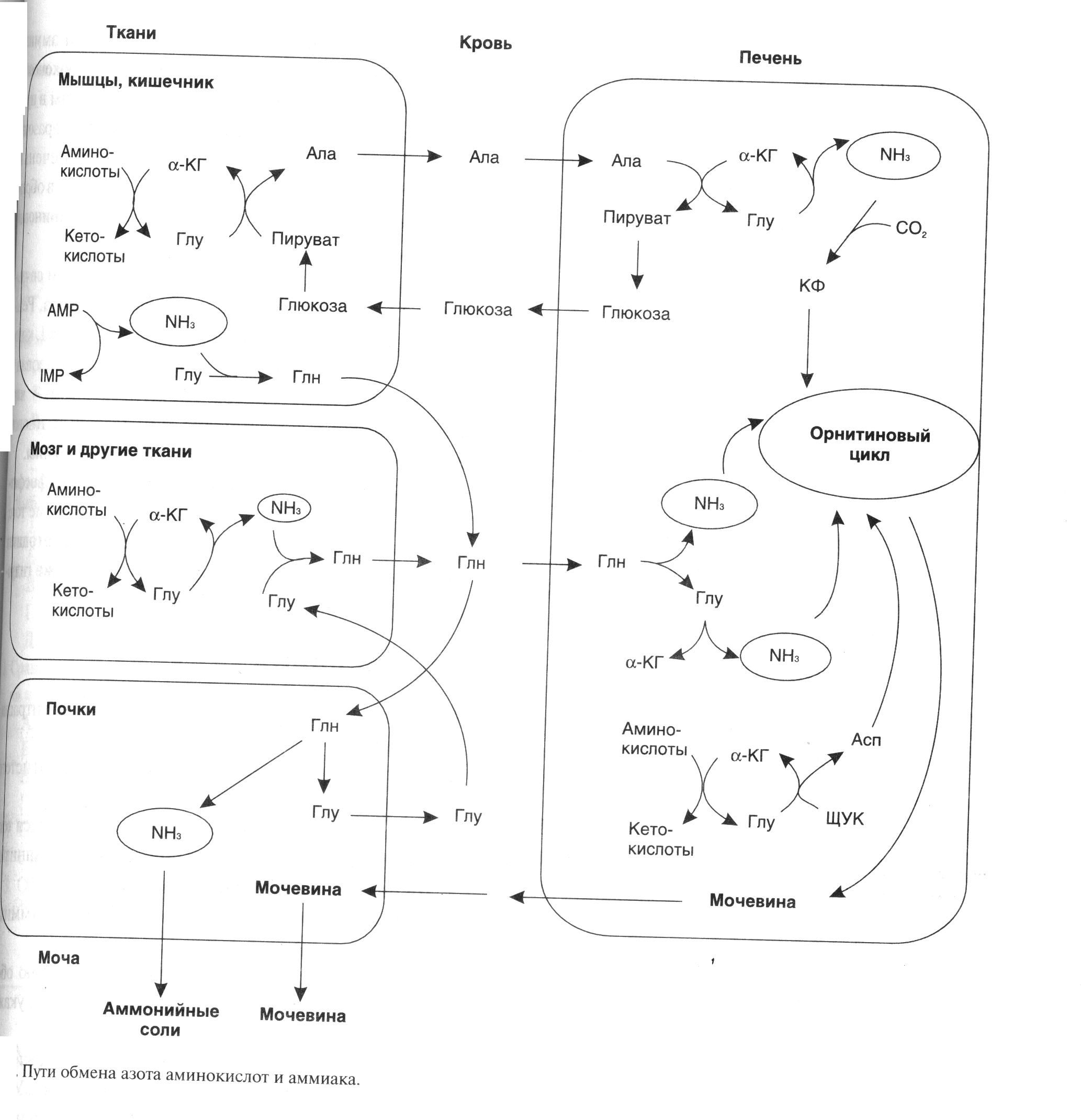 Рисунок 5 В печени аммиак обезвреживается путем образования с СО2 и образования карбамоилфосфата. Реакцию катализирует карбамоилфосфатсинтетаза I, которая использует 2 моль АТР. Фермент локализован в митохондриях гепатоцитов. Продукт реакции карбамоилфосфат - используется затем в орнитиновом цикле Кребса-Гензелейта для синтеза мочевины. Основная часть аммиака для карбамоилфосфатсинтетазы I поставляется из кишечника. Кроме того, аммиак может образоваться и в самих гепатоцитах путем дезаминирования аминокислот, а также гидролиза глутамина. |
