Пособие по физиологии крови. Учебное пособие для студентов Уфа 2015 удк ббк м рецензенты
 Скачать 1.89 Mb. Скачать 1.89 Mb.
|
|
Соединения гемоглобина. В норме гемоглобин содержится в виде 3-х физиологических соединений: Оксигемоглобин (HHbO2) – гемоглобин, присоединивший к себе кислород. Артериальная кровь имеет ярко-алый цвет за счет него. Восстановленный или дезоксигемоглобин (HHb) - оксигемоглобин, который отдал кислород. Он находится в венозной крови, которая имеет более темный цвет, чем артериальная. Карбгемоглобин (HHbCO2) - соединение Hb с углекислым газом, который транспортирует СО2 из тканей к легким. Гемоглобин обладает способностью образовывать и патологические соединения: Карбоксигемоглобин (HbСО) - соединение гемоглобина с угарным газом. Сродство железа гемоглобина к СО превышает его сродство к кислороду, поэтому даже 0,1% СО в воздухе ведет к превращению 80% гемоглобина в карбоксигемоглобин, который не способен присоединять О2, что опасно для жизни. Однако, это обратимый процесс, и при вдыхании чистого кислорода карбоксигемоглобин легко распадается, чем на практике пользуются для лечения отравлений угарным газом. Метгемоглобин (MetHb) (окисленный гемоглобин) – соединение гемоглобина, в котором под влиянием сильных окислителей (перманганат калия, анилин, бертолетова соль) железо гема из 2-х валентного переходит в 3-х валентное. При накоплении в крови больших количеств метгемоглобина транспорт кислорода к тканям нарушается и может наступить смерть. Только переливание крови может оказать действенную помощь. Цветовой показатель крови. Эритроциты, нормально насыщенные гемоглобином, получили название нормохромные; со сниженным количеством гемоглобина – гипохромные, а с повышенным содержанием – гиперхромные. Оценить степень насыщения эритроцитов гемоглобином позволяет цветовой показатель (ЦП). Среднее содержание гемоглобина в одном эритроците составляет 33 пг. Величину 33 пг принимают за единицу и обозначают как цветовой показатель. В норме цветовой показатель равен 0,8 – 1,1. По цветовому показателю судят о том, является ли содержание гемоглобина в эритроцитах исследуемого лица нормальным, пониженным или повышенным по отношению к норме, что имеет важное практическое (диагностическое) значение. Вычисление цветового показателя производится по формуле: 3 х Hb(г/л) ЦП = -------------------------------------------- три первые цифры числа эритроцитов Скорость оседания эритроцитов (СОЭ). Удельный вес эритроцитов (1,096) выше, чем плазмы (1,027), и поэтому в пробирке с кровью, лишенной возможности свертываться, они медленно оседают на дно. СОЭ у здорового мужчины составляет 1-10 мм/час, а у женщин – 2-15 мм/час. При некоторых состояниях (беременности, эмоциональном или физическом напряжении, воспалительных процессах, опухолях) СОЭ увеличивается. Это происходит за счет склонности эритроцитов к образованию агрегатов – «монетных столбиков». Эритроциты сначала перестают отталкиваться друг от друга, склеиваются и затем оседают на дно пробирки. Какие же факторы способствуют изменению отрицательного заряда на поверхности эритроцитов и, как следствие, влияют на СОЭ? Количество и форма самих эритроцитов. При увеличении их количества и изменении формы эритроциты труднее склеиваются и медленнее оседают. И, наоборот, чем меньше эритроцитов, тем быстрее они оседают. Белки плазмы крови. СОЭ снижается при увеличении содержания в плазме альбуминов и повышается при увеличении содержания фибриногена и глобулинов. Холестерин, антигены, иммуноглобулины или антитела, образующиеся в избытке при патологических состояниях, липопротеины, мукополисахариды ускоряют СОЭ. РН крови: ацидоз замедляет, а алкалоз ускоряет СОЭ. Минеральные соли. Снижение солей кальция ускоряет СОЭ и, наоборот. Гемолиз эритроцитов. Гемолизом называют разрушение оболочки эритроцитов, сопровождающееся выходом из них гемоглобина в плазму крови. Виды гемолиза. Химический – происходит под влиянием веществ, разрушающих белково-липидную оболочку эритроцитов (эфир, хлороформ, алкоголь, бензол и другие). Механический – возникает при сильных механических воздействиях на кровь (сильное встряхивание бутылки с кровью). Термический – наблюдается при замораживании и размораживании крови. Разрушение оболочки эритроцитов при этом происходит кристалликами льда. Биологический – развивается при переливании несовместимой крови, при укусах змей, насекомых, под влиянием гемолизинов. Аутогемолиз – наблюдается при образовании в организме антител против собственных эритроцитов (при аутоиммунных заболеваниях). Осмотический (коллоидно-осмотический) – возникает в гипотонической среде. Известно, что в норме осмолярность плазмы и эритроцитов уравновешены, т.е. они изотоничны. Концентрация электролитов в норме составляет 0,9%. Мембрана эритроцита хорошо пропускает воду, глюкозу, анионы, но мало проницаема для катионов. Эритроциты в гипертонических солевых растворах сморщиваются вследствие диффузии воды из эритроцита в направлении большого содержания катионов. В гипотонических растворах эритроциты набухают вследствие поступления воды в эритроцит по закону осмоса (осмос – движение растворителя через полупроницаемую мембрану в направлении большой концентрации ионов натрия). Высокое внутриклеточное содержание белков, которое при этом остается постоянным, перестает компенсироваться, и осмотическое давление в эритроцитах возрастает. В результате вода начинает поступать в эритроцит, это продолжается до тех пор, пока мембрана его не лопнет и гемоглобин не выйдет в плазму, которая при этом окрашивается в красный цвет и становится прозрачной («лаковая кровь»). Это и есть осмотический гемолиз. Если внеклеточная жидкость лишь умеренно гипотонична, эритроциты набухают и приобретают форму, близкую к сферической (сфероциты). Мерой осмотической стойкости (резистентности) эритроцитов является концентрация хлорида натрия, при которой начинается гемолиз. У человека это происходит в 0,44%-0,48% растворе NaCI (минимальная граница), а в 0,28%-0,34% растворе NaCI разрушаются все эритроциты (максимальная граница). При некоторых заболеваниях осмотическая стойкость эритроцитов уменьшается, и гемолиз наступает при больших концентрациях NaCI в плазме. УЧЕБНЫЕ ВОПРОСЫ Гемоглобин, строение, свойства, количество в крови, методы определения. Физиологические разновидности гемоглобина. Соединения гемоглобина с газами. Цветовой показатель крови, его определение. Гемолиз, виды гемолиза, механизм происхождения. Понятие об аутогемолизе. Осмотическая резистентность эритроцитов, ее границы. Скорость оседания эритроцитов (СОЭ), механизм, факторы, влияющие на СОЭ. САМОСТОЯТЕЛЬНАЯ РАБОТА Темы практических работ: Определение скорости оседания эритроцитов. Определение осмотической резистентности эритроцитов. Определение содержания гемоглобина в крови. Расчет цветового показателя крови. Работа 1. Определение скорости оседания эритроцитов (СОЭ). Стабилизированная цитратом Na кровь при отстаивании разделяется на верхний светлый слой плазмы и нижний красный слой форменных элементов, среди которых значительно преобладают эритроциты. Оснащение: прибор Панченкова, 5% раствор цитрата натрия, часовое стекло. Ход работы: прибор Панченкова (рис. 5) состоит из специального штатива с гнездами и резиновыми прокладками и специальных капилляров. Капилляры представляют собой стеклянные трубки стандартной длины с просветом канала около 1 мм. На стенку капилляра нанесена миллиметровая шкала длиной 100 мм. Верхнее деление шкалы отмечено цифрой «0» и буквой «К» - кровь, нижнее – буквой «Р» - раствор. В капилляр наберите 5% раствор цитрата натрия до метки 50 («Р») и выдуйте на часовое стекло. Затем к раствору антикоагулянта добавьте кровь, набранную в капилляр дважды до метки «К» («0»), перемешайте. Заполните капилляр полученной смесью до метки «0» («К») и фиксируйте в штативе. Через 1 час произведите учет СОЭ, определяя сколько делений шкалы (в миллиметрах) занимает слой плазмы, очистившийся в результате оседания эритроцитов. 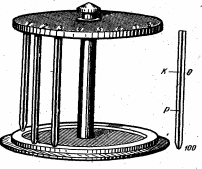 Рис. 5. Прибор Панченкова с капилляром Оформление результатов работы: полученные результаты определения СОЭ занесите в тетрадь протоколов опытов, оцените их и сделайте вывод, сравнив с нормой. Работа 2. Определение осмотической резистентности эритроцитов. Оснащение: раствор натрия хлорида убывающей концентрации: 0,9; 0,7; 0,48 и 0,28%; дистиллированная вода; эфир; пробирки (6 штук); пипетка; маркер. Таблица 2. Определение границ осмотической стойкости эритроцитов.
Ход работы: промаркируйте шесть пробирок. В четыре из них налейте по 5 мл раствора хлорида натрия разной концентрации, в пятую – 5 мл дистиллированной воды, а в шестую 4 мл физиологического раствора и 1 мл эфира. В каждую пробирку добавьте по 0,02 мл крови, осторожно перемешайте и оставьте пробирки на 1 час при комнатной температуре, после чего определите границы осмотической резистентности - минимальной (начало гемолиза - слабое розовое окрашивание надосадочной жидкости) и максимальной (полный гемолиз - эритроциты полностью разрушаются («лаковая кровь»)). Оформление результатов работы: опишите полученные результаты в тетради протоколов опытов, обращая внимание на цвет надосадочной жидкости и наличие осадка эритроцитов на дне пробирки (рекомендуется сделать цветной рисунок или оформить в виде таблицы 2). Определите границы осмотической резистентности эритроцитов, оцените их и сделайте вывод, сравнив с нормой, опишите химический гемолиз. Работа 3. Определение содержания гемоглобина в крови (метод Сали). Определение гемоглобина по методу Сали производится методом визуальной колориметрии. Принцип метода заключается в том, что гемоглобин крови под влиянием соляной кислоты превращается в солянокислый гематин бурого цвета, интенсивность окраски которого сравнивают со стандартным раствором, находящимся в гемометре Сали. Оснащение: гемометр Сали, стеклянная палочка, капилляр вместимостью 0,02 мл, 0,1 н. раствор соляной кислоты, дистиллированная вода, глазная пипетка. Ход работы: гемометр Сали представляет собой штатив с тремя гнездами. В крайние гнезда вставлены запаянные пробирки со стандартным раствором солянокислого гематина с содержанием гемоглобина в нем 166,7г/л (рис. 6а). В среднем гнезде находится градуированная пробирка (рис. 6б). Задняя стенка штатива закрыта матовым стеклом. В среднюю пробирку гемометра до нижней круговой метки «2» внесите 0,1 N раствор соляной кислоты. Капилляром наберите 0,02 мл крови. Тщательно вытрите кончик капилляра снаружи. Внесите кровь на дно пробирки таким образом, чтобы верхний слой жидкости остался прозрачным. Повторными всасываниями и выдуваниями промойте капилляр верхним слоем жидкости. Путем осторожного встряхивания содержимое пробирки перемешайте и оставьте стоять в течение 5 минут. Вследствие гемолиза и образования солянокислого гематина смесь становится прозрачной и буреет. Через 5 минут к исследуемой жидкости добавьте дистиллированную воду глазной пипеткой по каплям, каждый раз тщательно перемешивая смесь стеклянной палочкой. Разведение закончите, когда цвет жидкости сравняется с цветом стандартов. Цвет жидкости и стандартов необходимо сравнивать при дневном освещении в проходящем свете, держа гемометр в вытянутой руке на уровне глаз. Определите, какому делению шкалы соответствует нижний мениск жидкости. Цена деления шкалы соответствует 0,2. Концентрацию гемоглобина пересчитайте в граммах на 1 л (г/л), для чего полученные данные умножьте на 10. 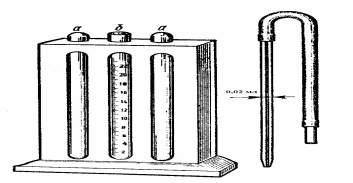 Рис. 6. Гемометр Сали и капилляр Оформление результатов работы: полученные результаты определения содержания гемоглобина занесите в тетрадь протоколов опытов, оцените их и сделайте вывод, сравнив с нормой. Работа 4.Расчет цветового показателя (ЦП) крови. Ход работы: определив в крови испытуемого содержание гемоглобина и количество эритроцитов, вычислите цветовой показатель по формуле: 3 х Hb(г/л) ЦП = -------------------------------------------- три первые цифры числа эритроцитов Оформление результатов работы: полученные результаты расчета цветового показателя занесите в тетрадь протоколов опытов, оцените их и сделайте вывод, сравнив с нормой. V. ФИЗИОЛОГИЯ ТРОМБОЦИТОВ. ГЕМОСТАЗ. ГРУППЫ КРОВИ. РЕЗУС-ФАКТОР. Физиология тромбоцитов. Тромбоциты – или кровяные пластинки это маленькие плоские клетки разнообразной формы (в основном овальной), не имеющие ядра, диаметром 1-4 мкм (рис.7). Продолжительность их жизни составляет 8-11 дней, после чего они разрушаются в печени, легких и селезенке.  Рис. 7. Тромбоцит (электронная микроскопия) Тромбоцитопоэз – это процесс образования тромбоцитов в организме. В основном он протекает в костном мозге и включает следующие этапы: КОЕ-мег (мегакариоцатарная) – промегакариобласт – мегакариобласт – промегакариоцит - зрелый мегакариоцит - тромбоцитарный мегакариоцит – протромбоциты – тромбоциты. Костный мозг человека содержит около 15х106 мегакариоцитов на 1 кг массы тела. В среднем мегакариоцит высвобождает до 3000 тромбоцитов. В 1 литре крови их содержится 150–350х109/л (200-400х109/л). Из общего количества тромбоцитов в крови находится 70%, в селезенке – 30%. Продолжительность жизни тромбоцитов 6-10 дней. Клетки разрушаются в костном мозге, селезенке и печени. Тромбоциты выполняют следующие функции: участие в процессе свертывания крови – за счет тромбоцитарных факторов свертывания крови; ангиотрофическая – проявляется в том, что они оказывают влияние на структуру и функцию сосудов микроциркуляции, питая эндотелиальные клетки капилляров; регуляция тонуса сосудистой стенки за счет серотонина, находящегося в гранулах тромбоцитов, и тромбоксана А2, образующегося из арахидоновой кислоты в процессе агрегации тромбоцитов. Тромбоциты обладают следующими свойствами: фагоцитоз; амебовидная подвижность; секреторная активность; адгезия (прилипание); агрегация (скучивание). Адгезия – это способность тромбоцитов прилипать к чужеродной поверхности, в частности к измененной сосудистой стенке. При соприкосновении с чужеродной поверхностью тромбоциты распластываются и выпускают псевдоподии. Агрегация – склеивание тромбоцитов друг с другом. Сначала развивается обратимая, а затем при появлении активного фермента тромбина агрегация становится необратимой. В тромбоцитах обнаружено много специфических соединений, участвующих в свертывании крови. Их называют тромбоцитарными (пластиночными) факторами и нумеруют арабскими цифрами. Наиболее важными являются фактор 3 – тромбоцитарный тромбопластин или тромбопластический фактор и фактор 6 – тромбостенин. Система гемостаза. Гемостаз – это процесс остановки кровотечения. Однако следует помнить, что в организме существует единая система, которая также поддерживает жидкое состояние крови и растворение тромба после прекращения кровотечения (фибринолиз), восстанавливая проходимость сосуда. Процесс гемостаза протекает в два этапа: сосудисто-тромбоцитарный (первичный) гемостаз; коагуляционный (вторичный). Первичный гемостаз Сосудисто-тромбоцитарный механизм гемостаза обеспечивает остановку кровотечения в мельчайших сосудах (сосудах микроциркуляторного русла), где имеется низкое кровяное давление и малый просвет сосудов. В них остановка кровотечения может произойти за счет: спазма сосудов; образования тромбоцитарной пробки агрегатами тромбоцитов; сочетания того и другого. В результате адгезии тромбоцитов к соединительно-тканным волокнам в области краев раны мембрана этих клеток становится более проницаемой, и из них выходят АТФ, АДФ и сосудосуживающие вещества (серотонин и катехоламины), а также тромбоцитарный фактов 3. В результате действия сосудосуживающих веществ, просвет сосудов уменьшается (возникает функциональная ишемия) и перекрывается тромбоцитами, прилипшими к коллагеновым волокнам. Выделившийся АДФ вызывает дальнейшую агрегацию тромбоцитов, ускоряя тем самым закупорку просвета сосудов. Агрегация тромбоцитов под действием АДФ носит обратимый характер. Тромбоцитарная пробка пропускает через себя плазму крови. Далее наступает необратимая агрегация тромбоцитов, при которой тромбоцитарная пробка становится непроницаемой для крови. Эта реакция возникает под влиянием тромбина, изменяющего структуру тромбоцитов. Далее из тромбоцитов выделяется фактор 6 – тромбостенин, под влиянием которого происходит сокращение (ретракция) тромбоцитарной пробки, образуется тромбоцитарный тромб. Он прочно закрывает просвет микрососуда и кровотечение останавливается. Вторичный гемостаз. Первичный гемостаз останавливает кровотечение в сосудах микроциркуляторного русла (где не высокое артериальное давление). Сосудисто-тромбоцитарные реакции начинают гемостаз и в крупных сосудах, но тромбоцитарные тромбы не выдерживают высокого давления и вымываются. В таких сосудах остановить кровотечение способен только фибриновый тромб - прочная пробка. В процесс гемостаза вовлечены 3 компонента: 1. стенка кровеносных сосудов, 2. форменные элементы крови; 3. плазменная ферментная система крови. Плазменные факторы свертывания крови. Обозначаются римскими цифрами в порядке хронологического открытия. В основном, факторы являются белками, многие из которых, ферментами. Большинство из них образуются в печени и в крови находятся в неактивном состоянии, активируясь в процессе свертывания. Фактор I – фибриноген. Фактор II - протромбин. Фактор III – тканевой тромбопластин. Фактор IV - ионы кальция. Фактор V - проакцелерин. Фактор VI – акцелерин. Фактор VII – конвертин. Фактор VIII – антигемофильный глобулин А. Фактор IX – фактор Кристмаса, антигемофильный глобулин В. Фактор X – Стюарта – Прауэра. Фактор XI – плазменный предшественник тромбопластина. Фактор XII – фактор Хагемана. Фактор XIII – фибринстабилизирующий. Плазминоген. Фактор Флетчера (прокалликреин). Фактор Фитцжеральда (кининоген). Основными плазменными факторами являются: I, II, IV. Дополнительные факторы (коферменты) – V и VIII. Факторы-ферменты: II, III, VII, IX-XIII. 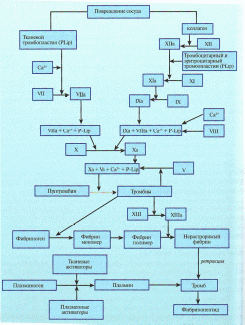 Рис. 8. Схема коагуляционного гемостаза и фибринолиза Процесс свертывания крови – это ферментативный, цепной (каскадный), матричный процесс перехода растворимого белка фибриногена в нерастворимый фибрин (рис. 8). Вторичный гемостаз осуществляется в 3 фазы: образование протромбиназы. Данный процесс может осуществляться по двум механизмам – внешнему, то есть протекать в тканях с образованием тканевой протромбиназы, и внутреннему - внутри сосуда с образованием кровяной протромбиназы. образование тромбина; превращение фибриногена в нерастворимое состояние - фибрин. Образование фибрина завершает образование кровяного тромба. После образования фибринового тромба через30-60 минут начинается его сокращение (ретракция). Ретракция происходит за счет сокращения нитей актина и миозина тромбоцитов, а также нитей фибрина под влиянием тромбина и ионов кальция. В результате ретракции сгусток сжимается в плотную массу, тромб уплотняется и стягивает края раны, что облегчает ее закрытие соединительнотканными клетками. Одновременно с ретракцией, но с меньшей скоростью начинается фибринолиз – расщепление фибрина, составляющего основу тромба. Важнейшая функция фибринолиза – восстановление просвета сосудов, закупоренных тромбами. Лизис сгустка крови осуществляется системой ферментов, активным компонентом которой являются плазмин, фибриноген, факторы свертывания крови V, VII, XII и протромбин. Фибринолиз протекает в 3 фазы: образование кровяного активатора плазминогена; превращение плазминогена в плазмин (фибринолизин); плазмин расщепляет фибрин до пептидов и аминокислот. Лизис кровяных сгустков продолжается в течение нескольких дней. Противосвертывающие механизмы. Сохранение жидкого состояния крови – главная функция системы гемокоагуляции. Жидкое состояние крови обеспечивается следующими механизмами: гладкой поверхностью эндотелия сосудов, препятствующей агрегации тромбоцитов; стенки сосудов и форменные элементы крови заряжены отрицательно, что способствует их отталкиванию друг от друга; большая скорость течения крови, что не позволяет концентрироваться факторам свертывания в одном месте; стенки сосудов покрыты слоем растворимого фибрина, который адсорбирует активные факторы свертывания; наличие в крови естественных антикоагулянтов. К естественным антикоагулянтам относятся: антитромбин III, гепарин, белки С и S, нити фибрина. Адгезии тромбоцитов к неповрежденной сосудистой стенке препятствуют эндотелиальные клетки; гепариновые соединения тучных клеток соединительной ткани; простациклин, синтезируемый эндотелиальными и гладкомышечными клетками сосуда; активированный эндотелием сосуда протеин С; антитромбин III, активированный гепариноподобными соединениями эндотелия; оксид азота. Ускорение свертывания крови называют гиперкоагулемией, а замедление – гипокоагулемией. Группы крови. Австрийский ученый К. Ландштейнер и чешский врач Я.Янский в 1901-1907 годах установили существование в эритроцитах людей особых антигенов – агглютиногенов и наличие в плазме крови соответствующих им антител – агглютининов. Это послужило основанием для выделения у людей групп крови. Групповую принадлежность крови обусловливают изоантигены. Главным носителем антигенных свойств являются эритроциты. У человека описано около 200 эритроцитарных изоантигенов. Они объединяются в групповые антигенные системы: АВ0, Rh-hr, Дафи, MNS, Диего, Келл и другие. Изоантигены передаются по наследству, постоянны в течение всей жизни, не изменяются под воздействием экзогенных и эндогенных факторов. В результате взаимодействия антигена с антителом происходит склеивание (агглютинация) антигенных частиц. Различают нормальные (полные) и ненормальные антитела. Нормальные антитела находятся в плазме крови людей и не связаны с иммунными антигенами. К ним относятся α - и β- агглютинины групповой антигенной системы АВ0. Неполные антитела образуются в ответ на введение антигена, например антирезус-агглютинины. Система АВО. Антигены (агглютиногены) А и В являются полисахаридами, они находятся в мембране эритроцитов и связаны с белками и липидами. Кроме указанных агглютиногенов в эритроцитах может содержаться антиген 0, у которого антигенные свойства выражены слабо и в крови нет одноименных ему агглютининов. Антитела (агглютинины) α и β находятся в плазме крови. Одноименные агглютиногены и агглютинины в крови одного и того же человека в естественных условиях не встречаются. Если же в эксперименте в пробирке смешать кровь с одноименными агглютиногенами и агглютининами, то произойдет реакция агглютинации. Она сопровождается склеиванием и разрушением (гемолизом) эритроцитов. Подобное состояние в организме протекает очень тяжело и получило название гемотрансфузионный шок. Он сопровождается тяжелыми клиническими проявлениями и может закончиться летально. Деление людей по группам крови в системе АВ0 основано на различных комбинциях агглютиногенов эритроцитов и агглютининов плазмы. В настоящее время по системе АВО выделяют 4 группы крови: I – (0), α и β; II - (А), β; III - (В), α ; IV - (АВ) 0. Таким образом, одновременно в крови не могут находиться одноименные агглютиногены и агглютинины (А и α), (В и β). Именно между ними и может происходить реакция агглютинации при переливаниях крови. Кроме этого, в эритроцитах обнаружены разновидности агглютиногенов А и В: агглютиногены А1-7 и В1-6. Указанные агглютиногены различаются по антигенным свойствам. Найдены также агглютинины α1 и α2, получившие название экстраагглютинины. Выявлено, что в крови людей различных групп могут находиться иммунные анти-А- и анти-В-антитела. Определение групп крови имеет практическое значение при переливании крови (гемотрансфузии). В настоящее время существуют единые правила для всех случаев переливания крови: переливать только одногруппную кровь по системе АВ0; нельзя переливать резус-положительную кровь (Rh+) резус-отрицательному (Rh-) реципиенту; в исключительных случаях допускается переливание крови другой группы, но не более 1/10 объема циркулирующий крови. При этом учитывают агглютиногены донора и агглютинины реципиента. Система резус (Rh-hr). Данная система открыта в 1941 году К.Ландштейнером и А.Винером при иммунизации кроликов кровью обезьян - макак-резусов. Антигены системы резус (Rh) являются липопротеидами. В настоящее время описано шесть разновидностей антигенов системы резус. Наиболее важными из них являются: D, C, E, обладающие наибольшей иммунногенной активностью. Среди них самым сильным является антиген D, который имеется в эритроцитах 85% людей независимо от их групповой принадлежности по системе АВ0. Кровь таких людей называется резус-положительной (Rh+). У остальных 15% людей антиген D отсутствует. Их кровь считается резус-отрицательной (Rh-). В отличии от системы АВ0, система резус не имеет врожденных антител: антирезус-антитела (антирезус-агглютинины) могут сформироваться только при переливании резус-отрицательному человеку резус-положительной крови, поэтому повторное переливание резус-положительной крови может вызвать гемоконфликт. Подобная же ситуация возникает, если резус-отрицательная женщина беременна резус-положительным плодом, наследующим резус-принадлежность от отца. Во время беременности небольшое количество крови плода (0,1-0,2 мл) может проникнуть через плацентарный барьер в кровь матери. Поступление эритроцитов плода в кровь матери может также произойти во время родов. В ответ на чужеродный антиген в организме матери начинают вырабатываться антирезус-агглютинины. При первой беременности резус-конфликт, как правило, не развивается, поскольку титр антител не велик. При повторной и последующих беременностях резус-положительным плодом, титр антител в крови у женщины увеличивается. Антирезус-агглютинины, из-за небольшой молекулярной массы, легко проникают через плацентарный барьер в организм плода, взаимодействуют с антигенами системы резус и вызывают агглютинацию и гемолиз его эритроцитов. В результате развивается выкидыш или гемолитическая болезнь новорожденных. Для предупреждения иммунизации резус - отрицательной беременной женщине вводят готовые концентрированные антирезус-агглютинины, которые агглютинируют резус-положительные эритроциты плода, поступающие в ее организм и иммунизации не наступает. УЧЕБНЫЕ ВОПРОСЫ Группы крови (система АВ0, резус-принадлежность, другие системы). Правила переливания крови. Кровезаменяющие растворы. Наследование групп крови. Тромбоциты, их строение, количество, функции. Процесс свертывания крови (А.А. Шмидт) и его значение. Современные представления об основных факторах, участвующих в свертывании крови (тканевые, плазменные, тромбоцитарные, эритроцитарные, лейкоцитарные). Фазы свертывания крови. Фибринолиз, этапы фибринолиза. Свертывающая, противосвертывающая и фибринолитическая системы крови как главные аппараты функциональной системы поддержания ее жидкого состояния. Факторы, ускоряющие и замедляющие свертывание крови. Регуляция гемостаза. САМОСТОЯТЕЛЬНАЯ РАБОТА Темы практических работ: Определение времени свертывания крови. Определение групп крови системы АВ0. Определение резус-принадлежности. Определение индивидуальной совместимости крови по системе АВ0. Работа 1. Определение времени свертывания крови. Метод свертывание крови in vitro является одним из широко применяемых в клинической практике. Однако позволяет выявить лишь грубый дефицит факторов свертывания (фибриногена, антигемофильных глобулинов, протромбина). Время свертывания крови зависит от используемого способа определения, поэтому в результате всегда необходимо указывать название метода. По Сухареву. (В норме начало свертывания 0,5-2 минуты, конец -3-5 минут.) Оснащение: сухой капилляр Панченкова, секундомер. Ход работы: уколите палец. Первую каплю удалите. В капилляр Панченкова наберите 25 мм крови. Включите секундомер. Путем наклона капилляра на 45о переведите взятую кровь на его середину. Затем каждые 30 секунд наклоняйте капилляр на 45о сначала в одну сторону, затем возвращайте капилляр в горизонтальное положение и через 30 секунд вновь наклоняйте его, но уже в другую сторону. Отметьте момент замедления движения крови или появления на стенке капилляра микросгустков. Окончание процесса свертывания регистрируйте в момент полного прекращения движения крови. По Альтгаузену. (В норме время свертывания 5-6 минут.) Оснащение: часовое стекло, секундомер, скарификатор. Ход работы: чистое и сухое часовое стекло согрейте на ладони до температуры тела. Нанесите на стекло 2-3 капли капиллярной крови. Включите секундомер. Через каждые 30 секунд проводите через кровь скарификатором до тех пор, пока не потянется первая нить фибрина. Зафиксируйте время. Оформление результатов работы: полученные результаты определения времени свертывания крови по обеим методикам занесите в тетрадь протоколов опытов, оцените их и сделайте вывод, сравнив с нормой. Работа 2. Определение групп крови системы АВ0. Для определения групп крови используют стандартные сыворотки, содержащие определенный титр агглютининов или цоликлоны. Использование стандартных сывороток. Оснащение: предметные стекла, вата, стандартные сыворотки крови групп 0(I), А(II) и В(III). Ход работы: предметное стекло поместите на белую бумагу и нанесите (не смешивая) по капле стандартной сыворотки 0(I), А(II) и В(III) групп. Возьмите другое предметное стекло, и первым его углом перенесите небольшое количество крови, полученной из пальца, в каплю сыворотки I группы, затем вторым углом стекла перенесите такое же количество крови в сыворотку II группы, третьим углом – в сыворотку III группы крови. При этом, каждый раз перемешивайте тщательно кровь в капле сыворотки, пока смесь не примет равномерно розовый цвет. Акция агглютинации наступает через 1-5 минут. При отсутствии агглютинации, капля остается равномерно окрашенной. При агглютинации капля состоит из комочков красного цвета, разделенных прозрачной смесью плазмы и стандартной сыворотки. Для исключения «холодовой агглютинации» к капле сыворотки с кровью прилейте каплю физиологического раствора комнатной температуры. Группу крови установите в зависимости от агглютинации (таб.3): 1. При отсутствии агглютинации со всеми тремя сыворотками, кровь принадлежит к 0(I) группе. 2. При агглютинации с сыворатками I и III групп, кровь принадлежит ко А(II) группе. 3. При агглютинации с сыворатками I и II групп, кровь принадлежит к В(III) группе. 4. При агглютинации с сыворатками I, II и III групп, кровь принадлежит к АВ((IV) группе. Таблица 3. Интерпретация результатов определения группы крови системы АВ0 с использованием стандартных сывороток.
Примечание: знаком «+» обозначено наличие агглютинации, знаком «-» - отсутствие агглютинации. Использование цоликлонов. Цоликлоны анти-А и анти-В предназначены для определения группы крови человека системы АВ0 вместо стандартных гемагглютинирующих сывороток. Моноклональные анти-А и анти-В антитела продуцируются двумя мышиными гибридомами и принадлежат к иммуноглобулинам класса М. Цоликлоны готовят из асцитной жидкости мышей-носителей анти-А и анти-В гибридом. Цоликлон анти-АВ представляет собой смесь моноклональных анти-А и анти-В антител. В отличии от сывороток, в цоликлонах наблюдается высокий титр антител. Время наступления реакции агглютинации и ее выраженность у цоликлонов выше, чем у гемагглютинирующих АВ0-сывороток. Оснащение: цоликлоны анти-А, анти-В, анти-АВ; пластина или планшет, пипетки, стеклянные палочки. Ход работы: нанесите на планшет или пластину индивидуальными пипетками цоликлоны анти-А, анти-В и анти-АВ по одной большой капле (0,1 мл) под соответствующими надписями. Рядом с каплями антител нанесите по одной маленькой капле (0,01 – 0,03 мл) исследуемой крови, смешайте кровь с реагентом. Наблюдайте за ходом реакции при периодическом покачивании пластины в течение 3 минут. Агглютинация эритроцитов с цоликлонами обычно наступает в первые 3-6 секунд, однако наблюдение следует вести 3 минуты. Результат реакции в каждой капле может быть положительным или отрицательным. Положительный результат выражается в агглютинации (склеивании) эритроцитов. При отрицательной реакции капля остается равномерно окрашенной в красный цвет, агглютинаты в ней не обнаруживаются. Интерпретация результатов реакции агглютинации исследуемой крови с цоликлонами представлена в таблице 4. Таблица 4. Интерпретация результатов определения группы крови системы АВ0 с использованием цоликлонов
Примечание: знаком «+» обозначено наличие агглютинации, знаком «-» - отсутствие агглютинации. Оформление результатов работы: опишите полученные результаты в тетради протоколов опытов. Рекомендуется сделать цветной рисунок, демонстрирующий агглютинацию эритроцитов в разных каплях сыворотки или цоликлона. Определите групповую принадлежность исследуемой крови и сделайте вывод, отразив значения определения группы крови системы АВ0 для клиники. Работа 3. Определение резус-принадлежности. Для определения резус-фактора в настоящее время используют стандартную сыворотку, содержащую определенный титр агглютининов или цоликлон анти-D. Использование стандартных сывороток. Оснащение: стандартная сыворотка анти-резус двух разных серий, пластина или планшет, пипетка, стеклянные палочки, изотонический раствор хлорида натрия. Ход работы: на пластину или планшет нанесите по капле антирезусной сыворотки двух разных серий. Стеклянными палочками смешайте небольшое количество крови с сывороткой в обоих рядах. Пластину периодически покачивайте в течение 3 минут, затем добавьте по одной капле изотонического раствора хлорида натрия и продолжайте наблюдение до истечения 5 минут. Реакция может быть положительной или отрицательной (см. работу 2). Если реакция положительная, то исследуемая кровь содержит резус-фактор, и ее называют резус-положительной. Отрицательная реакция свидетельствует о том, что исследуемая кровь является резус-отрицательной. Использование цоликлонов. Оснащение: цоликлон анти-D, пластина или планшет, пипетка, стеклянная палочка. Ход работы: на пластину или планшет нанесите большую каплю (около 0,1 мл) цоликлона анти-D, рядом поместите маленькую каплю (0,01-0,05 мл) исследуемой крови смешайте стеклянной палочкой. Реакция агглютинации начинается через 10-15 секунд, четко выраженная агглютинация наступает через 30-60 секунд. (Для сокращения времени начала реакции планшет можно предварительно подогреть до 37- 40о С.) Результаты реакции учитывайте через 3 минуты. Планшет после смешивания реагента с кровью рекомендуется покачивать не сразу, а через 20-30 секунд, для образования более полной крупнолепестковой агглютинации. Оформление результатов работы: опишите полученные результаты в тетради протоколов опытов. Рекомендуется сделать цветной рисунок, демонстрирующий агглютинацию эритроцитов в каплях сыворотки или цоликлоне. Определите резус-принадлежность исследуемой крови и сделайте вывод, отразив значения определения резус-фактора для клиники. Работа 4. Определение индивидуальной совместимости крови по системе АВ0. Гемотратсфузия – это серьезная операция по транплантации живой ткани человека. Перед переливанием крови помимо определения групповой и резус-принадлежности крови донора и реципиента определяют еще и их индивидуальную совместимость. Оснащение: микроцентрифуга с пробирками, предметное стекло, две глазные пипетки, стеклянная палочка, 5% раствор цитрата натрия, изотонический раствор хлорида натрия. Ход работы: кровь реципиента в количестве 1-2 мл поместите в центрифужную пробирку, добавьте одну каплю 5% цитрата натрия и центрифугируйте 10-15 минут, для отделения плазмы от форменных элементов. На предметное стекло поместите каплю плазмы реципиента, а рядом каплю крови донора в соотношении 10:1. Перемешайте капли стеклянной палочкой в течение 5 минут, после чего добавьте каплю изотонического раствора хлорида натрия. Оформление результатов работы: опишите полученные результаты в тетради протоколов опытов. Сделайте вывод о совместимости или несовместимости крови донора и реципиента и возможности переливания крови. VI. Примеры тестовых заданий для определения исходного уровня знаний по разделу «Физиология крови» | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
