фарм химия. Учебное пособие к лабораторным занятиям по фармацевтической химии для студентов специализации фармация
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
|
Тема 3. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Задание 1. Выполнить количественный анализ лекарственного средства – спирт этиловый Спирт этиловый: 45 %, 70 %, 95 % Spiritusaethylicus 45%, 70%, 95% Количественное определение методом рефрактометрии Рефрактометрический метод анализа основан на измерении показателей преломления растворов веществ. Метод рефрактометрии относится к экспресс-методам анализа. Простота и быстрота выполнения анализа, а также малые объемы растворов, затрачиваемые на одно определение (несколько капель), делают его незаменимым для внутриаптечного контроля экстемпоральных лекарственных препаратов. Приборы, применяемые для определения показателя преломления, называются рефрактометрами. Определение проводится при температуре 20+0,3°С и длине волны линии D спектра натрия 589,3 нм. Показатель преломления, определенный при таких условиях, обозначается индексом nD20. Диапазон измеряемых показателей преломления при измерении в проходящем свете 1,3-1,7. Точность измерения показателя преломления должна быть не ниже ±2*10" . Рефрактометры тестируют по эталонным жидкостям, прилагаемым к приборам, или дистиллированной воде, для которой nD = 1,3330. В водных растворах этилового спирта линейная зависимость показателя преломления и концентрации наблюдается в пределах до 50-60%. При установлении содержания спирта в более концентрированных растворах следует их предварительно разбавить и при расчетах концентрации учитывать разведение. При определении показателя преломления спиртово-водных растворов следует на призму рефрактометра наносить не менее 5-7 капель и измерять величину n немедленно во избежание ошибки, связанной с летучестью спирта. Исследование необходимо проводить при температуре 20°С. Если оно осуществляется при другой температуре, следует вносить поправку на температуру. Величины поправок показателя преломления на 1°С представлены в табл. 1. Если определение проводится при температуре выше 20°С, то поправку прибавляют к найденной величине показателя преломления; если анализ проводится при температуре ниже 20°С, поправку вычитают. Таблица 6 Показатели преломления спирто-водных растворов, концентрация которых выражена в об. %
Пример. Анализу подвергался 40%-ный раствор спирта, определение показателя преломления проводили при 23 °С. Показание рефрактометра — 1,3541. Согласно табл.1 поправка на 1°С для показателя преломления, близкого по величине к полученному (1,35500), равна 2,4-10-4 (т. е. 0,00024). Поскольку исследование проводилось при 23°С, то поправка будет составлять 0,00024-3 = 0,00072. Показатель преломления, приведенный к 20°С, равен 1,3541 + 0,00072 = 1,35482. По табл. 6 определяют соответствующую данному показателю преломления концентрацию спирта. Найденной величины показателя преломления (1,35482) в таблице нет; близкому по величине показателю преломления 1,35500 соответствует 40% спирта. Необходимо определить, какая концентрация спирта соответствует разности показателей преломления: 1,35500 - 1,35482 = 0,00018. Поправка на 1 % спирта равна 4,0-10-4. Следовательно, 0,00018/0,0004=0,45%. Таким образом, истинное содержание спирта в исследуемом растворе 39,55% (40 - 0,45). Для определения концентрации этилового спирта в 70%-ных спиртовых растворах разведение проводят обычно 1:2, а в 95%-ном спирте - 1:3. При этом необходимо учитывать, что при смешивании спирта с водой объем раствора несколько уменьшается, в связи с чем следует вносить поправку к фактору разведения: при смешивании 1 мл спирта с 2 мл воды — на 2,98 (вместо 3); при смешивании 1 мл спирта с 3 мл воды — на 3,93 (вместо 4). После соответствующего разведения определяют показатель преломления полученного раствора. Если необходимо, вносят поправку на температуру и находят концентрацию спирта в приготовленном растворе. Для установления крепости спирта в 70% и 95% растворе найденное значение концентрации умножают на коэффициент разведения. Задание 2. Выполнить качественный и количественный анализ лекарственной формы – раствор глюкозы Раствор глюкозы 5 % - 100 мл Solutioglucosi 5 % -100 ml 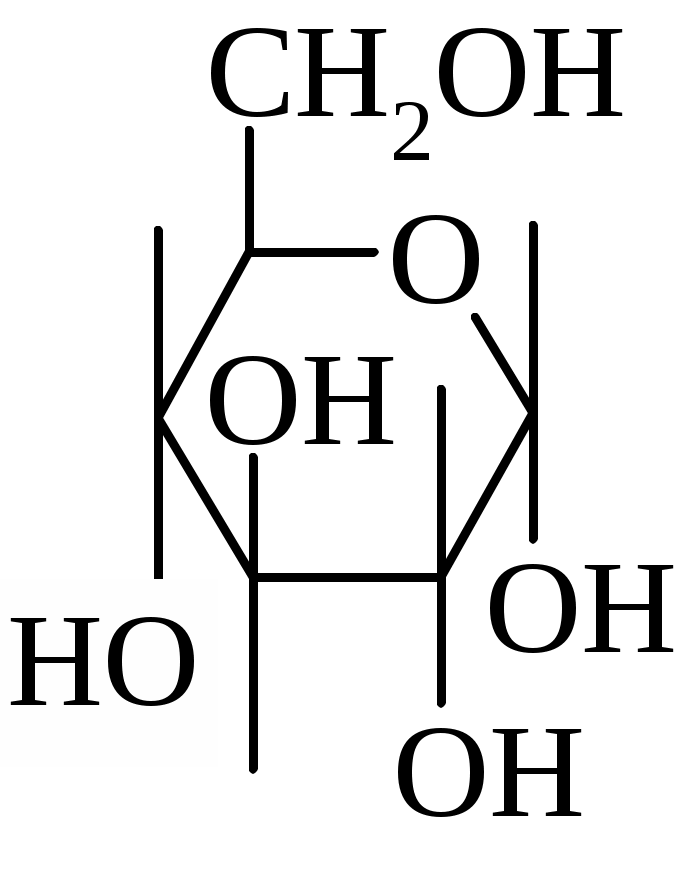 С6Н12О6 Подлинность (качественные реакции) 1. К 2 - 4 каплям раствора прибавляют 0,5 мл реактива Фелинга и нагревают; образуется кирпично-красный осадок. 2. 3 - 5 капель раствора выпаривают в фарфоровой чашке на водяной бане досуха. После охлаждения к остатку прибавляют 0,01 г тимола, 5 - 6 капель концентрированной кислоты серной и 1 - 2 капли воды; появляется фиолетовое окрашивание. Количественное определение 1 мл раствора разводят дистиллированной водой до объема 10 мл. К 2 мл полученного раствора, помещенного в пробирку, прибавляют 2 мл 0,1 н. раствора йода, 4 капли 10 % раствора натрия гидроксида, закрывают пробирку пробкой и реакционную смесь оставляют стоять в темном месте 5 мин. Далее прибавляют 0,5 мл разведенной кислоты хлороводородной и титруют выделившийся йод 0,1 н. раствором натрия тиосульфата. Параллельно проводят контрольный опыт. 1 мл 0,1 н. раствора йода соответствует 0,009906 г (водной) глюкозы или 0,009006 г (безводной) глюкозы. Количественное содержание глюкозы в растворе рассчитывают по формуле: x = (v0-v)· K ·t ·v1· ioo a·V2 а- аликвота препарата, взятая для определения , мл (1 мл ); Vi - объем раствора препарата первого разведения, мл (10 мл ); V2 - объем аликвотной части разведения , взятый для определения, мл (2 мл); V0 - объем стандартного раствора (Na2S203), пошедший на титрование раствора I2 в контрольном опыте, мл; V - объем стандартного раствора (Na2S203), пошедший на титрование избытка раствора I2, мл; К- поправочный коэффициент к титру стандартного раствора Na2S203; Т- титр титранта по определяемому веществу. Задание 3. Выполнить качественный и количественный анализ лекарственной формы - кислота глутаминовая Кислоты глутаминовой Acidiglutaminici Сахара по 0,2 Sacchariana 0,2 Подлинность (качественныереакции) Глутаминовая кислота 1. 0,03 г порошка растворяют при нагревании в 1 мл воды, прибавляют 3-5 капель 0,25% раствора нингидрина и нагревают; появляется сине-фиолетовое крашивание. 2. К 0,01 г порошка прибавляют 1-2 мл разведенной кислоты хлороводородной, несколько кристаллов резорцина и кипятят в течение 1 мин; появляется красное окрашивание. Количественное определение 0,05 г порошка растворяют при нагревании в 1-2 мл воды. К охлажденному раствору прибавляют 1-2 капли бромтимолового синего и титруют 0,1 н раствором натрия гидроксида до голубовато-зеленого окрашивания. 1 мл 0,1 н. раствора натрия гидроксида соответствует 0,01471 г кислоты глутаминовой. Расчет содержания кислоты глутаминовой (X, г) в порошке проводят по формуле: Х =V·K·T·b/ а, где V- объем стандартного раствора (0,1н. NaOH), пошедший на титрование, мл; а- масса навески порошка, взятой на определение (0,05г); b- средняя масса порошка, г ; К- поправочный коэффициент к концентрации титранта; Т- титр стандартного раствора по определяемому веществу. Задание 4. Провести фармакопейный анализ кислоты ацетилсалициловой в таблетках Таблетки кислоты ацетилсалициловой 0,25 г или 0,5 г TabulettaeAcidiacetylsalicylici 0,25 aut 0,5 Состав: Кислоты ацетилсалициловой - 0,25 г или 0,5 г Вспомогательных веществ - достаточное количество Описание Таблетки белого цвета, слабокислого вкуса. Подлинность 0,5 г порошка растертых таблеток кипятят в течение 3 минут с 5 мл раствора едкого натра, затем охлаждают и подкисляют разведенной серной кислотой; выделяется белый кристаллический осадок. Раствор сливают в другую пробирку и добавляют к нему 2 мл спирта и 2 мл концентрированной серной кислоты: раствор имеет запах уксусноэтилового эфира. К полученному осадку добавляют 1-2 капли раствора хлорида окисного железа: появляется фиолетовое окрашивание. 0,2 г препарата помещают в фарфоровую чашку, добавляют 0,5 мл концентрированной серной кислоты, перемешивают и добавляют 1-2 капли воды: ощущается запах уксусной кислоты. Затем добавляют 1-2 капли формалина: появляется розовое окрашивание. Количественное определение Около 0,3 г (точная навеска) порошка растертых таблеток взбалтывают с 10 мл нейтрализованного по фенолфталеину спирта в течение 10 минут. Затем жидкость охлаждают до 8-10 °С и титруют с тем же индикатором 0,1 н. раствором едкого натра до розового окрашивания. 1 мл 0,1 н. раствора едкого натра соответствует 0,01802 г С9Н804, которой соответственно должно быть 0,238-0,262 г или 0,475-0,525 г, считая на средний вес одной таблетки. Расчет содержания кислоты ацетилсалициловой (X, г) в таблетках проводят по формуле: V·K·T·b Х = а г, где V- объем раствора гидроксида натрия (0,1 М ), пошедший на титрование, мл; а- навеска порошка растертых таблеток, взятая для анализа (0,3 г); b - средняя масса одной таблетки в граммах, определенная по методике ГФ XI, ч. II, С. 156; К- поправочный коэффициент к концентрации титранта; Т- титр стандартного раствора по определяемому веществу; Задание 5. Провести качественный и количественный анализ лекарственной формы – раствора сульфацила. Раствор сульфацила - натрия 20% - 10,0 SolutioSulfacyli - natrii 20% - 10,0 Подлинность (качественные реакции) 1. Сулъфацил. К 2 -3 каплям лекарственной формы прибавляют 5 - 6 капель разведенной соляной кислоты, 2 -3 капли 1%-ного раствора нитрита натрия. Полученную смесь вливают в 1-2 мл щелочного раствора β-нафтола. Появляется вишнево-красное окрашивание. 2. Сулъфацил. К 2-4 каплям лекарственной формы прибавляют 2-3 капли раствора сульфата меди. Образуется голубовато-зеленый осадок. 3. Натрий -ион. Графитовую палочку, смоченную исследуемым раствором, вносят в пламя горелки. Пламя окрашивается в желтый цвет. Количественное определение 1. Метод нейтрализации. Разводят 1 мл лекарственной формы в мерном цилиндре водой до 10 мл (раствор 1). К 1 мл полученного раствора 1 прибавляют 2 капли раствора метилового оранжевого, 1 каплю раствора метиленового синего и титруют 0,1 н. раствором соляной кислоты до фиолетового окрашивания. 1 мл 0,1 н. раствора соляной кислоты соответствует 0,02542 г сульфацила-натрия. Расчет содержания сульфацила-натрия (Х,%) в лекарственной форме проводят по формуле: V·K·T·V2·100 X = a·V1 % , где V- объем стандартного раствора (0,1М НС1), пошедший на титрование, мл; V1 объем лекарственной формы, взятой для анализа (1 мл ); V2- объем раствора, полученный при первом разведении (10 мл ); а- аликвота разведенного раствора, отобранная для титрования (1 мл); К- поправочный коэффициент к концентрации стандартного раствора; Т - титр стандартного раствора по определяемому веществу ( 0,02542 г/мл ) Задание 6. Провести качественный и количественный анализ лекарственной формы – раствор новокаина Растворы новокаина: 0,25%;0,5%;1%;2% - 100 мл. SolutioNovocaini: 0,25%;0,5%;1%;2% -100 ml Подлинность (качественные реакции) Новокаин. К 3-4 каплям исследуемого раствора прибавляют 1 каплю разведенной соляной кислоты, 1 каплю 0,1 М раствора нитрита натрия, 0,5 мл щелочного раствора β-нафтола - появляется вишнево-красное окрашивание. Реакция на хлорид-анион. С раствором нитрата серебра образует белый творожистый осадок. Количественное определение. К 0,5-2 мл исследуемого раствора (в зависимости от концентрации раствора - см. таблицу) прибавляют 2 капли раствора бромфенолового синего и по каплям - разведенную уксусную кислоту, пока фиолетовое окрашивание не перейдет в зеленовато-желтое. Титруют 0,02 н. или 0,1 н. раствором нитрата серебра до фиолетового окрашивания. 1 мл 0,02 н. раствора нитрата серебра соответствует 0,005454 г новокаина.. 1 мл 0,1 н. раствора нитрата серебра соответствует 0,02727 г новокаина. Таблица 7
СОДЕРЖАНИЕВВЕДЕНИЕ……………………………………………………………….3 ПРАВИЛА ПО ТЕХНИКЕ БЕЗОПАСНОСТИ…………………………4 ИЗУЧЕНИЕ ФИЗИЧЕСКИХ И ФИЗИКО-ХИМИЧЕСКИХМЕТОДОВ ОПРЕДЕЛЕНИЯ ПОДЛИННОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ…………………………………………………………………6 АНАЛИЗ ОРГАНИЧЕСКИХ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПО ФУНКЦИОНАЛЬНЫМ ГРУППАМ………………………………11 КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ…………..37 СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ Беликов В.Г. Фармацевтическая химия. В 2 ч. Учеб. Для вузов. – Пятигорск, 2003. – 720 с. Государственная фармакопея СССР. Общие методы анализа. – 11-е изд. Доп. / МЗ СССР. - Вып. 1. – М: Медицина, 1987. – 336 с. Руководство к лабораторным занятиям по фармацевтической химии : Учеб. пособие / Аксёнова Э.Н., Андрианова О.П., Арзамасцев А.П, и др. / Под ред. А.П. Арзамасцева. – 3-е изд., перераб. И доп.. – М: Медицина, 2001. – 384 с. Глущенко Н.Н. Фармацевтическая химия. - -М: Академия, 2004, 384 с. Максютина Н.Т. Методы анализа лекарств. – Киев: Здоровье, 1989. – 382 с. Мелентьева Г.А. Фармацевтическая химия. – М: Высшая школа. – М: Медицина, 1993. – 576 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
