Курсовая работа Производство дивинила. ДИВИНИЛ 3 вариант. Производство дивинила
 Скачать 487.42 Kb. Скачать 487.42 Kb.
|
|
Министерство образования и науки Российской Федерации Российский технологический университет -МИРЭА Институт тонких химических технологий им. М.В. Ломоносова Кафедра общей химической технологии Курсовая работа на тему: «Производство дивинила» Вариант №2 Подготовила: студентка группа Преподаватель: Г. Москва, 2020 Содержание: 1.Введение…………………………………………………………………….…..3 2.Характеристика исходного сырья……………………………………………..5 3.Характеристики целевого продукта…………………………………………...8 4.Физико-химические основы процесса…………………………….….............11 5.Термодинамический анализ процесса ………………………………….……16 6.Кинетический анализ процесса …....……………………...……….…………18 7.Механизм процесса……………….…………………………………..….……19 8.Выбор оптимальных условий ………………………………………….…….20 9.Описание технологической схемы …………………………………….…….21 10.Расчет материального баланса ……………………………………….……..23 11.Список использованной литературы………………………………….…….27 Введение Задача данной работы – провести качественный и количественный анализ химико-технологической системы производства дивинила (1,3-бутадиена). Для выполнения поставленной задачи необходимо изучить литературные и справочные данные, а также провести расчет материального баланса этого процесса. Дивинил, впервые полученный Кавенту в 1863 году, до сих пор продолжает привлекать внимание химиков. После установления С. В. Лебедевым способности дивинила образовывать каучукоподобные полимеры, а затем разработки им промышленного способа получения этого ценного мономера из спирта, интерес к дивинилу возрос еще больше. Впервые процесс получения бутадиена из этилового спирта был разработан С.В. Лебедевым (СССР). Впоследствии он получил развитие в США. Процесс производства бутадиена по реакции ацетилена с формальдегидом (способ Реппе) впервые был реализован в Германии. Затем были разработаны процессы получения бутадиена через альдольную конденсацию ацетальдегида (Германия) и дегидратацией и дегидрированием этанола (Советский Союз, США). В настоящее время одним из основных технических способов производства бутадиена-1,3 является дегидрирование н-бутана или н-бутилена. Огромные количества бутана, получаемого при прямой перегонке и крекинге нефти, а также при стабилизации газового бензина, представляют собой практически неограниченные ресурсы сырья для промышленности синтетического каучука. Технологический процесс дегидрирования бутана или бутиленов освоен в крупных промышленных масштабах. Бутадиен является основным мономером, применяемым в современном промышленном производстве синтетических каучуков. На бутадиене базируется производство подавляющего большинства синтетических каучуков общего назначения: стереорегулярные 1,4-цис-бутадиеновые, бутадиен-стирольные, бутадиен-метилстирольные, ряд синтетических каучуков специального назначения - бутадиен-нитрильные, бутадиен- метилвинилпиридиновые и др. Помимо производства синтетических каучуков, бутадиен применяется в промышленном масштабе для производства синтетических смол, адиподинитрила (в производстве полиамидов) и себациновой кислоты. Дивинил имеет важное значение не только как мономер для получения синтетических каучуков, но и как полупродукт в производстве синтетических волокон, в частности—нейлона. 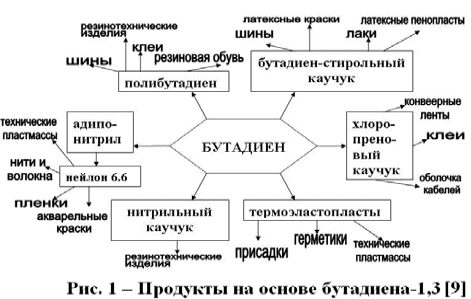 Рис.1. Области применения бутадиена-1,3 Мировое потребление бутадиен-стирольных каучуков в 2014 году составило 5 млн тонн, бутадиеновых каучуков – 3,1 млн тонн, АБС-пластиков – 6,9 млн тонн. Шинная и автомобилестроительная промышленности потребляют суммарно до 75% производных бутадиена, являясь основным конечным потребителем бутадиена. Поэтому прогресс в развитии мирового производства бутадиена в целом будет определяться прогрессом в автомобильной промышленности, в первую очередь в азиатских странах. Интенсивное развитие мировых мощностей по производству бутадиена прогнозируется вплоть до 2017 года. В последующие годы ожидается незначительный дальнейший рост мировых мощностей бутадиена. Объем мировых мощностей бутадиена в 2018 году прогнозируется на уровне 16,32 млн тонн в год. Характеристика исходного сырья Сырье для процесса одностадийного дегидрирования н-бутана — смесь исходного н-бутана и возвратной бутан-бутеновой фракции. Бутан Б 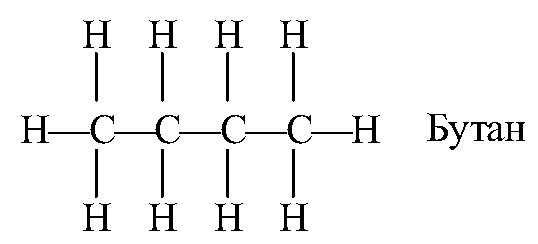 ута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76. ута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76.2.1.1.Физические свойства бутана Бутан представляет собой бесцветный и легковоспламеняемый газ. При нормальном давлении и температуре ниже 0 °C легко сжижается. При повышении давления и обычной температуре — легколетучая жидкость. Растворимость в воде бутана составляет 6,1 мг на 100 миллилитров воды. Бутан при давлении 10 атмосфер и температуре 100 °C может образовывать азеотропную смесь с водой. Молярная масса — 58,12 г/моль; Температура кипения 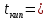 -0,5°С; -0,5°С;Температура самовоспламенения 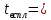 372°С; 372°С;Пределы взрываемости — 1,6±0,1 об.%; Плотность жидкой фазы — 0,580 г/см³; Плотность газовой фазы при нормальных условиях — 0,0027 г/см³; Теплота сгорания — 45,8 МДж/кг (2657 МДж/моль). 2.1.2.Химические свойства бутана Бутан, как и любой алкан – химически инертное соединение, не реагирует с концентрированной серной и азотной кислотой, с концентрированной щелочью, с перманганатом калия. Бутан не склонны к реакциях разрыва связи (реакция присоединения), для него свойственны реакции радикального замещения (галогенирование, нитрование, сульфирование). При определенных условиях ( AlCl3, 100°С) может изомеризоваться с образованием изо-бутана. В различных условиях и при разных катализаторах окисление бутана может привести к образованию бутанола, бутаналя и масляной кислоты. В условиях полного окисления реакция протекает до конца – до образования воды и углекислого газа. 2.1.3. Получение н-бутана Содержится в газовом конденсате и нефтяном газе (до 12 %). Является продуктом каталитического и гидрокаталитического крекинга нефтяных фракций. 2.1.4. Очистка н-бутана В качестве сырья для получения н-бутиленов используют бутановую фракцию, выделяемую из газов нефтепереработки или из попутных газов. Бутановую фракцию предварительно очищают от сернистых соединений, а также от изобутана и пентанов. Эти углеводороды выделяют ректификацией. Кроме того, бутан подвергают осушке твердыми поглотителями (прокаленный хлористый кальций, боксит, силикагель, цеолиты) до содержания влаги не более 0,1 вес.%, так как используемый в процессе окисный алюмо-хромовый катализатор чувствителен к парам воды.    Бутилены 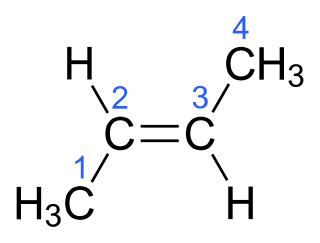 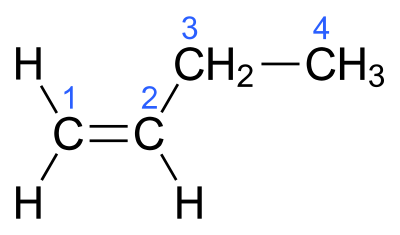 Бутен-1 (бутилен-1, Бутен-2 (бутилен-2, α-бутилен) β-бутилен) Бутилены – промежуточные продукты дегидрирования н-бутана, при дальнейшем дегидрировании образуют дивинил. Поэтому целесообразно возвращать смесь бутиленов с непрореагировавшим бутаном обратно в реактор. 2.2.1.Физические свойства бутенов Бутиле́ны (буте́н) C4H8 — непредельные углеводород, наркотик, раздражающий верхние дыхательные пути. Класс опасности — четвёртый. При обычных условиях бесцветный газ с характерным запахом. Мало растворимы в воде, хорошо растворяются в органических растворителях. Молярная масса — 56,11 г/моль. Остальные параметры приведены в Табл.1.
Характеристика целевого продукта Б 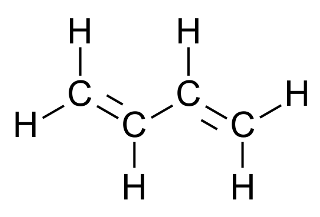 утадие́н-1,3 (дивинил) СН2=СН—СН=СН2 — ненасыщенный углеводород, простейший представитель сопряжённых диеновых углеводородов. Молекулы 1,3-бутадиена могут находиться в s-цис- и s-транс-конформациях, причём последняя является преобладающей (93-97 %): утадие́н-1,3 (дивинил) СН2=СН—СН=СН2 — ненасыщенный углеводород, простейший представитель сопряжённых диеновых углеводородов. Молекулы 1,3-бутадиена могут находиться в s-цис- и s-транс-конформациях, причём последняя является преобладающей (93-97 %):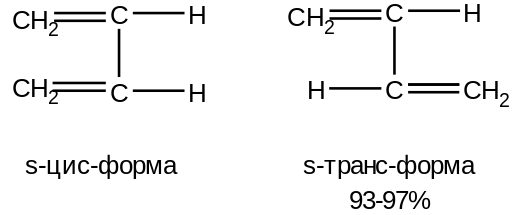 3.1.Физические свойства бутадиена Бутадиен-1,3, или дивинил, при обычных условиях представляет собой бесцветный газ, конденсирующийся в жидкость при -4,3°С. Малорастворим в воде, хорошо растворим в бензоле, диэтиловом эфире, плохо растворим в метаноле и этаноле. Молярная масса — 54,09 г/моль; Температура кипения 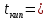 -4,5°С; -4,5°С;Температура вспышки 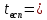 -40°С; -40°С;Взрывоопасные смеси с воздухом — 1,6-10,8 об.%; Плотность жидкой фазы — 0,650 г/см³; Плотность газа по воздуху — 1,877. 3.2.Химические свойства бутадиена 1,3-Бутадиен является типичным бутадиеновым углеводородом и обладает высокой реакционной способностью. Он легко вступает в реакции полимеризации, в том числе с другими непредельными соединениями (стиролом, эфирами и нитрилами акриловой и метакриловой кислот, изопреном, изобутиленом и др.). 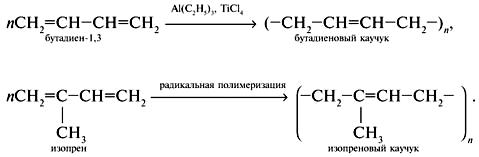 По двойной связи бутадиен присоединяет молекулы водорода, галогенов и галогеноводородов. 3.3.Требования и нормы к физико-химическим показателям получаемого 1,3-бутадиена (ГОСТ Р 55066 – 2012):  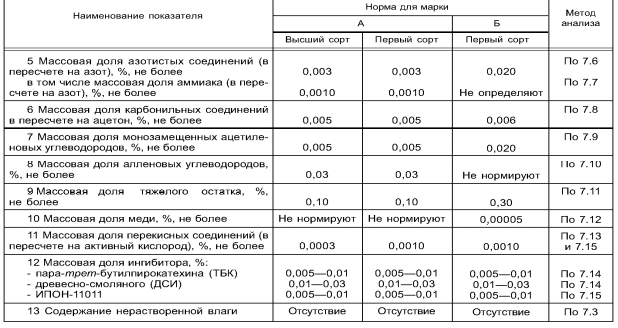 Таблица 2. Физико-химические показатели. Марка А – для производства синтетических каучуков методом стереоспецифической полимеризации, синтетических каучуков и латексов методом эмульсионной полимеризации, хлоропрена; Марка Б – для производства хлоропрена, синтетических каучуков и латексов методом эмульсионной полимеризации. Физико-химическое обоснование основных процессов производства целевого продукта и экологической безопасности производства Промышленные способы получения дивинила по исходному сырью можно разделить на следующие группы: получение из этилового спирта; получение из бутана и бутиленов; получение из ацетилена 4.1.Получение дивинила по Лебедеву Впервые промышленное производство бутадиена было осуществлено из этилового спирта в СССР в 1933 г. по разработанному С. В. Лебедевым методу. В основе процесса лежат превращения этанола в присутствии бифункционального катализатора, обеспечивающего одновременное протекание реакций дегидрирования (ZnO) и дегидратации (А12О3, промотированный К2О), при температуре не выше 400 0С: 2С2Н5ОН → СН2=СН-СН=СН2 + 2Н2О + Н2 В настоящее время этот метод практически полностью вытеснен одно- или двухстадийным дегидрированием насыщенных углеводородов. Большое значение имеют способы получения дивинила из бутана и бутиленов. Сущность получения дивинила из бутана заключается в каталитическом дегидрировании последнего. Процесс дегидрирования бутана может быть осуществлен в одну или две стадии. 4.2.Одностадийное дегидрирование н-бутана Одностадийный процесс дегидрирования н-бутана до бутадиена-1,3 может быть описан суммарным уравнением: С4Н10 ↔ С4Н6 + 2Н2 + 247 кДж и складывается из двух последовательных реакций дегидрирования н-бутана до н-бутиленов и н-бутиленов до бутадиена-1,3. В этом процессе н-бутилены не выводятся из сферы реакции и в реакторе создается система «н-бутан — н-бутилены — бутадиен-1,3 — водород», равновесный состав которой зависит от температуры и давления. Одностадийный процесс дегидрирования н-бутана осуществляется по регенеративному принципу, при котором затраты тепла на проведение эндотермической реакции дегидрирования в адиабатическом режиме возмещаются за счет тепла, выделяющегося на стадии регенерации катализатора при выжигании отложившегося на нем кокса. В этом процессе разогретый регенерированный катализатор используется как теплоноситель, а для повышения его способности аккумулировать тепло, к нему добавляется в отношении 1:3 инертный теплоноситель в виде гранул оксида алюминия, предварительно обожженных. Жесткие условия чередующихся окислительно-восстановительных циклов дегидрирования и регенерации предъявляют к катализаторам повышенные требования. В одностадийном процессе используется алюмо-хромовый оксидный катализатор состава Сг2О3∙Al2O3, активный при температуре около 600 °С, ускоряющий реакции дегидрирования, прочный и устойчивый в эксплуатации и хорошо регенерирующийся. Так как он отравляется парами воды, то понижение парциального давления углеводородного сырья в процессе достигается не введением в систему водяного пара, а проведением дегидрирования в вакууме. 4.3.Двухстадийное дегидрирования н-бутана Большинство промышленных установок получения дивинила из н-бутана работает по двухстадийной схеме. Первая стадия дегидрирования бутана заключается в превращении его в бутилен, а вторая - это процесс получения дивинила из бутилена. Дегидрирование бутана в бутилен на хромооксидном катализаторе, нанесенном на оксид алюминия, протекает по реакции С4Н10 → С4Н8+Н2; ∆Н= 131 кДж В промышленных реакторах протекают и побочные реакции: обратная реакция гидрирования бутилена, крекинг бутана и бутилена, изомеризация бутана и бутилена, реакции углеобразования. На советских промышленных установках по дегидрированию бутана применяют системы с кипящим слоем мелкозернистого алюмохромового катализатора. В процессе дегидрирования бутана катализатор покрывается углеродистыми отложениями и изменяет свой химический состав. Активность катализатора при этом резко снижается. С целью реактивации катализатор непрерывно отводят из реактора и обжигают в токе воздуха в регенераторе с кипящим слоем. Углеродистые соединения при этом выгорают, а низшие оксиды хрома окисляются до Сг2О3. Дегидрирование бутилена до дивинила протекает на хром-кальций-фосфатном катализаторе по реакции С4Н8 → С4Н6 + Н2; ∆Н= 119 кДж Бутадиен при повышенных температурах разлагается, поэтому для сохранения достаточно высокой селективности по бутадиену на практике приходится прибегать к снижению парциального давления реакционных газов за счет применения перегретого водяного пара или вакуума. Использование двухстадийного процесса позволяет создать на каждой стадии оптимальные условия ее протекания, обеспечивающие максимальный выход продуктов и селективность. Выход бутадиена от массы исходного бутена составляет 20— 35 %. Селективность колеблется от 73 до 94 %. 4.4.Производство из ацетилена 1) Возможны синтезы дивинила на базе ацетилена, если последний получать из природных или нефтяных газов. Подобные синтезы целесообразны и в странах, не имеющих нефти, но обладающих запасами каменного угля или дешевой электроэнергией для выработки карбидного ацетилена. 2) Конденсацией ацетилена с формальдегидом, по методу Реппе, можно получить бутиндиол, гидрируя который получают бутиленгликоль и затем дивинил. Этот процесс также является многостадийным и менее экономичным по сравнению с другими методами. 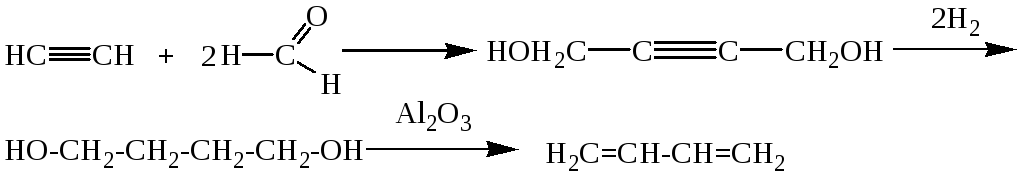 4.5.Способ И.И. Остромысленского Способ получения бутадиена, предложенный русским химиком И.И. Остромысленским еще в 1915 г., был реализован в США в годы Второй мировой войны. В отличие от способа С.В. Лебедева этот процесс протекает в две стадии. На первой стадии дегидрированием этанола получают ацетальдегид: С2Н5ОН → СН3СНО + Н2 На второй стадии смесь спирта и ацетальдегида в мольном соотношении 3:1 пропускают над катализатором (оксид тантала на силикагеле): СН3СНО + С2Н5ОН → СН2 =СН-СН=СН2 + 2 Н2О Селективность процесса – 63,9%. По этой технологии дегидрирование осуществляют при 523-573 К. В качестве катализатора используют медь, нанесенную на асбестовое волокно. В качестве промоторов к катализатору добавляют 5 % оксида кобальта и 2% оксида хрома (в расчете на медь). Выход ацетальдегида на пропущенный этанол составляет 30-40% при селективности 92%. Основными побочными продуктами являются масляный альдегид, этилацетат и уксусная кислота. Вторая стадия получения бутадиена по этому способу представляет собой совместное превращение этанола и ацетальдегида в присутствии в качестве катализатора оксида тантала, нанесенного на силикагель, при 603-623 К и атмосферном давлении. Синтез бутадиена протекает через стадию образования кротонового альдегида: 2CH3-CHO → CH3-CH=CH-CHO + H2O CH3-CH=CH-CHO + CH3-CH2OH → CH2=CH-CH=CH2 + CH3CHO + H2O В годы Второй мировой войны по методу Остромысленского в США выпускалось около 60% всего бутадиена, использованного для производства синтетического каучука. После 1952 г. все заводы, использовавшие этот процесс, были закрыты из-за их нерентабельности. 4.6.Сравнительная характеристика Сопоставление технико-экономических данных показывает, что одностадийный процесс экономичнее, чем двухстадийный из-за отсутствия в нем промежуточной подсистемы разделения контактного газа после первой ступени и меньшей величины расходных коэффициентов по сырью и энергии. Таблица 3. ТЭП производства бутадиена-1,3.
Достоинствами одностадийного процесса дегидрирования н-бутана до бутадиена-1,3 являются: значительное сокращение расхода технологического пара; использование теплоты регенерации катализатора и проведение реакции дегидрирования в адиабатическом режиме и, как следствие, простота конструкции реактора и отсутствие сложного теплообменного оборудования; исключение второй стадии дегидрирования и операций разделения бутан-бутиленой фракции. За счет этого относительно невысокие выход бутадиена-1,3 (12—14%) и степень конверсии н-бутана (не превышающая 0,2) компенсируются меньшими капитальными затратами и энергоемкостью производства и, как следствие, более низкой, чем при двухстадийном методе, себестоимостью бутадиена-1,3. 4.7.Экологическая безопасность производства Главным признаком правильного и полного решения при разработке любого технологического процесса является не только эффективное и комплексное использование исходного сырья, но и устранение всяких отходов производства, примесей в отходящих газах и промышленных сточных водах. В настоящее время также определены экологические требования к продукции: экологические требования к продукции производства должны обеспечивать соблюдения нормативов ПДК на окружающую природную среду в процессе производства, хранения и транспортировки продукции. Бутадиен-1,3 в малых концентрациях раздражает слизистые оболочки носа, вызывает функциональные нарушения центральной нервной системы. Помещение в производстве бутадиена-1,3 оборудовано системой контроля и управления составом воздуха, а также пожарной сигнализацией. Технологические установки вынесены на открытые продуваемые и доступные для транспортных средств площадки. Для исключения опасных ситуаций на производстве, разработаны и строго выполняются в соответствии с Правилами Гостехнадзора требования к конструкции, изготовлению и монтажу аппаратов и уровню подготовки обслуживающего персонала. Главным же является обеспечение обслуживающего персонала спецодеждой и противогазами. |
