Курсовая работа Производство дивинила. ДИВИНИЛ 3 вариант. Производство дивинила
 Скачать 487.42 Kb. Скачать 487.42 Kb.
|
|
Термодинамический анализ процесса Характерной особенностью реакций дегидрирования с образованием олефинов является ограничение степени превращения условиями равновесия. Реакции дегидрирования всегда являются эндотермическими и, следовательно, равновесие в сторону образования ненасыщенных углеводородов должно сдвигаться с повышением температуры. Степень превращения углеводородов возрастает с повышением температуры и понижением давления. На практике при температурах выше 773-823К даже в отсутствие катализаторов предельные углеводороды претерпевают реакции изомеризации, крекинга и др. Поэтому процесс дегидрирования бутана проводят при температурах до 923-973 К, т.е. при температурах более низких, чем термодинамические оптимальные. Применение катализаторов позволяет достигнуть высокой скорости процесса при относительно низкой температуре, когда еще не существенен вклад побочных реакций. Ввиду обратимости реакций дегидрирования – гидрирования и, следовательно, способности катализаторов ускорять обратимые реакции в обоих направлениях, эти реакции катализируются одними и теми же соединениями. При дегидрировании вследствие отщепления водорода всегда происходит увеличение объема газа, и понижение давления благоприятствует повышению степени конверсии. По этой причине процессы дегидрирования проводят при давлении, близком к атмосферному, а в некоторых случаях процесс осуществляют в вакууме. Дегидрирование н-бутана до бутадиена-1,3 представляет собой обратимый гетерогенно-каталитический процесс, протекающий с поглощением тепла через стадию образования изомеров бутилена по реакции: 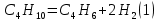 А также протекают побочные реакции, среди которых наибольшее значение имеют реакции распада и гидрирования:  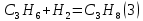  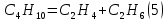 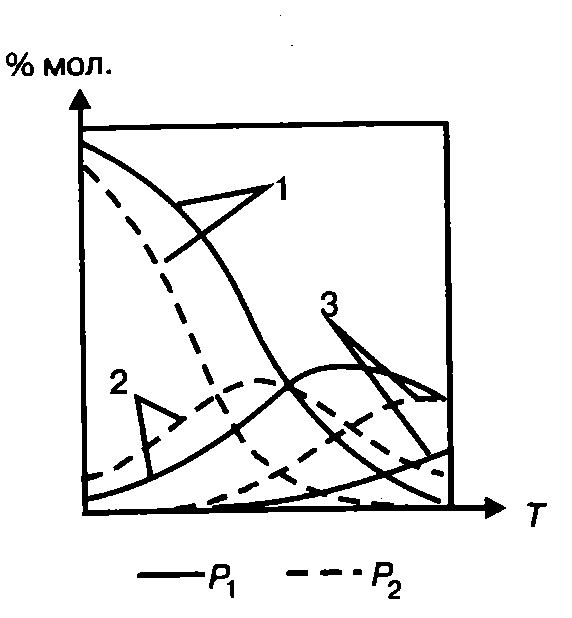 Равновесный состав данной газовой смеси зависит от температуры и давления. Из рисунка следует, что при повышении температуры равновесная концентрация н-бутана (кривая 1) резко падает, равновесная концентрация н-бутиленов (кривая 2) проходит через максимум, а содержание бутадиена-1,3 в смеси увеличивается.  Рис. 2 - Зависимость состава равновесной смеси от температуры и давления. Р1=0,1 МПа Р2=0,01 МПа. 1 – бутан; 2 –бутены; 3 – бутадиен. Таким образом, руководствуясь принципом Ле-Шателье, можно сделать вывод , что, поскольку процесс эндотермический, равновесный выход диена существенно возрастает с повышением температуры. Однако повышение температуры связано с увеличением вероятности протекания побочных реакций, а именно реакций распада, поэтому одностадийное получение дивинила из н-бутана реализуется в условиях пониженного давления. Кинетический анализ процесса 6.1. Катализатор Процесс дегидрирования осуществляется в присутствии катализатора. В качестве катализатора при одностадийном дегидрировании н-бутана применяют алюмо-хромовый окисный катализатор ДВ-3М состава Сг2О3∙А12Оз, активный при температуре около 600°С, ускоряющий обе реакции дегидрирования, прочный и устойчивый в эксплуатации и хорошо регенерирующийся. Активный катализатор получают пропиткой активной окиси алюминия водным раствором хромового ангидрида, после чего катализатор сушат и прокаливают в паро-воздушной среде. В исходных материалах для приготовления катализатора не должно содержаться окислов железа и кремния, так как в условиях этого процесса они способствуют расщеплению связи С – С. Активность катализатора под действием водяных паров понижается, поэтому реагирующие газы водяным паром не разбавляют, а для снижения парциального давления углеводородов проводят дегидрирование на неподвижном катализаторе при остаточном давлении 100 – 150 мм.рт.ст. Высокие температуры синтеза и повышенная реакционная способность продуктов приводят к его быстрому закоксовыванию. В результате катализатор работает на дегидрирование только 15—20 мин, затем реактор переключается на регенерацию. Регенерация осуществляется с помощью выжигания кокса воздухом и длится 30 мин. Поэтому процесс дегидрирования н-бутана выгодно проводить по регенеративному принципу, при котором затраты тепла на проведение эндотермической реакции дегидрирования в адиабатическом режиме возмещаются за счет тепла, уделяющегося на стадии регенерации катализатора при выжигании отложившегося на нем кокса. В этом процессе разогретый регенерированный катализатор используется как теплоноситель, а для повышения его способности аккумулировать тепло, к нему добавляется в отношении 1 : 3 инертный теплоноситель в виде гранул оксида алюминия, предварительно обожженных. 6.2.Время контактирования Большое значение имеет время контакта (в, к.), так как при очень малом в. к. часть бутана проскакивает неразложенной, при большом же з. к. (выше оптимального) усиливаются вторичные реакции разложения. 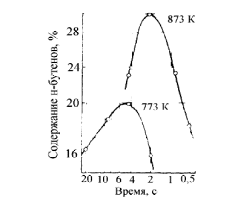 С повышением температуры оптимальное время контактирования, необходимое для превращения н-бутана в н-бутилены, уменьшается и при температурах 550-570 °С на промышленных алюмохромовых катализаторах равно примерно 2 с. Рис. 3 - Зависимость содержания н-бутенов при каталитическом дегидрировании н-бутана от температуры и времени реакции Механизм процесса Механизм процесса дегидрирования н-бутана на алюмохромовом катализаторе до конца не раскрыт. Согласно представлениям Любарского, он основан на взаимодействии бутана с активными центрами катализатора, а именно ионами металла, находящимися на поверхности катализатора. Дегидрирование идет через элементарные стадии образования и разрушения поверхностного радикала. Пусть k – это активный центр, тогда механизм можно представить: C4H10 + 2K → C4H9…K + K…H C4H9…K → C4H8 + K…H 2K…H → 2K+H2 C4H8 + 2K → C4H7…K + K…H C4H7…K → C4H6 + K…H 2K…H → 2K + H2 Механизм дегидрирования н-бутана на алюмохромовом катализаторе Выбор оптимальных условий процесса Рассмотренные выше физико-химические характеристики процесса вызывают необходимость при разработке технологической схемы учитывать следующие положения: организация технологической схемы по принципу многократной рециркуляции непрореагировавшего сырья; исходное сырье должно содержать минимальное количество примесей (особенно инертных примесей); процесс эндотермический, однако температура не должна быть слишком высокой, чтобы не увеличивалась вероятность протекания побочных реакций; так как реакция идет с выделением газа, эффективнее вести её при пониженном давлении (что так же позволит снизить температуру процесса); катализатор быстро загрязняется коксом, поэтому необходима постоянная регенерация катализатора путем выжигания кокса, что позволяет использовать регенерированный катализатор как теплоноситель для подогрева реакционной массы.
|
