Ученица 8 класса а моу сш р п. Сурское Бубнова Наталья Учитель химии Кузнецова Л. В
 Скачать 0.6 Mb. Скачать 0.6 Mb.
|
Муниципальное общеобразовательное учреждение средняя школа р.п. Сурское   Выполнила: Ученица 8 класса А МОУ сш р.п.Сурское Бубнова Наталья Руководитель: Учитель химии Кузнецова Л.В. 2018 год Содержание:
Введение Из меня состоит все живое, Я графит, антрацит и алмаз, Я на улице, в поле и в школе Я в деревьях и в каждом из вас! Актуальность выбранной темы: В этом году мы начали изучать химию. Я решила поближе познакомиться с элементом, обладающим удивительными свойствами – углеродом! Трудно найти химический элемент, который в виде простого вещества был бы столь же многолик, как углерод. Алмаз, графит, сажа, кокс и активированный уголь – все эти совершенно непохожие друг на друга вещества состоят из одних и тех же атомов углерода, по-разному соединённых друг с другом. Углерод способен образовывать миллионы органических соединений. Его называют царём живой природы, на его основе построена жизнь. Мне стало очень интересно, почему же углерод является жизненно важным для нас? В чём уникальность этого элемента по сравнению с другими? Цель: Изучение аллотропных видоизменений углерода, его строение и свойства. Задачи проекта: Изучить и систематизировать информацию о аллотропных видоизменениях углерода. Получить аморфный углерод – древесный уголь. Исследовать адсорбционную способность древесного угля (активированного угля) Основной вопрос проекта: Почему вещества, имеющие одинаковый качественный состав обладают разными свойствами. Для достижения поставленных задач использовали следующие приёмы и методы: - изучение литературы - практическая работа - наблюдение и анализ явлений адсорбции Я предположила, что… Гипотеза: Причина многообразия веществ в атоме углерода. Теоретическая часть. Информационный этап 1. Анкетирование. На этапе сбора материала, я хотела узнать, что ребята знают об углероде. Я подготовила небольшую анкету. В результате обработки ответов я получила следующее: Знаете ли вы, что углерод составляет основу всех живых организмов? 15 человек дали положительный ответ, 1 учащийся – отрицательный. 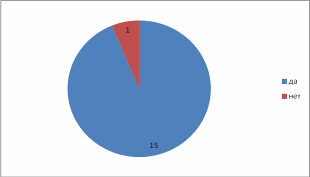 Где встречается углерод? Повсюду – ответили 13% опрошенных Составляет основу живых организмов – 87% опрошенных 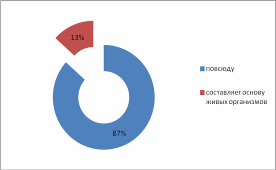 Алмаз, графит, сажа, древесный уголь – это углерод? Ответ на этот вопрос был 100% да 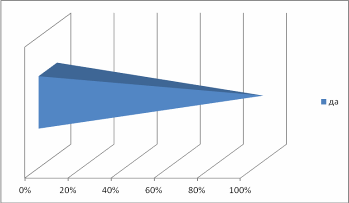 Слышали ли вы про явление адсорбция? 6 человек дали определение явления адсорбция, это составило 38% опрошенных 9 человек знают что это за явление – 56% опрошенных 1 человек (6% опрошенных) не знает что такое адсорбция 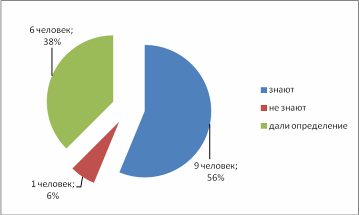 Какое значение имеет и где используется адсорбция? Адсорбция используется в медицине – ответили 15 человек, везде – 1 человек Определить ее значение участники опроса затруднились 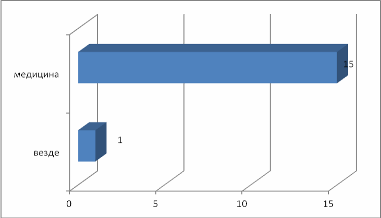 2.1. Историческая справка. Углерод – один из немногочисленных элементов «без роду, без племени». История общения человека с этим веществом уходит во времена доисторические. Имя первооткрывателя углерода неизвестно, неизвестно и то, какая из форм элементного углерода – алмаз или графит была открыта раньше. И то и другое случилось слишком давно. Определённо утверждать можно лишь одно: до алмаза и до графита был открыт уголь. Углём рисовали ещё в каменном веке. Росписи известных пещер Альтамира в Испании, созданные 20 тысяч лет назад, выполнены углём. На рубеже XVII—XVIII вв. возникла теория флогистона, выдвинутая Иоганном Бехером и Георгом Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества — невесомого флюида — флогистона, улетучивающегося в процессе горения. Так как при сгорании большого количества угля остается лишь немного золы, флогистики полагали, что уголь — это почти чистый флогистон. Именно этим объясняли, в частности, «флогистирующее» действие угля, — его способность восстанавливать металлы из «известей» и руд. Позднейшие флогистики, Реомюр, Бергман и другие, уже начали понимать, что уголь представляет собой элементарное вещество. Однако впервые таковым «чистый уголь» был признан Антуаном Лавуазье, исследовавшим процесс сжигания в воздухе и кислороде угля и других веществ. В книге Гитона де Морво, Лавуазье, Бертолле и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерод» (carbone) вместо французского «чистый уголь» (charbone pur). Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье. В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокалённым мелом, в результате чего образовывались фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно. Ещё в 1751 г. германский император Франц I согласился дать алмаз и рубин для опытов по сжиганию, после чего эти опыты даже вошли в моду. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины и пришёл к выводу, что алмаз представляет собой кристаллический углерод. В XVIII веке Антуан Лоран Лавуазье, изучая горение угля на воздухе и в кислороде, пришёл к выводу, что уголь – всего лишь простое вещество, и назвал новый элемент Carboneum (от латинского «Carbo» - уголь). 2.2 Нахождение в природе. Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½= 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения на ядра азота по реакции: 14N (n, p) 14C, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб. Содержание углерода в земной коре 0,15555555 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94—97 % С), бурые угли (64—80 % С), каменные угли (76—95 % С), горючие сланцы (56—78 % С), нефть (82—87 % С), горючих природных газов (до 99 % метана), торф (53—56 % С), а также битумы и др. В атмосфере и гидросфере находится в видедиоксида углерода СО2, в воздухе 0,046 % СО2 по массе, в водах рек, морей и океанов в 60 раз больше. Углерод входит в состав растений и животных (17,5 %). В организм человека углерод поступает с пищей (в норме около 300 г в сутки). Общее содержание углерода в организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани. Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина). Способность углерода образовывать полимерные цепочки порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимается органическая химия. Среди них наиболее обширные группы: углеводороды, белки, жиры и др. Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %. 2.3. Положение а периодической системе химических элементов.   2.4. Аллотропные изменения. Вспомним, что такое аллотропия? Это способность атомов одного элемента образовывать несколько простых веществ. Явление аллотропии обусловлено в одних случаях тем, что молекулы простого вещества состоят из различного числа атомов (О, О2, О3), в других - тем, что их кристаллы имеют различное строение (алмаз, графит, карбин). То есть один и тот же элемент образует разные вещества. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. 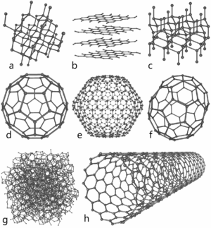 a: алмаз, b: графит, c: лонсдейлит, d: фуллерен — бакибол C60, e: фуллерен C540, f: фуллерен C70, g: аморфный углерод, h: углеродная нанотрубка Кристаллический углерод Алмаз Графит Карбин Лонсдейлит Наноалмаз Фуллерены Фуллерит Углеродное волокно Углеродные нановолокна Углеродные нанотрубки Аморфный углерод Активированный уголь Древесный уголь Ископаемый уголь: антрацит Кокс каменноугольный, нефтяной Стеклоуглерод Техуглерод Сажа Углеродная нанопена На практике, как правило, перечисленные выше аморфные формы являются химическими соединениями с высоким содержанием углерода, а не чистой аллотропной формой углерода. Кластерные формы Астралены Диуглерод Углеродные наноконусы Основные и хорошо изученные аллотропные модификации углерода — алмаз и графит. Более и менее изучены карбин и фуллерен. Алмаз. Алмаз – прозрачное кристаллическое вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая по десятибалльной системе оценивается высшим баллом 10. Такая твердость алмаза обусловлена особой структурой его атомной кристаллической решетки. В ней каждый атом углерода окружен такими же атомами, расположенными в вершинах правильного тетраэдра. Кристаллы алмаза обычно бесцветные, но бывают синего, голубого, красного и черного цветов. Они имеют очень сильный блеск благодаря высокой светопреломляющей и светоотражающей способности. Само слово «алмаз» происходит от арабского алмас, что означает «твердейший», или от греческого слова адамас, т.е. «несокрушимый, непреодолимый». Алмаз известен людям с незапамятных времен. Старинные легенды позволяют предполагать, что первые находки алмазов в Индии относятся к третьему тысячелетию до нашей эры. Не менее чем за пять веков до начала современного летосчисления с алмазом познакомились древние греки, поскольку к этому времени относится греческая бронзовая статуэтка, глазами которой служат два неотшлифованных алмаза. Высказываются предположения, что в Грецию алмазы были завезены из Индии. В Европу заметное количество индийских алмазов начало поступать только в XIII в. Долгое время исключительно высокая твердость камня являлась непреодолимым препятствием для европейских ювелиров, и все попытки обработать этот минерал терпели неудачу. Лишь в середине XV в. голландцу Ван-Беркену удалось огранить алмазы, шлифуя их друг о друга. Долго оставался неизвестным и химический состав таинственного камня, не поддававшегося воздействию самых сильных кислот и щелочей. Некоторые ученые даже думали, что алмаз состоит из особого химического элемента - алмазной земли. В середине XVII в. во Флоренции ставились опыты по нагреванию в закрытых сосудах алмазов и рубинов. При этом было установлено, что рубины не претерпевали никаких изменений, а от алмазов не оставалось "ни малейшего следа". Это казалось совершенно необъяснимым, и лишь много позднее выяснилось, что кристаллы алмаза, нагреваемые в окружении кислорода, попросту сгорают. Показательное сжигание алмаза в конце XVIII в. было проведено в Петербургском горном училище (ныне Ленинградский горный институт). Этот опыт, по-видимому, имел целью доказать невозможность искусственного получения крупных алмазов путем сплавления мелких кристаллов. К этому же времени относятся многочисленные опыты по сжиганию алмазов, проводившиеся в различных странах Западной Европы. Большое внимание этим опытам уделял и знаменитый французский химик А. Лавуазье, поскольку "бесследное" исчезновение алмаза при нагревании противоречило закону сохранения материи. Он смог определенно сказать лишь то, что алмаз принадлежит к классу горючих тел и что продуктом сгорания его является газообразное вещество. Отметив возможное родство алмаза с углеродом, ученый все же не решился отождествить сверкающий камень с углем и не сделал окончательного вывода о составе алмаза. Он писал, что, может быть, никогда нельзя будет определить состав этого минерала. Однако уже на рубеже XVIII и XIX вв. химическая природа алмаза была точно установлена. Английский химик П. Теннан в 1797 г. сжег алмаз в плотно закрытом золотом сосуде, заполненном кислородом, и установил, что образовавшийся при этом газ является двуокисью углерода. Поскольку первоначально в сосуде кроме алмаза и кислорода ничего не было, то, следовательно, алмаз в химическом отношении является чистым углеродом. Чтобы окончательно убедиться в правильности сделанного вывода, П. Теннан определил количество углерода в заполняющем сосуд углекислом газе. Оказалось, что оно в точности соответствует массе сгоревшего алмаза. Исключительную по своей прозорливости мысль высказал М. В. Ломоносов: причиной необычайной твердости алмаза является "сложение его из частиц, тесно соединенных". Предвидение гениального ученого подтвердилось почти через два столетия, в начале XX в., когда с помощью рентгеновских лучей удалось расшифровать атомную структуру алмаза и графита. Были установлены существенные различия в пространственном расположении слагающих эти вещества элементарных частиц - атомов. В алмазе атомы углерода размещаются очень плотно, причем каждый из них прочно связан с четырьмя окружающими его атомами (рис. 1). 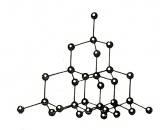 Рис. 1. Атомная структура алмаза Хотя алмаз в чистом виде состоит только из атомов углерода, реальные природные кристаллы этого минерала постоянно содержат примеси других веществ. Минимальные количества примесей характерны для бесцветных и слабоокрашенных прозрачных алмазов. При сжигании таких камней количество золы не превышает 0,02-0,05% от их массы. В замутненных и особенно в непрозрачных разновидностях алмаза содержание золы достигает нескольких процентов. Спектральным анализом в составе золы установлены кремний, магний, кальций, алюминий, железо, титан и некоторые другие химические элементы. Наряду с мельчайшими включениями в алмазах нередко присутствуют и сравнительно крупные посторонние частицы: чаще всего графит, несколько реже минералы, являющиеся по химическому составу силикатами (оливин, пироксены), алюмосиликатами (гранаты) и сложными окислами (хромшпинелиды). В крупных кристаллах алмаза довольно обычны также включения его мелких кристалликов. Плотность алмаза около 3,52. Эта величина типична для чистых хорошо образованных кристаллов. У мелкозернистых агрегатов, часто содержащих включения графита и обладающих не вполне массивным сложением, плотность существенно ниже и у отдельных разновидностей карбонадо опускается до 3,0. Для сравнения укажем, что плотность графита не превышает 2,23. Таким образом, "рыхлость" атомной структуры графита привела к более чем полуторакратному снижению плотности. Цвет и особенности светопреломления алмаза рассмотрены в предыдущей главе, а здесь мы остановимся еще на одном весьма интересном и важном его свойстве, которое также тесно связано с внутренним строением. Речь пойдет о люминесценции. Люминесценцией называется способность некоторых природных и синтетических веществ светиться под действием рентгеновских, ультрафиолетовых и катодных лучей, что принято обозначать специальными терминами: рентгенолюминесценция, фотолюминесценция, катодолюминесценция. Наиболее изучены рентгено- и фотолюминесценция алмаза, которые используются при проведении геологопоисковых работ, о чем подробнее рассказывается в заключительных главах. Некоторые исследователи связывают люминесценцию с присутствием посторонних примесей, другие указывают на причинную связь этого явления со специфическими особенностями кристаллической решетки минерала. Чистые кристаллы прозрачны не только для световых, но и для рентгеновских лучей, что позволяет легко определять алмазы среди сходных по внешнему облику минералов, а также отличать бриллианты от всевозможных подделок. А вот ультрафиолетовые лучи многие алмазы совершенно не пропускают. Твердость является, как уже отмечалось, весьма важным свойством алмаза, определяющим его исключительно большую роль в производственной деятельности человека. Под твердостью обычно подразумевается сопротивление одного тела проникновению в него другого. Для качественного определения относительной твердости минералов широко используется так называемая шкала твердости (шкала Мооса), предложенная в начале XIX в. Шкала включает десять минералов-эталонов, расположенных в порядке возрастания твердости. При этом порядковые номера эталонов принимаются в качестве баллов твердости. Минералогическая шкала твердости
Твердость веществ на основе шкалы Мооса определяют, с усилием проводя ребром или острым сколом изучаемого объекта по гладкой поверхности какого-либо эталонного минерала. Если вещество тверже взятого эталона, то на поверхности последнего остаются бороздки, царапины. При меньшей твердости изучаемого вещества относительно минерала-эталона оно не оставляет царапин на его поверхности. При равной твердости объекта и эталона неглубокие царапинки остаются на каждом из них. Алмаз, обладающий наивысшей твердостью, оставляет глубокие борозды на всех минералах и при этом сам не претерпевает ни малейших изменений. 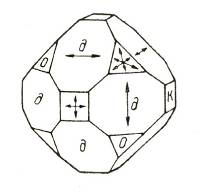 Рис. 3. Направления наименьшей твердости (стрелки) на различных гранях природных кристаллов алмаза (по И. И. Шафрановскому) [11]. Буквами обозначены грани: о - октаэдра, д - ромбододекаэдра, к - куба Графит. Рассмотрим модификацию графита. Графит – темно-серое, жирное на ощупь кристаллическое вещество с металлическим блеском. В отличие от алмаза графит мягкий ( оставляет след на бумаге) и не прозрачный, хорошо проводит теплоту и электрический ток. Мягкость графита обусловлена слоистой структурой. В кристаллической решетки графита атомы углерода, лежащие в одной плоскости, прочно связанные в правильные шестиугольники. Связи между слоями малопрочны. Он очень тугоплавок. Из графита изготовляют электроды (вспомните электролитическое получения алюминия), твердые смазки, замедлители нейтронов в ядерных реакторах, стержней для карандашей. При высоких температурах и давлениях из графита получают искусственные алмазы, которые широко применяются в технике. Сходное с графитом строение имеют сажа и древесный уголь. Древесный уголь получают при сухой перегонке древесины. Этот уголь благодаря своей пористой поверхности обладает замечательной способностью поглощать газы и растворенные вещества. Такое свойство и некоторых веществ называется адсорбцией. Чем больше пористость древесного угля, тем эффективнее адсорбция. Чтобы увеличить поглотительную способность , древесный уголь обрабатывают горячим водяным паром. Обработанный таким способом уголь называют активированным. В аптеках его продают в виде черных таблеток карболена. Если бросить кусочки активированного угля в колбу с бурым газом NO2, то бурая окраска в колбе исчезнет. На поглотительной способности активированного угля основано действие противогазов – устройств для защиты от вредных примесей, имеющихся в воздухе. Первый противогаз был изобретен выдающимся русским химиком Н.Д. Зелинским и спас жизнь тысячам солдатам в период Первой мировой войне. Совершенно иной вид имеет кристаллическая решетка графита. Структура ее образована параллельными слоями сеток, состоящих из шестиугольников с атомами углерода в вершинах. Слои отстоят на 3,39 Å (Å - сокращенное обозначение единицы длины, равной 10-8 см, которая называется "ангстрем") один от другого и последовательно сдвинуты, так что в проекции совмещается только половина атомов углерода, а остальная часть их проецируется в центре ячеек сетки нижних и верхних слоев (рис. 2). Связь между слоями атомов в графите осуществляется посредством легкоподвижных электронов. Такая связь придает веществу металлические свойства: непрозрачность, блеск, высокую электропроводность. Атомы в каждом отдельно взятом слое связаны достаточно прочно, а связь между слоями слабая. Этим обусловливается весьма высокая способность расщепляться на тонкие пластинки и чрезвычайно малая твердость графита по направлению, параллельному слоистости кристаллической решетки минерала. 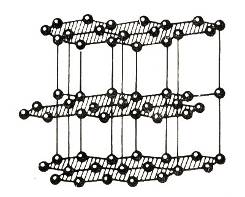 Рис. 2. Атомная структура графита Образование одинаковых по химическому составу веществ, различающихся кристаллической структурой решетки, называется полиморфизмом, а сами такие вещества называются полиморфными модификациями. Следовательно, алмаз и графит являются полиморфными модификациями углерода. Таким образом, алмаз и графит состоят из одного химического элемента - углерода. Карбин. Кристаллическая модификация углерода гексагональной сингонии с цепочечным строением молекул называется карбин. Цепи имеют либо полиеновое строение (—C≡C—), либо поликумуленовое (=C=C=). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см³). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов или CCl4 в низкотемпературной плазме. Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9—2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно или тройными и одинарными связями (полиеновое строение), либо постоянно двойными связями (поликумуленовое строение). Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. в Институте элементоорганических соединений Академии наук СССР[8]. Карбин обладаетполупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах. Фуллерен. Углерод известен также в виде кластерных частиц С60, С70, C80, C90, C100 и подобных (фуллерены), а также графенов, нанотрубок и сложных структур — астраленов. Аморфный углерод. В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, техуглерод, сажа, активный уголь. Графен (англ. graphene) — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp² связей в гексагональную двумерную кристаллическую решётку. Фуллерен, бакибол и букебол – молекулярное соединение, принадлежащее классу аллотропных форм углерода и представляющее собой выпуклые замкнутые многогранники. Своим названием фуллерены обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру, чьи геодезические конструкции построены по этому принципу. Первоначально данный класс соединений был ограниче6н структурами, включающими только пяти- и шестиугольные грани. Следует отметить, что открытие фуллеренов имеет свою предысторию: возможность их существования была предсказана ещё в 1971 году в Японии и теоретически обоснованна в 1973 году в СССР. За открытие фуллеренов Крото, Смолли и Кёрлу в 1996 году была присуждена Нобелевская премия по химии. Единственным способом получения фуллеренов в настоящий момент ( октябрь 2007 года) является их искусственный синтез. В течение ряда лет эти соединения интенсивно изучали в лабораториях разных стран, пытаясь установить условия их образования, структуру, свойства и возможные сферы применения. Установлено, в частности, что фуллерены в значительном количестве содержатся в саже, образующейся в дуговом разряде на графитовых электродах – их раньше просто не замечали. Таблица. Сопоставление некоторых свойств алмаза и графита.
2.5. Применение аллотропных видоизменений и биологическое применение. Графит используют в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления позволяет делать из него тигли для заливки металлов. Способность графита проводить электрический ток также позволяет изготавливать из него высококачественные электроды. Алмаз благодаря исключительной твердости — незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты — используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводностьалмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая себестоимость добычи алмазов ($97,47 за один карат) и сложность обработки алмаза ограничивают его применение в этой области. В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для адсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ). Углерод играет огромную роль в жизни человека. Его применения столь же разнообразны, как сам этот многоликий элемент. В частности, углерод является неотъемлемой составляющей стали (до 2,14 % масс.) и чугуна (более 2,14 % масс.) Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти. Углерод в виде ископаемого топлива: угля и углеводородов (нефть, природный газ) – один из важнейших источников энергии для человечества. Токсическое действие. Углерод входит в состав атмосферных аэрозолей, в результате чего может изменяться региональный климат, уменьшаться количество солнечных дней. Углерод поступает в окружающую среду в виде сажи[ в составе выхлопных газов автотранспорта, при сжигании угля на ТЭС, при открытых разработках угля, подземной его газификации, получении угольных концентратов и др. Концентрация углерода над источниками горения 100—400 мкг/м³, крупными городами 2,4—15,9 мкг/м³, сельскими районами 0,5 — 0,8 мкг/м³. С газоаэрозольными выбросами АЭС в атмосферу поступает (6—15)·109 Бк/сут 14СО2. Высокое содержание углерода в атмосферных аэрозолях ведет к повышению заболеваемости населения, особенно верхних дыхательных путей и легких. Профессиональные заболевания — в основном антракоз и пылевой бронхит. В воздухе рабочей зоны ПДК, мг/м³: алмаз 8,0, антрацит и кокс 6,0, каменный уголь 10,0, технический углерод и углеродная пыль 4,0; в атмосферном воздухе максимальная разовая 0,15, среднесуточная 0,05 мг/м³. Токсическое действие 14С, вошедшего в состав биологических молекул (особенно в ДНК и РНК), определяется его радиационным взаимодействием с β-частицами (14С (β) → 14N), приводящим к изменению химического состава молекулы. Допустимая концентрация 14С в воздухе рабочей зоны ДКА 1,3 Бк/л, в атмосферном воздухе ДКБ 4,4 Бк/л, в воде 3,0·104 Бк/л, предельно допустимое поступление через органы дыхания 3,2·108 Бк/год. Практическая часть. Экспериментальный этап. 1. Получение древесного угля. Сырьё: древесина ( лучше берёза). Химический процесс: Термическая обработка без доступа кислорода.          2. Активизация угля водяным паром ( древесный уголь становится активированным углём).   2. Исследование адсорбционной способности активированного угля. Адсорбция активированным углём различных веществ из растворов. Взяла 6 образцов жидкости: Компот из крыжовника Компот из чёрной смородины Сок «Любимый» Яблоко и персик Лимонад «Радуга» Cola Classic Чай Раствор Перманганата калия (Марганцовка)  Добавила таблетки активированного угля     В эти же образцы добавила растолченного нагретого активированного угля   Через несколько часов я получила такие результаты:  В  оспользовавшись воронкой и медицинской ватой, я профильтровала полученный раствор оспользовавшись воронкой и медицинской ватой, я профильтровала полученный раствори получила следующее:  Быстрее всего явление адсорбции проявилось в образце №3 - сок «Любимый» Яблоко и персик.       Из этого эксперимента можно сделать вывод, что все образцы содержат красители. В случае образцов № 1, 2 – это природные красители, № 3, 4, 5,6 – это искусственные красители Образец № 4 (Лимонад «Радуга» Cola Classic) явления адсорбции наглядно не показал (его цвет изменился незначительно)   Но поскольку, всем известно, что этот напиток содержит красители, я решила, что для адсорбции более сильного и качественного красителя нужно большее время, и оставила этот образец на более длительное время. Через 2 дня я получила такой результат: Пропустив раствор через вату, получила следующее:   С раствором перманганата калия (марганцовки) я решила поэкспериментировать.  Суть эксперимента состояла в том, что в один образец я положила активированный уголь как и во все другие образцы (из аптеки)    А в другой образец уголь полученный и активированный мной.  Результат превзошел мои ожидания.  Получилось, сто «мой» уголь адсорбировал марганцовку лучше и быстрее, чем аптечный.  Выводы по экспериментальной части: Итак, я смогла: Практически в школьной лаборатории получить древесный уголь и сделать его активированным; Проверить адсорбционную способность активированного угля дома; Изучила поглотительную способность активированного угля частиц красящих органических веществ из образцов: компот из крыжовника, компот из чёрной смородины, сок «Любимый» Яблоко и персик, лимонад «Радуга» Cola Classic, чай, перманганат калия (Марганцовка) В ходе исследования я обнаружила, что активированный уголь полученный в школьной лаборатории или дома обладает большей адсорбционной способностью, по сравнению с активированным углём из аптеки и что не все вещества полностью адсорбируются активированным углём. Одной из причин того, что эти вещества остались в растворе и окраска не изменилась может быть: 1) то, что размеры молекул этих веществ больше, чем размеры адсорбента; 2) а так же, между молекулами вещества и поверхностью пор активированного угля не возникли силы притяжения. Всё это привело к мысли, о дальнейшем исследовании в будущем: « Как улучшить адсорбционную ( поглотительную) способность активированного угля?» Заключение При работе над проектом я узнала много интересного о простых веществах, в виде которых углерод встречается в природе. При изучении различного материала, убедилась в том, что жизнь без углерода не возможна, так как он составляет основу всех живых организмов и содержится во многих веществах неживой природы. Из достоверных источников я выделила причину многообразия аллотропных видоизменений углерода. Изучив поглотительную способность активированного угля, я пришла к выводу о значимости адсорбции в связи с решением экологических проблем и проблем получения особо чистых веществ. На сегодняшний день активированные угли выпускают в большом количестве и ассортименте. Ему нашли применение в следующих областях: очистка питьевой и сточных вод; очистка оборотных вод на предприятиях; осветление сахарных сиропов; очистка газов и рекуперация паров; получение медикаментов; очистка спиртоводных растворов и вин; использование в качестве катализаторов и носителей катализаторов; в золотодобывающей промышленности для извлечения золота из рабочих растворов. Я считаю, что знания, полученные при создании проекта, помогут мне принимать самостоятельные, аргументированные решения. Вывод: Итак, моя гипотеза о том, что причина многообразия веществ в атоме углерода, подтвердилась. Она состоит в следующем: 1. Углерод – друг с другом образует цепи разной длины и формы; 2. Углерод способен друг с другом соединяться одинарными, двойными и тройными связями; 3. Углерод легко взаимодействует с другими элементами. В ходе работы смогла ответить на такой вопрос: «Почему же эта маленькая чёрная таблеточка способна так эффективно поглощать различные вещества?» Всё дело в особой углеродной структуре, которая представляет собой слои атомов углерода, расположенных хаотично относительно друг друга, из-за чего между слоями образуется пространство – поры. Эти поры как раз и придают активированному углю его свойства – поры способны поглощать и удерживать в себе другие вещества. И пор этих невероятное количество. Так, площадь всего 1 грамма активированного угля может доходить до 2000м2! Литература Берёзкин В. И. Углерод: замкнутые наночастицы, макроструктуры, материалы. Бухаркина Т. В. Химия природных энергоносителей и углеродных материалов Ольгин О. "Опыты без взрывов" Подобудчик В.З. «Об алмазе и графите» Сладков А. М., Кудрявцев Ю. П. Алмаз, графит, карбин — аллотропные формы углерода. Шабалина Н.К. «Углерод» Информационные ресурсы http://www.periodictable.ru/006C/C_exp.html http://www.brilliant-info.ru/01history.html http://juwelir.info/index.php/kamny/vmiresamocvetov/866-nekotorye_istoricheskie_almazy_i_drugie_zamechatel_nye_kamni https://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4 http://alhimikov.net/element/C.html |
