Химия итог. Утверждаю Зав кафедрой общей и биологической химии, д б. н., профессор К. С. Эльбекьян 2015г. Итоговое тестирование по дисциплине Общая и неорганическая химия для студентов 190 группы
 Скачать 214.5 Kb. Скачать 214.5 Kb.
|
|
10. «Коэффициент активности» - это: 1) отношение числа активных соударений ионов к общему числу ионов в растворе; 2) отношение скоростей движения ионов в растворе в зависимости от их заряда; 3) отклонение поведения ионов в растворе от их поведения в растворе при бесконечном разбавлении; 4) отклонение скоростей диффузии ионов от «идеальной» скорости при отсутствии межионных взаимодействий 11. «Активность иона» - это: 1) максимальная скорость движения иона в электрическом поле; 2) отношение скорости движения иона в растворе к скорости в вакууме; 3) концентрация иона, в соответствии с которой он участвует в ионных взаимодействиях; 4) эффективная концентрация иона, в соответствии с которой он участвует в различных процессах 12. Понятию «ионная сила» соответствует определение: 1) сумма произведений концентраций ионов на их заряд; 2) полусумма произведений концентраций ионов на их заряд; 3) полусумма произведений квадрата концентраций ионов на их заряд; 4) полусумма произведений концентраций ионов на квадрат их заряда 1 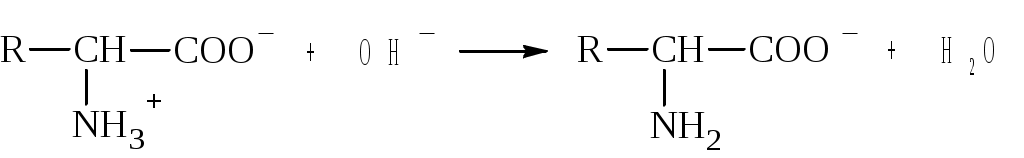 3. В реакции 3. В реакции молекула белка с позиций теории Бренстеда является: 1) акцептором электронной пары; 2) донором электронной пары; 3) основанием; 4) кислотой 14. Сила кислот HCN ( 1) CH3COOH > H2CO3 > HCN; 2) HCN > CH3COOH > H2CO3; 3) CH3COOH > H2CO3 > HCN; 4) CH3COOH > H2CO3 > HCN 15. Кислотой Льюиса является частица 1) образующая при диссоциации ион H+ ; 2) имеющая неспаренный электрон; 3) способная принимать электронную пару; 4) обладающая повышенной электронной плотностью 16. Основанием Льюиса является частица 1) образующая при диссоциации ион OH; 2) обладающая свободной электронной орбиталью для образования ковалентной связи; 3) способная отдавать электронную пару для образования ковалентной связи; 4) обладающая повышенной подвижностью в водных растворах 17. Основанием Бренстеда является частица 1) обладающая пониженной подвижностью в растворах; 2) способная присоединять протон; 3) имеющая свободную орбиталь; 4) образующая при диссоциации ион OH 18. Математическая форма закона разведения Оствальда имеет вид: 1) 19. Понятию «константа диссоциации» соответствует определение: 1) отношение числа распавшихся молекул к общему числу молекул в растворе; 2) отношение числа продиссоциировавших молекул к числу молекул, не подвергшихся диссоциации; 3) отношение концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части молекул; 4) стехиометрическое отношение произведения концентраций ионов, образовавшихся в результате диссоциации, к концентрации недиссоциированной части электролита 20. Понятию «степень диссоциации» соответствует определение 1) стехиометрическое отношение концентраций образовавшихся ионов; 2) отношение концентрации анионов к концентрации недиссоциированной части молекул; 3) отношение числа диссоциированных молекул к числу недиссоциированных молекул; 4) отношение числа диссоциированных молекул к общему числу молекул растворенного вещества 2  1. Согласно теории Бренстеда- Лоури в реакции H3O+ H+ + H2O молекула H2O по отношению к иону H3O+ является: 1. Согласно теории Бренстеда- Лоури в реакции H3O+ H+ + H2O молекула H2O по отношению к иону H3O+ является: 1) акцептором электронной пары; 2) кислотой; 3) сопряженной кислотой; 4) сопряженным основанием 22. Протолитическая реакция CH3COOH + H2O ↔ H3O+ + CH3COO- является реакцией 1)ионизации; 2)нейтрализации; 3)гидролиз по аниону; 4)гидролиз по катиону 23. Протолитическая реакция CN- + H3O+ ↔ HCN + H2O является реакцией 1)ионизации; 2)нейтрализации;3) гидролиз по катиону4) гидролиз по аниону 24. Значение pOH раствора при pH = 7,5 равно 1). 7 2). 14 3). 6,5 4). 0,5 ОТВЕТЫ 1-3; 2-3; 3-1; 4-1; 5-3; 6-3; 7-2; 8-4; 9-3; 10-3; 11-4; 12-4; 13-4; 14-4; 15-3; 16-3; 17-2; 18-4; 19-4; 20-4; 21-2; 22-1; 23-2; 24-3. буферные системы 1.При добавлении НСl к буферной системе НРО42-/Н2РО4-: 1)активная концентрация НРО42-увеличивается, Н2РО4- - уменьшается; 2)активная концентрация НРО42- уменьшается, Н2РО4- - увеличивается; 3)активности компонентов не изменяются. 2.Максимаьную буферную ёмкость системы имеют при: 1)рН = pKa; 2)рН > рKa; 3)pH < pKa; 4)эти параметры не взаимосвязаны друг с другом. 3.Максимальной буферной ёмкостью при физиологическом значении рН обладает кислотно-основная сопряженная пара: 1)Н3РО4/Н2РО4-, рКа (Н3РО4) = 2,1; 2)Н2РО4-/НРО42-, рКа (Н2РО4-) = 6,8; 3)НРО42-/РО43-, рКа (НРО42-) = 12,3. 4.При одинаковых концентрациях компонентов буферная ёмкость: 1)максимальна, т. к. рН = pKa; 2)максимальна, т. к. рН > pKa; 3)минимальна, т. к. рН = pKa; 4)буферная ёмкость не зависит от соотношения концентраций компонентов. 5.Буферная ёмкость при разбавлении растворов: 1)уменьшается, вследствие уменьшения концентрации всех компонентов системы; 2)увеличивается, т. к. возрастает степень диссоциации электролитов; 3)не изменяется, т. к. соотношение концентраций компонентов остается постоянным; 4)практически не изменяется, т. к. количество компонентов системы остается неизменным. 6.Ацидоз - это: 1)уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой; 2)увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой; 3)увеличение основной буферной ёмкости физиологической системы по сравнению с нормой. 7.Алкалоз - это: 1)уменьшение кислотной буферной ёмкости физиологической системы по сравнению с нормой; 2)увеличение кислотной буферной ёмкости физиологической системы по сравнению с нормой; 3)уменьшение основной буферной ёмкости физиологической системы по сравнению с нормой. 8.Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары: 1)Н3РО4 - кислота, Н2РО4- - сопряженное основание; 2)Н2РО4- - кислота, НРО42- - сопряженное основание; 3)НРО42- - кислота, РО43- - сопряженное основание; 4)Н3РО4 - кислота, РО43-- сопряженное основание. 9.При рН > рI белковый буфер будет состоять из сопряженной кислотно-основной пары: 1)биполярной молекулы белка NH3+—Prot—COO- и катиона белка NH3+—Prot—COOH; 2)биполярной молекулы белка NH3+—Prot—COO- и аниона белка NH2—Prot—COO-; 3)аниона белка NH2—Prot—COO- и катиона белка NH3+—Prot—COOH; 4)белка NH2—Prot—СООН и аниона белка NH2—Prot—COO-. 10.При рН < pI белковый буфер будет состоять из сопряженной кислотно-основной пары: 1)биполярной молекулы белка NH3+—Prot—COO- и катиона белка NH3+—Prot—COOH; 2)биполярной молекулы белка NH3+—Prot—COO- и аниона белка NH2—Prot—COO-; 3)аниона белка NH2—Prot—COO- и катиона белка NH3+—Prot—COOH; 4)белка NH2—Prot—СООН и катиона белка NH3+—Prot—COOH. 11.При рН > рI глицин образует сопряженную кислотно-основную пару: 1)NH3+– СН2 – COO-/NH2 – СН2 – СОО-; 2)NH3+– СН2 – COO-/NH3+– СН2 – СООН; 3)NH2 – СН2 – СООН/NH2 – CH2 – COO-; 4)NH2 – CH2 – COO-/NH3+– СН2 – СООН. 12.При рН < рI глицин образует сопряженную кислотно-основную пару: 1)NH3+– СН2 – COO-/NH2 – СН2 – СОО-; 2)NH3+– СН2 – COO-/NH3+– СН2 – СООН; 3)NH2 – СН2 – СООН/NH2 – CH2 – COO-; 4)NH2 – CH2 – COO-/NH3+– СН2 – СООН. 13.Изоэлектрические точки большинства белков плазмы крови лежат в слабокислой среде, рI = 4,9-6,3, поэтому в крови в основном работает: 1)анионный белковый буфер; 2)катионный белковый буфер; 3)форма компонентов буфера не зависит от значения рН. 14.Буферная ёмкость белковой буферной системы крови больше: 1)по кислоте, т. к. в крови работает анионный белковый буфер; 2)по основанию, т. к. в крови работает катионный белковый буфер; 3)по кислоте, т. к. в крови работает катионный белковый буфер; 4)по основанию, т. к. в крови работает анионный белковый буфер. 15.Физиологическое значение рН поддерживается при соотношении компонентов бикарбонатной буферной системы, равном: 1)[НСО3-]/[СО2] = 1:20; 2)[НСО3-]/[СО2] = 4:1; 3)[НСО3-]/[СО2] = 20:1; 4)[НСО3-]/[СО2] = 1:4. 16.Физиологическое значение рН поддерживается при соотношении компонентов фосфатной буферной системы, равном: 1)[НРО42-]/[Н2РО4-] = 4:1; 2)[НРО42-]/[Н2РО4-] = 20:1; 3)[Н2РО4-]/[НРО42-] = 4:1; 4)[НРО42-]/[Н2РО4-] = 1:20. 17.При физиологическом значении рН соотношение концентраций компонентов в гидрокарбонатной буферной системе крови [НСО3-]/[СО2] = 20:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию: 1)больше; 2)меньше; 3)их значения равны. 18.При физиологическом значении рН соотношение концентраций компонентов в фосфатной буферной системе крови [НРО42-]/[Н2РО4-] = 4:1. Следовательно, буферная ёмкость этой системы по кислоте в сравнении с буферной ёмкостью по основанию: 1)больше; 2)меньше; 3)их значения равны. 19.У больных сахарным диабетом за счёт накопления в организме β-гидроксимасляной кислоты развивается: 1)метаболический алкалоз; 2)респираторный алкалоз; 3)метаболический ацидоз; 4)респираторный ацидоз. 20.Фосфатная буферная система действует: 1)в плазме крови; 2)в плазме крови и во внутренней среде эритроцитов; 3)во внутренней среде эритроцитов. 21.Гемоглобиновая буферная система действует: 1)в плазме крови; 2)в плазме крови и во внутренней среде эритроцитов; 3)во внутренней среде эритроцитов. 22.Наиболее быстродействующей в организме является буферная система: 1)фосфатная; 2)гидрокарбонатная; 3)белковая; 4)гемоглобиновая. 23.Максимальный относительный вклад в поддержание протолитического гомеостаза в плазме крови вносит буферная система: 1)гидрокарбонатная; 2)белковая; 3)гидрофосфатная; 4)гемоглобиновая. 24.Максимальный относительный вклад в поддержание протолитического гомеостаза во внутренней среде эритроцитов вносит буферная система: 1)гидрокарбонатная; 2)белковая; 3)гидрофосфатная; 4)гемоглобиновая. 25.Выберите уравнение Гендерсона-Гассельбаха (С). 1)В = Cкис. (щел.) ·Vкис. (щел.)/δpH·Vбуф. р-ра; 2)pH = -lg a(H+); 3)pOH = -lg а(ОН-); 4)рН = pКа + lg Ссоли/рСО2; 5)рН = рКа ± 1; 6)С(Н3О+) = 26.На основе какой системы можно приготовить буферный раствор с рН 7,4? 1)CH3COOH/CH3COONa; 2)H3PO4/KH2PO4; 3)HCl/KCl; 4)КН2РО4/К2НРО4; 5)NH4OH/NH4Cl? ОТВЕТЫ 1 – 2; 2 – 1; 3 – 2; 4 – 1; 5 – 1; 6 – 1; 7 – 2; 8 – 2; 9 – 2; 10 – 1; 11 – 1; 12 – 2; 13 – 1; 14 – 1; 15 – 3; 16 – 1; 17 – 1; 18 – 1; 19 – 3; 20 – 2; 21 – 3; 22 – 2; 23 – 1; 24 – 4; 25 – 4; 26 – 4. Гетерогенные процессы и равновесия 1.Необходимое условие существования гетерогенного равновесия: 1)ненасыщенный раствор соприкасается с твердой фазой данного электролита; 2)насыщенный раствор соприкасается с твердой фазой данного электролита; 3)пересыщенный раствор соприкасается с твердой фазой данного электролита. 2.Если в растворе произведение концентраций ионов в степенях, равных стехиометрическим коэффициентам, больше константы растворимости, то: 1)раствор пересыщен, осадок образуется; 2)раствор ненасыщен, осадок растворяется; 3)раствор насыщен, осадок не выпадает. |
